У кого анализы апластической анемии
Одной из патологий кровеносной системы человеческого организма является апластичекая (гипопластическая) анемия. Причиной тому служит частичная дисфункция, связанная с прекращением выработки важнейших элементов, содержащихся в крови человека. Прекращают вырабатываться тромбоциты, эритроциты, лейкоциты. Апластическая относится к числу редких заболеваний. Однако, риск возникновения подобного недомогания существует у всех возрастных категорий. Следует знать, какие анализы потребуются для выявления недуга. Причины, по которым возникает это заболевание, до конца так и не выяснены. Специалисты смогли выявить факторы, вызывающие предрасположенность к проявлению патологии. Пример: у людей, которые имеют регулярное соприкосновение с химическими веществами, радиоактивным облечением, страдают вирусными инфекциями или генетически предрасположены к патологии, принимают специфические медикаменты, часто наблюдается анемия.
Обследование крови
Проведя общий анализ, медики выявляют показатели, которые могут указывать на пониженное содержание определенных клеток. Пониженное содержание лейкоцита наблюдается в том случае, если присутствует количественное понижение гранулоцита. Следовательно, лейкоцитная формула показывает относительное увеличение процентного содержания моноцита и лимфоцита. Апластическая, именуемая также как гипопластическая, на определенных этапах своего развития способна проявлять различные признаки воспалительного процесса. Чтобы определить степень воздействия таких процессов на организм, потребуется сдать анализы. Кроме сдачи крови, требует также биохимическая проверка. Диагностика показывает, что железо в крови больного имеет завышенные показатели, из-за чего им бывает перенасыщен трансферрин. Расшифровка проверки крови иногда выявляет завышенный фетальный гемоглобин. Повысятся и показатели билирубина в случае гемолиза. Однако, эритропоэтин часто бывает ниже положенной нормы.
Апластическая приводит к понижению количества тромбоцита в крови, что влечет за собой гипокоагуляцию. Диагностикой подобного явления занимается анализна свертываемость. Также изменяются функциональные особенности печени.
Гемолитическая анемия
Основной причиной развития этой патологии является интенсивный распад эритроцита. Ряд факторов, провоцирующих гемолиз: неполноценный характер самого эритроцита в крови (генетическая предрасположенность), воздействие окружающей среды проживания больного (занесение вирусной инфекции через укус змеи или насекомого, применение медикаментов, лечение сердечно сосудистой системы организма). Гемолитическая диагностируется в том случае, если проводится анализ, биохимическое обследование, исследование мочи больного. Гемолитическая показывает понижение эритроцита, уровень гемоглобина колеблется зависимо от возрастной категории. Типология кровообразования не изменяется, эритроциты по своей форме могут различаться: от типичной до более округлой или вытянутой в овал, у детей поднимает содержание ретикулоцита выше 52%.
Если у ребенка диагностирована болезнь, также повышается количество билирубина, в кале обнаруживается высокое содержание стеркобилина, а в моче – концентрация уробилина. Это можно определить благодаря анализам. Когда обнаруживается гемолитическая, специалист может прибегнуть к серологическому обследованию пациента, чтобы обнаружить вероятные антитела в отношении эритроцита. Благодаря генотипированию эта анемия может быть спрогнозирована на предмет осложнений и более соответствующей терапии.
Мегалобластная анемия
В эту группу патологий кровообразования входит и пернициозная.
Одной из наиболее вероятных причин возникновения заболевания является слабое всасывание витамина, обусловленное дисфункцией слизистой желудка.
Мегалобластная группа включает в себя целую группу патологий, отличающихся мегалобластным способом кровообразования. Наряду с тем, что в дефиците находится в 12, образовывается острая нехватка фолиевой кислоты. Чаще всего мегалобластное малокровие возникает по причине нехватки витаминов группы С, врожденной недостаточностью определенных микроэлементов.
Не обязательно проводить общий анализ, чтобы выявилась дефицитная. Недостачу в 12 можно определить по внешним проявлениям у пациента: расстройство желудочно-кишечного тракта, особенности внешнего вида кожного покрова, «лакированный» язык, неврологическое расстройство. Подобным образом проявляется В12. Однако, точная диагностика подразумевает исследование больного в лабораторных условиях и дальнейшая расшифровка показателей. Изучение пункции при нехватке в 12 не требуется. Анализ дает ясное представление: количество эритроцита пониженное, диаметр их тельца превышает 11-12 мкм. При диагностировании ретикулопении отмечается низкое содержание тромбоцита, лейкоцита.
В12 отличается относительным лимфоцитозом. Определить это может анализ на содержание в 12. Скорость опадания эритроцитов повышается. Если выявлена В12, диагностика мочи не определяет существенных отклонений. Биохимическое исследование выявляет билирубин в повышенном содержании, витамин существенно понижен.
В12, качественно диагностируется при использовании миелограммы. При подобном обследовании диагностика выявляет повышенное содержание эритроцита, мегабластное кровообразование, нейтрофилическая гиперсегментация. В12 требует исключительно комплексного подхода к лечению. Учитывается этиология болезни, ее выраженность, неврологическое расстройство. Правильно подобранный рацион питания, повышающий содержание в 12, белков, исключающий употребление алкоголя – неотъемлемое требование, чтобы В12 была вылечена. В12 в этом случае будет вводиться парентеральным образом, что является неотъемлемой частью патогенетической терапии. Необходимо нормализовать все нарушенные гемодинамические показатели. Также следует нейтрализовать существующие антитела, провоцирующие низкое усвоение В12. Чтобы не имела случаев рецидива, необходимо нормализовать сбалансированное питание. Пример: из рыбных и мясных продуктов. Кроме того, нехватка В12 хорошо восполняется молочными и соевыми продуктами.
По заключению анализов при малокровии рекомендуется внутривенное введение препаратов, содержащих витамин до двух раз на протяжении месяца. Пернициозная патология, прежде всего, появляется у людей, полностью отказавшихся от употребления мясных продуктов. Отсутствие в рационе пищи, содержащей В12, приводит к истощению организма недостающим микроэлементом. Определенный период организм в состоянии использовать естественные запасы витамина. Но при развитии дефицита этого вещества образовывается пернициозную. Также эта патология формируется на почве расстройства всасывания В12 в желудке. Пернициозная, крайне негативно отражается на функционировании ЦНС и костного мозга. Имея длительный период развития, наблюдаются сложнейшие патологические эффекты, часто опасные для человека. Пернициозная, как и любая патология, имеет провоцирующие факторы. Диагностика заболевания и расшифровка данных выявляет отклонения работы ЖКТ на предмет язв, гастрита или других заболеваний, нарушающих усвояемость пищи. Кроме того, она нарушает работу печени, вызывает почечную недостаточность.
Железодефицитная анемия
Исходя из названия патологии, становится понятным, что возникает в результате острой нехватки указанного элемента в организме человека. Причиной того, почему образовывается железодефицитная патология, может быть продолжительная потеря крови (менструальные выделения, язвенные очаги, т. п.). Часто диагностика беременных девушек обнаруживает наличие такого заболевания в силу высокой необходимости в микроэлементе на этом жизненном этапе. Железодефицитная при исследовании в лаборатории показывает низкий гемоглобин, также эритроциты и железо в малом количестве. Лечится железодефицитная, посредством использования медикаментов с высоким содержанием железа, перорально или в виде уколов. Расшифровка при ЖДА покажет нарушение морфологической особенности эритроцита и их индекса. Также отличается анизоцитозом – когда эритроциты одного человека отличаются размером друг от друга. Кроме того, патология характеризуется пойкилоцитозом – различие форм эритроцитов одного пациента.
Прогрессирующая железодефицитная во время биохимического обследования крови выявляет сывороточный ферритин довольно низкий, железо в низком количестве, завышенное ОЖСС, трансферрин мало насыщен железом. Железодефицитная имеет три стадии развития: легкая, средняя, тяжелая. При подобном заболевании легкой формы гемоглобин находится в заниженном положении, но выше 88 г/л. Средней формы тяжести удерживает гемоглобин на отметке 72г/л. При тяжелом развитии, она снижает концентрацию гемоглобина ниже 69г/.
Фолиеводефицитная анемия
Общее обследование выявляет пониженное состояние эритроцита. В диаметре этот микроэлемент будет составлять более 12 мкм. Также фолиеводефицитная характеризуется ретикулопенией, понижением тромбоцита и лейкоцита. Кроме указанных проявлений, фолиеводефицитная патология вызывает лимфоцитоз. СОЭ повышает свою интенсивность. Фолиеводефицитная патология входит в подгруппу мегалобластной. Из-за низкого процента фолиевой кислоты деление зрелых кровяных клеток останавливается, развивается фолиеводефицитная.
Гиперхромная группа заболевания характеризуется пониженным количеством эритроцитов. При этом гемоглобиновый уровень практически не изменяется. Следовательно, эритроциты испытывают избыток этого вещества. Поэтому она вызывает насыщеный красный цвет эритроцитов. Диагностированная гипохромная провоцируется пониженным уровнем гемоглобина в эритроцитах. Диагностика заболевания приходит в лабораторных условиях. Расшифровка анализа крови помогает определить, присутствует ли она у пациента. Для этого необходимо определить соотношение эритроцитов, показатель гемоглобина и цвета.
Автор:Е.Кубина
Есть проблемы, запишитесь на прием к врачу.
Источник
На сегодняшний день существует множество различных нарушений в функционировании кровеносной системе человека, которые имеют отличные друг от друга причины возникновения, по-разному проявляются клинически. Различны и прогнозы протекания таких заболеваний. Одним из примеров таких заболеваний является апластическая анемия.
Особенности
Когда человек впервые сталкивается с диагнозом апластическая анемия, естественно, у него сразу возникает вопрос, что это такое? В основе данного заболевания (другое его название – панмиелофтиз) лежит резкое угнетение процессов кроветворения в красном костном мозге, что клинически проявляется в уменьшении в крови содержания форменных ее клеток – эритроцитов, лейкоцитов и тромбоцитов.
Процент выявления апластической анемии среди населения относительно низок и частота выявленных случаев составляет всего 0,5 на 100 тысяч населения. Этот вид анемии не зависит от пола больного человека, но возможно установить некоторую зависимость от возраста.
Начиная с рождения и до 20 лет частота выявленных случаев среди этой возрастной категории постепенно увеличивается; в категории пациентов возрастом от 20 до 55 лет она сохраняется на одном уровне, а вот после 55 лет резко возрастает.
Согласно последним исследованиям в этой области, у небольшой группы пациентов была установлена генетическая предрасположенность к развитию апластической анемии.
Летальный исход наступает у более, чем половины больных. Некоторые источники отмечают, что этот процент достигает отметки 80.
Виды
Согласно МКБ 10-го пересмотра апластическая анемия входит в группу «другие анемии» под кодом D61.
В зависимости от клинической картины проявления заболевания различают:
- Наследственные апластические анемии. Данные патологии приводят к тотальному поражению системы кроветворения. Среди данного вида анемий выделяют два подвида:
- анемии Фанкони – если основное заболевание сопровождается формированием врожденных пороков развития;
- анемии Эстрена – Дамешека – если врожденные пороки отсутствуют;
- анемия Даймонда – Блекфена – форма анемии, при которой отмечается нарушение продукции только эритроцитарных клеток крови, обусловленное генетическими факторами.
- Приобретенные апластические (или гипопластические) анемии. Здесь также различают подвиды:
- формы анемий, которые характеризируются острым, подострым или хроническим процессом угнетения общего кроветворения;
- парциальная (красноклеточная) анемия – угнетается процесс формирования только эритроцитов.
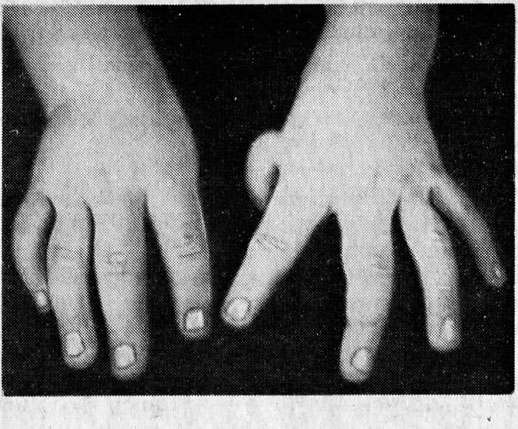 Анемия Фанкони
Анемия Фанкони
Причины
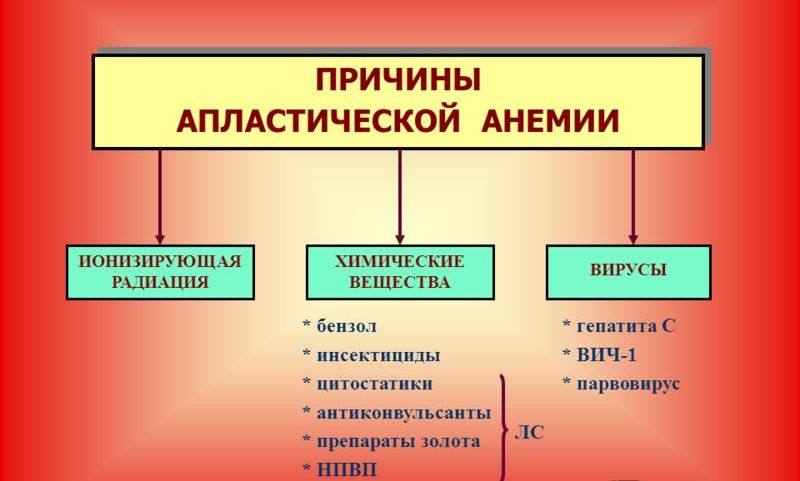
Причины апластической анемией следующие:
- Наличие внешних факторов, которые обладают миелотоксическим эффектом, то есть провоцируют цитостатические нарушения свертываемости крови. Сюда относятся и различные заболевания инфекционной и вирусной природы, и действие ионизирующего излучения, и некоторые лекарственные препараты (анальгин, противотуберкулезные препараты, некоторые виды антибиотиков), а также препараты, применяемые в химиотерапии.
- Эндогенные, то есть внутренние, причины апластической анемии – накопление токсических веществ в результате внутренних нарушений и эндокринных сдвигов, например, в случае развития гипотериоза, уремии.
- Аутоагрессия, когда у больного развивается индивидуальная чувствительность к антигенам и появляются антитела в крови.
- Идиопатические формы апластической анемии. Различают у половины больных, диагностируют в случае, если установить причину развития заболевания не удалось.
 Основные факторы апластической анемии
Основные факторы апластической анемии
На современном этапе специалистам удалось изучить в наибольшей степени только врожденные виды апластических анемий. Так, в случае диагностирования анемии Фанкони причина заключается в изменениях в парных хромосомах I и VII. При анемии Даймонда – Блекфена мутируют гены хромосом I, XVI, XIX, и XIII. Свою роль в этих процессах может сыграть воздействие на организм свободных радикалов.
Процессы развития
Современной медицине пока окончательно не известны механизмы и причины, которые приводят к формированию недоразвития костного мозга.
Выделяют несколько процессов развития апластической анемии:
- Развитие в организме процессов, приводящих к поражению стволовых клеток костного мозга.
- Действие защитных механизмов организма (клеточных, под влияние гормонов), в результате которого процессы образования клеток крови подавляются.
- Различные виды нарушений функционирования элементов микроокружения костного мозга (остеогенные, жировые клетки, макрофаги и другие).
- Недостаток в организме факторов, которые активизируют процессы кроветворения.
- Случаи, когда концентрация необходимых для кроветворения веществ сохраняется на должном уровне (в частности, железо в крови, витамин В12, протопорфирин), но они не усваиваются кроветворной тканью.
В случае развития у человека апластической анемии и поражения костного мозга, происходит разрушение клеток крови различной степени зрелости, но, в первую очередь, страдают эритроциты. Нарушается не только средний объем эритроцитов, но также уменьшается и длительность жизнедеятельности зрелых форм.
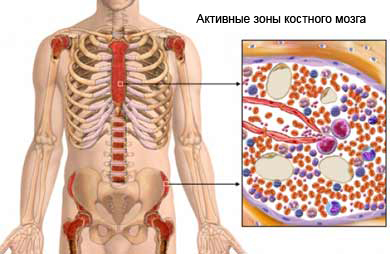 Поражение клеток костного мозга
Поражение клеток костного мозга
Заболевание анемии сопровождается нарушениями процессов выведения излишков железа, которое кумулируется в печени и селезенке.
Из-за понижения лейкоцитов в крови происходят сбои в работе иммунной системе организма. Снижением концентрации тромбоцитов в крови объясняется нарушение процессов свертываемости крови.
Повышение лимфоцитов, Отмечается «опустошение» костного мозга (панмиелофтиз).
Поскольку в крови снижается количество зрелых эритроцитов, это приводит к развитию хронической гипоксии в тканях, что влечет за собой дистрофические изменения внутренних органов. В первую очередь очень чувствительны к гипоксии (кислородное голодание) эндокринные железы.
Симптомы
В зависимости от того, насколько выражены нарушения процессов кроветворения, клинические проявления и симптомы апластической анемии очень разнообразны: различают переходные формы апластической анемии от частичного угнетения процессов образования клеток крови до выраженного недоразвития костного мозга.
В течении заболевания выделяют 3 основных синдрома апластических анемий:
- цитопенический;
- септико – некротический;
- геморрагический.
Эти синдромы анемии могут по-разному проявляться в организме человека в зависимости от степени развития заболевания. Различают 3 этапа развития болезни, при этом симптомы апластической анемии на каждом из них разнятся.
I этап характеризируется проявлением неспецифических симптомов, которые могут быть при любом другом патологическом процессе, — хроническая усталость и общая слабость. Очень часто больные приспосабливаются к существующей у них анемии и обращаются к специалисту только тогда, когда заболевание начнет прогрессировать. Также этот этап характеризуется такими проявлениями геморрагического синдрома, как маточное, носовое кровотечение и повышенная склонность к образованию кровоподтеков (синяки на теле без причины).
На II этапе у больных болеющие апластической анемией отмечается бледность кожи и видимых слизистых оболочек, также иногда могут возникать кровоподтеки. Если заболевание переходит в острую форму, помимо бледности кожных покровов также наблюдают геморрагический шок, некроз слизистых оболочек и высокую температуру. В организме активизируются различные воспалительные процессы (в частности, пневмония).
Обычно печень и селезенка не увеличиваются, но если диагностируют аутоиммунную форму апластической анемии, при которым в организме больного вырабатываются антитела к эритроцитом, может развиться умеренная спленомегалия (увеличение селезенки) и легкая желтушность кожи и склер, вызванных наличием в крови гемолитических компонентов.
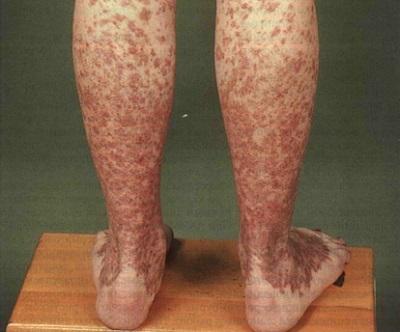 Геморрагические высыпания
Геморрагические высыпания
Показатели в анализе крови
Наиболее ярко выраженным является III этап анемии, который характеризируется бурной картиной клинических проявлений. На этой стадии развития апластической анемии анализ крови показывает:
- в клиническом анализе крови определяется ярко выраженная анемия (как правило, нормохромная) – уровень гемоглобина уменьшается до 20 – 30 г/л, концентрация ретикулоцитов снижается (говорит о снижении функциональности костного мозга);
- возникает лейкопения, гранулоцитопения, то есть резко снижается уровень содержания в крови гранулярных лейкоцитов. При этом количество лимфоцитов не изменяется;
- понижение тромбоцитов, вплоть до нуля;
- при гистологическом исследовании ткани костного мозга отмечается катастрофическое исчезновение его клеток, которые замещаются жировой тканью;
- резко повышается СОЭ – до 30 – 50 мм/час;
- в сыворотке крови концентрация железа увеличивается.
Лечение
Лечение апластической анемии зависит от главного фактора, который предположительно стал причиной развития патологического процесса.
Если заболевание выявлено впервые, больной обязательно подлежит госпитализации в стационар, отделение гематологии. Только в условиях лечебного учреждения можно корректно подобрать необходимый для лечения лекарственный препарат, а также определиться с его дозировкой.
Основными методиками коррекции и лечения апластической анемии у детей и взрослого являются:
- трансфузионные методы (переливание крови);
- трансплантационные методы;
- медикаментозные методы.
Трансфузия
Трансфузионный терапевтический метод предполагает переливание больному цельной, эритроцитарной или тромбоцитарной массы, а также гранулоцитов крови. Препараты крови, использующие в трансфузии, готовятся на станциях переливания из донорской крови. Данный метод трансфузии — временный, так как он позволяет только восполнить дефицит клеток крови, но нарушения в костном мозге при этом не ликвидируются. Еще одним минусом трансфузии является то, что при диагностировании аутоиммунных форм апластической анемии применять его нельзя.
 Переливание компонентов крови
Переливание компонентов крови
Если операции по переливанию крови больному делают довольно часто, это может привести к накоплению в его организме излишков железа, которые откладываются в печени и селезенке. Поэтому такой категории пациентов включают в терапию лекарственные препараты, влияющие на выведение железа из крови.
Трансплантация
Наиболее эффективным методом лечения апластической анемии принято считать трансплантационный, при котором происходит пересадка костного мозга человека. Вероятность успеха операции по пересадке костного мозга зависит от возраста больного, процент успешного исхода тем выше, чем моложе пациент. В качестве донора может выступить один из ближайших родственников, имеющий такую же группу крови, что и больной. Для этого необходимо провести исследование на индивидуальную совместимость их групп крови.
Данная методика лечения требует определенной подготовки, чтобы снизить процент вероятности отторжения чужеродных тканей. Перед процедурой переливания крови отменяются, назначается проведение лучевой терапии, закрепленной в последствие курсом химиотерапевтических препаратов. Делается это с целью временного подавления иммунной системы больного, которая может спровоцировать отторжение донорских стволовых клеток. Трансплантация костного мозга при анемии – очень дорогостоящая операция, проводится только в специализированных клиниках.
Медикаменты
Медикаментозная терапия при апластической анемии у человека включает применение следующих лекарственных средств:
- иммунодепрессанты – например, циклоспорин, специфические антиглобулины. Применение этих лекарственных форм показано в тех случаях, когда невозможно провести операцию по пересадке костного мозга. Назначаются они комплексно с кортикостероидами, чтобы предупредить развитие анафилактических реакций;
- лекарственные препараты, стимулирующие процессы кроветворения – например, филграстим, лейкомакс. Назначают их только в случае диагностирования лейкопении, поскольку они активируют процессы образования гранулярных лейкоцитов;
- для лечения апластической анемии у мужчин применяют препараты, содержащие андрогены (мужские половые гормоны) – тестостерона пропионат, сустанон;
- при выраженном геморрагическом синдроме показано назначение гемостатиков – дицинон, аминокапроновая кислота;
- одним из примеров препаратов, способствующих выведению железа из крови, является десферал.
Спленэктомия
Еще один метод лечения апластических анемий — спленэктомия, другими словами операция по удалению селезенки. Частота положительного эффекта составляет 85%. В основе этого метода лечения лежит прекращение аутоиммунных процессов в организме, когда вырабатываются антитела к собственным клеткам. Его можно проводить любым пациентам, у которых отсутствуют инфекционные осложнения.
Запрещено прибегать к использованию рецептов народной медицины при лечении апластической анемии. Лечение патологических нарушений в этом случае предусматривает точную дозировку лекарственных веществ, которую невозможно соблюдать при использовании фитопрепаратов.
Можно ли вылечить апластическую анемию
Поскольку механизмы развития апластической анемии на данном этапе так и остаются до конца не выясненными, прогноз лечения апластической анемии в большинстве случаев неблагоприятный.
Самый высокий процент смертности отмечается у категории больных с тяжелыми формами заболевания. Из-за прогрессирующего и не поддающего коррекции недоразвития костного мозга возобновить процессы образования клеток крови не удается и это приводит к гибели больного из-за генерализированного сепсиса.
Если же течение заболевания менее тяжелое, у больного отмечается положительная реакция на трансплантацию донорских стволовых клеток, а также применение иммунодепрессантов оказывает эффективное действие – прогнозы перехода заболевания в стадию ремиссии колеблются в пределах 50 – 90%. Одна лишь медикаментозная терапия, без применения оперативных методов лечения, может дать положительный результат только у половины пациентов.
Как проявляется заболевание в детском возрасте
В случае развития наследственных форм апластических анемий клиническая картина зависит от вида заболевания.
При диагностировании апластической анемии Фанкони у ребенка присутствуют такие врожденные пороки развития, как врожденные аномалии развития костной системы (отсутствие I пальца на кисти, искривление либо отсутствие лучевых костей и другие), пороки сердца и почек, аномалии развития глаз (маленькие глазные яблоки).
Симптомы апластической анемии у детей начинают появляться в возрасте 4 года, очень редко – в раннем возрасте. У ребенка наблюдается общая слабость, повышенная утомляемость, частые головные боли. Иммунитет снижается, ребенок становится более восприимчивым к простудным заболеваниям.
Геморрагический синдром проявляется склонностью к частым носовым кровотечениям. Лабораторное обследование дает характерную клиническую картину в анализах крови. Заболевание переходит в хроническую форму, прерываемую периодическими рецидивами.
Летальный исход при этой форме апластической анемии обусловлен присоединением инфекционного процесса или же развитием острой кровопотери из-за усилившегося геморрагического синдрома.
Случаи диагностирования апластической анемии Эстрена – Дамешека довольно редки. Данные виды болезни характеризируются нарушениями только кроветворных процессов.
При анемии Даймонда – Блекфена нарушаются процессы формирования только красных клеток крови. Геморрагический синдром отсутствует. При осмотре специалист отмечает бледность кожи, увеличение печени и спленомегалию. Концентрация тромбоцитов и лейкоцитов в крови может снизиться только в случае сильного поражения селезенки. Заболевание имеет хронически тяжелое течение. Прогноз крайне неблагоприятный. Смерть наступает до достижения 20-летнего возраста.
Источник


