Скачать бесплатно реферат тему анемия
Реферат
по патологической анатомии
на тему: «Анемии»
План:
1. Понятие анемии.
2. Принципы классификации анемий.
2.1. Анемии вследствие кровопотерь
(постгеморрагические).
2.2. Анемии вследствие нарушенного кровообразования.
2.3. Анемии вследствие повышенного кроворазрушения
(гемолитические).
2.4. Классификация анемий по частным признакам.
3. Приложение.
1. Понятие анемии.
Анемией
или малокровием
называется уменьшение содержания эритроцитов и (или) гемоглобина в единице объема крови, часто сочетающееся с их качественными изменениями.
Основной функцией эритроцитов является перенос кислорода и углекислого газа
.Эта функция становится недостаточной вследствие:
· уменьшения количества эритроцитовв крови;
· падения содержания гемоглобина;
· появления в крови незрелых или патологически измененных эритроцитов;
· наличия эритроцитов с наследственным дефектом;
· потери способности гемоглобина связывать кислород и других причин.
Чаше всего в клинической практике недостаточность функции эритроцитов отмечается при анемиях.
Анемии возникают на почве:
· различных заболеваний и интоксикаций;
· недостатка факторов, участвующих в кроветворении;
· гипоплазии костного мозга;
· гемолиза эритроцитов;
· кровопотерь и т. д.
При анемиях нарушается дыхательная функция крови — доставка кислорода к тканям. Потребность организма в кислороде в какой-то степени компенсируется мобилизацией защитно-приспособительных реакций, которые обычно возникают при гипоксических состояниях. В случае прогрессирующей анемии наступает тяжелая кислородная недостаточность, которая может стать причиной смерти.
Для различных видов анемий характерны не только уменьшение количества эритроцитов и гемоглобина, но и качественные изменения эритроцитов крови, степени их зрелости, размеров, формы, окраски, структуры и биохимических свойств.
2. Принципы классификации анемий.
В основу классификаций анемий положен патогенетический принцип. По патогенезу различает следующие виды анемий:
· анемия вследствие кровопотерь (постгеморрагические);
· анемии вследствие нарушенного кровообразования;
· анемии вследствие повышенного кроворазрушения (гемолитические).
2.1. Анемии вследствие кровопотерь
(постгеморрагические).
Острая постгеморрагическая анемия
.
Причинами острой анемии от кровопотерь являются внешние травмы (ранения) или кровотечения из внутренних органов.
В периферической крови сразу после кровотечения цифровые показатели эритроцитов и гемоглобина приближаются к исходным. Анемия выявляется через 1 — 2 дня. К этому времени объем крови восполняется за счет поступления в сосуды тканевой жидкости. Вследствие разжижения крови и повышенного износа и разрушения эритроцитов количество их прогрессивно снижается. Параллельно снижается содержание гемоглобина, поэтому цветовой показатель изменяется мало.
Острая постгеморрагическая анемия относится к анемиям регенераторным, так как с 4 — 5-го дня после кровопотери начинается интенсивная продукция эритроцитов под влиянием эритропоэтина и продуктов распада эритроцитов. В костном мозге увеличивается содержание эритро- и нормобластов. В периферической крови обнаруживаются клетки физиологической регенерации: увеличивается количество ретикулоцитов, полихроматофилов, появляются нормобласты (нормоциты). Процесс образования эритроцитов ускоряется, а гемоглобинизация их становится недостаточной из-за дефицита железа. Анемия приобретает гипохромный характер, цветовой показатель падает ниже 0,9.
Хроническая постгеморрагическая анемия
.
Причиной ее являются повторяющиеся кровопотери, например, при язве желудка, фиброме матки, геморроидальные и другие кровотечения. По патогенезу хроническая постгеморрагическая анемия относится к анемиям железодефицитным.
2.2. Анемии вследствие нарушенного кровообразования.
Нарушение кровообразования зависит от ряда причин. Основные из них следующие:
· недостаток факторов, необходимых для осуществления нормального эритропоэза. Сюда относятся анемии, связанные с дефицитом в организме железа, витаминов B12, B6
, В2
, фолиевой кислоты, белков (голодание) и микроэлементов (Си, Со, Zn, Мn);
· расстройство нейрогуморальной регуляции эритропоэза. Здесь главная роль принадлежит недостаточной продукции эритропоэтина или его инактивации ингибиторами;
· токсическое действие на костный мозг некоторых микробных токсинов, химических и лекарственных средств, ионизирующей радиации и пр. (гипо- и апластические анемии);
· метастазы злокачественных опухолей в костный мозг, лейкозы (метапластические анемии).
Несмотря на то, что все перечисленные анемии объединяются по патогенезу как анемии вследствие нарушенного кровообразования, процесс нарушения эритропоэза в разных случаях анемий обусловлен разными частными механизмами.
Железодефицитные анемии
составляют наибольший процент среди всех случаев малокровия.
Этиология.
Основные причины железодефицитных анемий следующие: 1) хронические кровопотери (вместе с эритроцитами теряется железо); 2) нарушение всасывания железа (удаление желудка, отсутствие секреции соляной кислоты, заболевания кишечника — энтериты); 3) повышенное расходование запасов железа (беременность, лактация, период роста у детей); 4) нарушение включения железа в синтез гема (наследственный дефект ферментов, отравление свинцом).
Железодефицитная анемия может сочетаться с тканевым дефицитом железа в организме, признаками которого являются: ломкость ногтей, выпадение волос, атрофический процесс в слизистой оболочке желудка (атрофический гастрит) и другие симптомы. С развитием атрофи-ческого гастрита ухудшается всасывание железа и прогрессирует малокровие.
Патогенез.
При дефиците железа нарушается синтез гемоглобина в эритро- и нормобластах. Недостаточная гемоглобинизация клеток красной крови приводит к задержке их созревания и выхода в кровеносное русло. Увеличивается процент неэффективного эритропоэза. Неэффективным эритропоэзом называют процесс разрушения эритроидных клеток в костном мозге, в норме он не превышает 20%. Развивается анемия гипорегенераторного типа. Железодефицитные анемии обычно гипохромные с цветовым показателем ниже единицы (0,8-0,4), так как концентрация гемоглобина падает в большей степени, чем количество эритроцитов. Характерным признаком является сидеропения — уменьшение уровня железа в плазме крови до 100 мкг/л (норма в среднем 1000 мкг/л).
Картина крови.
В периферической крови наблюдается пойкило-цитоз (наличие эритроцитов разной формы) и анизоцитоз (эритроциты разной величины) с преобладанием микроцитов. Количество ретикулоцитов увеличивается незначительно, в тяжелых случаях падает ниже нормы.
В12-дефицитные и фолиеводефицитные анемии
.
Этиология.
Основными причинами являются нарушение всасывания или повышенное расходование витамина B12 и фолиевой кислоты, реже недостаточное поступление их с пищей.
Нарушение всасывания витамина B12 наиболее выражено при анемии Аддисона—Бирмера развитие которой обусловлено отсутствием в желудочном соке больных внутреннего фактора Касла (гастромукопротеина).
В отсутствие гастромукопротеина витамин B12 разрушается в кишечнике и не усваивается. С недостатком в организме этого витамина нарушается нормальный эритропоэз, возникает мегалобластический тип кроветворения, ведущий к развитию малокровия.
Для анемии Аддисона — Бирмера
характерны и другие признаки авитаминоза B12: «полированный язык» из-за атрофии сосочков языка, шаткая походка, вызванная дегенеративными изменениями в задних и боковых столбах спинного мозга (фуникулярный миелоз).
Дефицит гастромукопротеина создается также после резекции желудка. Вначале развивается железодефицитная анемия вследствие ограниченного всасывания железа, а через 3 — 4 года — мегалобластическая анемия, так как к этому времени истощаются запасы эндогенного витамина B12.
Витамин В12 и фолиевая кислота плохо усваиваются при различных поражениях тонкого кишечника (резекция кишки, паразитирование широкого лентеца, энтериты).
Мегалобластическая анемия
наблюдается иногда у беременных. Причиной служит интенсивное потребление плодом витамина B12 и фо-лиевой кислоты, когда эмбриональный тип кроветворения у плода сменяется нормобластическим (на IV —V месяце развития).
Патогенез.
Витамин B12 и фолиевая кислота необходимы для нормального эритропоэза. При недостатке витамина B12 затрудняется переход фолиевой кислоты в ее метаболически активную форму — тетрагид-рофолиевую кислоту. В результате этого нарушается синтез ДНК в кроветворных клетках, в частности эритро- и нормобластах. Задерживается их деление и созревание, чем и обусловлен переход нормобластического эритропоэза в мегалобластический. В костном мозге преобладают клетки патологической регенерации. Характерной чертой мегалобластического эритропоэза является его неэффективность: резко увеличивается процент разрушающихся в костном мозге незрелых клеток (до 50%). Из-за подавления митотической активности и неэффективного эритропоэза значительно уменьшается количество поступающих в кровь эритроцитов (анемия гипорегенераторного типа).
Картина крови.
В периферической крови появляются «гигантские» клетки с диаметром до 12 — 15 мкм — мегалоциты и единичные, содержащие ядро мегалобласты. Эти клетки менее устойчивы, чем нормальные эритроциты, и легко подвергаются гемолизу, что усугубляет анемию. В крови могут быть обнаружены эритроциты с патологическими включениями в виде телец Жолли (остатки ядра), колец Кебота (остатки оболочки ядра) и эритроциты с базофильной зернистостью. Отмечается выраженный пойкилоцитоз и анизоцитоз с преобладанием макроцитов, встречаются нейтрофилы с гиперсегментированным ядром. Анемия сопровождается лейкопенией и тромбоцитопенией.
Мегалобластические анемии относятся к анемиям гиперхромным с цветовым показателем выше единицы (1,3-1,5). Гиперхромия обусловлена крупным размером клеток. Общее содержание гемоглобина в крови значительно падает, еще более резко снижается количество эритроцитов (до 2х106
и ниже в 1 мкл).
Гипо- и апластические анемии
возникают от токсического действия на костный мозг ионизирующей радиации, некоторых химических и лекарственных средств (бензол, цитостатические препараты, антибиотики), наблюдаются при инфекционных заболеваниях, нарушениях гормональной регуляции эритропоэза, аутоиммунных процессах. Замещение кроветворной ткани опухолевыми клетками (при лейкозах, метастазах рака в костный мозг) приводит к развитию метапластической анемии. При воздействии на костный мозг указанных выше факторов повреждаются и гибнут стволовые клетки, подавляются процессы деления и созревания кроветворных клеток, сокращается объем кроветворной ткани, что ведет к опустошению (аплазии) костного мозга. Отмечается прогрессирующее падение эритропоэза. Количество эритроцитов падает, резко снижается содержание в крови гемоглобина, цветовой показатель остается в пределах нормы. Как правило, анемия сочетается с лейкопенией и тромбоцитопенией.
2.3. Анемии вследствие повышенного кроворазрушения
(гемолитические).
Главным патогенетическим фактором в возникновении этого вида анемии является укорочение срока жизни эритроцитов и преобладание процесса разрушения эритроцитов над их продукцией. Гемолитические анемии сопровождаются желтухой вследствие избытка в крови и отложения в тканях пигмента билирубина. Источником его служит гемоглобин разрушенных эритроцитов. По цветовому показателю гемолитические анемии являются гипо- или нормохромными, реже — гиперхромными. Они относятся к регенераторным анемиям с нормобластическим типом эритропоэза.
По причине возникновения различают приобретенные и наследственные гемолитические анемии, по характеру заболевания — острые и хронические.
Приобретенные гемолитические анемии
обусловлены преимущественно внутрисосудистым гемолизом эритроцитов вследствие повреждения их мембраны разными агентами. Для остро развивающегося гемолиза характерно появление гемоглобина в моче (гемоглобинурия).
Причиной приобретенных гемолитических анемий являются: 1) отравление гемолитическими ядами (фенилгидразин, анилиновые красители, грибной яд и др.); 2) некоторые инфекционные и паразитарные заболевания (анаэробный сепсис, малярия); 3) переливание несовместимой крови или резус-несовместимость плода и матери; 4) образование в организме аутоантител против собственных эритроцитов; 5) ряд других причин.
Резус-несовместимость может возникнуть, если плод наследует от отца эритроциты с резус-фактором, а мать является резус-отрицательной; в организме матери против резус-антигена начинают вырабатываться антитела, которые вызывают гемолиз эритроцитов плода (гемолитическая болезнь новорожденных).
Анемии, возникающие в результате разрушения эритроцитов антиэритроцитарными аутоантителами, называются аутоиммунными гемолитическими анемиями
. Антиэритроцитарные аутоантитела могут образоваться: 1) в случае изменения антигенной структуры эритроцитов под влиянием различных повреждающих факторов и 2) в случае дефектов самой иммунологической системы, в результате чего ненормальные мутантные клоны лимфоидных клеток синтезируют антитела против эритроцитов собственного организма.
Наследственные гемолитические анемии
возникают в результате наследования патологических типов гемоглобинов (гемоглобинопатии), патологических форм эритроцитов (эритроцитопатии) и эритроцитов с дефицитом ферментов (энзимопатии).
Гемоглобинопатии
— это генетически обусловленные нарушения строения гемоглобина. Известны более 50 разновидностей патологических типов гемоглобинов, которые отличаются от нормального тем, что имеют измененный аминокислотный состав полипептидных цепей глобина. Примерами наиболее часто встречающихся гемоглобинопатий являются серповидноклеточная анемия и талассемия
.
Серповидноклеточная анемия
возникает от наследования патологического HbS. Он отличается от нормального HbA1 тем, что в β-цепи глютаминовая кислота заменена валином. Эритроциты приобретают вид серпа при снижении парциального давления кислорода в крови (гемоглобин при этом осаждается и стягивает мембрану эритроцитов). Этот вид анемии встречается у населения тропической Африки и некоторых областей Индии и наследуется по рецессивному типу. Тяжелая анемия проявляется лишь у гомозиготных по HbS субъектов.
Талассемия
(средиземноморская анемия) обусловлена нарушением синтеза α- или β-цепи нормального НЬА1
и соответственно называется α-талассемия или β-талассемия. При β-талассемии тормозится образование HbA1
и идет избыточный синтез НЬА2
и HbF — гемоглобина плода. Для этого заболевания типичны эритроциты в виде «мишени», сильно прокрашенные по периферии и в центре.
Эритроцитопатии.
К эритроцитопатиям относят гемолитические анемии, обусловленные генетическим дефектом белковой или липидной структуры мембраны эритроцитов. В этих случаях, как и при гемоглоби-нопатиях изменяется форма эритроцитов (шаровидная, овальная, с зазубренными краями и др.) и сокращается продолжительность их жизни. Например, при наследственной сфероцитарной анемии
повышена проницаемость мембраны эритроцитов к натрию. Вместе с натрием в клетку проникает вода, объем эритроцитов увеличивается, они приобретают форму шара, их механическая и осмотическая устойчивость резко снижается. Шаровидные эритроциты (сфероциты) циркулируют в кровеносном русле не более 12 — 14 дней.
При гемоглобинопатиях и эритроцитопатиях преобладает внесосу-дистый, внутриклеточный гемолиз. Деформированные эритроциты становятся ригидными, мало эластичными. Поэтому, проходя с трудом через мельчайшие сосуды, они повреждаются, захватываются макрофагами селезенки и печени и там подвергаются преждевременному гемолизу. Печень и селезенка у больных увеличены.
Энзимопатии
обусловлены дефектом ряда ферментных систем в эритроцитах. Например, при недостатке в эритроцитах фермента деги-дрогеназы глюкозо-6-фосфата происходит блокирование первого этапа обмена глюкозо-6-фосфата в пентозном цикле. В результате этого уменьшается образование восстановленной формы глютатиона (восстановленный глютатион предохраняет SH-группы глобина и мембраны эритроцитов от окисления).
Эритроциты с пониженным содержанием глютатиона легко подвергаются действию различных окисляющих веществ и гемолизируются. Таков механизм острой гемолитической анемии вследствие приема некоторых лекерств (хинин, ПАСК) или при употреблении в пищу бобов viciavafa (фавизм). С дефицитом гликолитических ферментов (пируваткиназа, гексокиназа и др.) нарушаетя гликолиз и энергетический обмен в эритроцитах, что способствует их преждевременному гемолизу.
2.4. Классификация анемий по частным признакам.
Существует классификация анемий по частным признакам
, которая, однако, не вскрывает механизма возникновения анемических состояний.
Например, анемию можно характеризовать по цветовому показателю
:
· нормохромная с цп-0,9 — 1,0;
· гиперхромная с цп-выше 1,0;
· гипохромная с цп ниже 0,9.
По среднему диаметру преобладающих в крови эритроцитов
:
· нормоцитарная с СДЭ-7, 2 — 8 мкм;
· макроцитарная с СДЭ выше 8,1 мкм;
· микроцитарная с СДЭ ниже 7,2 мкм.
По типу кроветворения различают:
· нормобластическую анемию с нормальным (постэмбриональным) типом эритропоэза;
· мегалобластическую анемию с патологическим (эмбриональным) типом эритропоэза.
По состоянию костномозгового кроветворения анемии подразделяются на
:
· регенераторные (с повышенным эритропоэзом);
· гипорегенераторные (с пониженной продукцией эритроцитов вследствие нарушения эритропоэза);
· арегенераторные (с временным или полным подавлением эритропоэза).
3. Приложение:
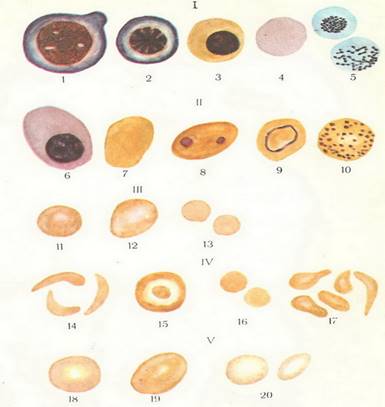
Различные виды эритроцитов периферической крови при анемиях.
I—
клетки физиологической регенерации: 1 — эритробласт; 2 — нормобласт (нормоцит) базофильный; 3 — нормобласт оксифильный; 4 — полихроматофильный эритроцит; 5 — ретикулоцит (прижизненная окраска);
II — клетки патологической регенерации: 6 — мегелобласт; 7 — мегалоцит; 8 — эритроцит с тельцами Жолли (остатки ядра); 9 — эритроцит с кольцом Кабо (остаток оболочки ядра); 10 — эритроцит с базофильной зернистостью;
Ш — анизоцитоз (эритроциты различной величины): 11 — нормальный эритроцит; 12 — макроцит; 13 — микроциты;
IV — пойкилоцитоз (эритроциты различной формы): 14 — в виде серпа (серповидноклеточная анемия); 15 — в виде мишени (талассемия); 16 — в форме шара (сфероцитарная анемия); 17 — различные другие формы эритроцитов;
V — анизохромия (эритроциты с различной степенью окраски): 18 — нормо-хромный; 19 — гиперхромный; 20 — гипохромный.
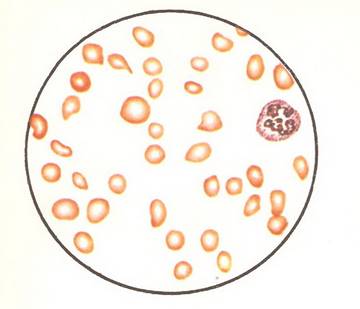
Картина крови при железодефицитной анемии
.
В поле зрения гипохромные эритроциты, анизопойкилоцитоз (по Н. Д. Стражеско и Д. Н. Яновскому).
Список использованной литературы:
1. Н.С. Кисляк, Р.В. Ленская «Клетки крови у детей в норме и патологии». Москва, 1978г.
2. Коллектив авторов. «Патологическая физиология». Под редакцией А.Д. Адо, Л.М. Ишимовой. Москва, 1980г.
3. Луговская С.А., Морозова В.Т., Почтарь М.Е., Долгов В.В. «Лабораторная гематология», Москва, 2006г.


