Роль цитокинов в развитии атеросклероза
Множество факторов вносит вклад в патогенез атеросклероза, в том числе эндотелиальная дисфункция, дислипидемии, воспалительные и иммунологические факторы, разрыв бляшки, и курение.
Эндотелиальная дисфункция
Эндотелий формирует активный биологический субстрат между кровью и другими тканями, образует уникальный тромборезистентный слой между кровью и потенциально тромбогенными субэндотелиальными тканями. Эндотелий также модулирует тонус, рост, гемостаз и воспаление по всей системе кровообращения. Эндотелиальная сосудорасширяющая дисфункция является начальным шагом в развитии атеросклероза и вызвана главным образом потерей эндотелием оксида азота
Эндотелиальная дисфункция связана со многими из традиционных факторов риска развития атеросклероза, в том числе гиперхолестеринемией, сахарным диабетом, гипертонией, курением сигарет. В частности, дисфункция эндотелия индуцируется окислением липопротеинов низкой плотности (ЛПНП), а в некоторых отношениях это можно рассматривать в качестве конечного и основного фактора. Это может быть улучшено путем коррекции диеты, с помощью терапии статинами (ГМГ-КоА редуктазы), что повышает биодоступность оксида азота, применения ингибиторов фермента, преобразующего ангиотензин, высокими дозами антиоксидантов, таких как витамин С или флавоноиды, содержащиеся в красном вине и фиолетовом виноградном соке. Однако клинические преимущества этих методов лечения были убедительно продемонстрированы только для статинов.
1. Воспаление. Признаки воспаления в атеросклеротических поражениях были отмечены, начиная с самых ранних гистологических наблюдений и воспаление имеет центральное значение для понимания патогенеза атеросклероза. Макрофаги, которые были модифицированы путем окисленного LDL высвобождения различных воспалительных веществ, цитокины и факторы роста [29,30]. Среди многочисленных клеток , которые были вовлечены являются: модифицированные путем окисления макрофаги, цитокины, факторы роста, белок хемотаксиса моноцитов (МСР) -1, растворимый CD40 лиганд; интерлейкин (IL) -1, ИЛ-3, ИЛ-6, ИЛ-8 и ИЛ-18 и фактор некроза опухолей альфа. Сывороточный С-реактивный белок связан с атеросклеротическими сердечно-сосудистыми заболеваниями, однако генетические данные не подтверждают его роль в качестве причинного фактора риска. Липопротеин-ассоциированная фосфолипаза А2 (Lp-PLA2) является макрофаг-секретируется ферментом, высокое содержание которого повышает риск развития инфаркта миокарда (ИМ) и инсульт в популяционных исследованиях. Цитокины могут участвовать в патогенезе атеросклероза. Медиаторы, такие как интерлейкин-1 или фактора некроза опухоли-альфа имеют множество атерогенных эффектов. Они усиливают экспрессию молекул клеточной поверхности, таких как ICAM-1, VCAM-1, CD40, CD40L и селектина на эндотелиальных клетках, гладких мышечных клеток и макрофагов. Провоспалительные цитокины могут также индуцировать клеточную пролиферацию, способствуют выработке активных форм кислорода, стимулируют металлопротеиназы матрикса, и индуцируют экспрессию тканевого фактора. Другие цитокины, такие как интерлейкин-4 и интерлейкин-10, являются антиатерогенными. активация лейкоцита — лейкоцитарный (циркулирующих моноцитов, а также в меньшей степени Т-лимфоциты), набор наблюдается в начале атеросклеротического поражения, обеспечивая некоторые доказательства роли системного воспаления.
2. Дислипидемии. Липидные аномалии играют решающую роль в развитии атеросклероза. Эпидемиологические исследования, проведенные в странах по всему миру, показали увеличение числа случаев атеросклероза, когда концентрации холестерина в сыворотке крови были выше 150 мг / дл (3,9 ммоль / л).
Полезно обобщить основные замечания.
Высокий уровень липопротеидов низкой плотности (ЛПНП)холестерина и низкий уровень липопротеинов высокой плотности (ЛПВП), являются особенно важными факторами риска развития атеросклероза.
Липопротеиды низкой плотности накапливаются в эфире холестерина обогащенных макрофагов (пенистые клетки) атеросклеротической бляшки. Накопление холестерина в пенистых клетках приводит к митохондриальной дисфункции, апоптозу и некрозу, с выпуском клеточных протеаз, воспалительных цитокинов и протромботических молекул.
Окисленные липопротеины низкой плотности, способствуют воспалительным и иммунным изменениям с увеличением агрегации тромбоцитов и развития нестабильности бляшки. Уровни окисленных ЛПНП увеличены у пациентов с острым коронарным синдромом и положительно коррелируют с тяжестью синдрома.
Липопротеиды высокой плотности , в отличие от липопротеидов низкой плотности , имеют предположительные антиатерогенные свойства, которые включают обратный транспорт холестерина, поддержание функции эндотелия, а также защиту от тромбоза. Существует обратная зависимость между уровнем липопротеидов высокой плотности-холестерина в плазме и сердечно-сосудистыми рисками.
Текущие эпидемиологические и генетические данные подтверждают причинную роль для богатых триглицеридами липопротеинов, особенно те, которые содержат аполипопротеин C3.
Роль липопротеина является довольно многомерная благодаря своей структуре, где липопротеин низкой плотности-подобный фрагмент липопротеина -а, способствовует развитию атеросклероза тромбообразованию, препятствуя фибринолизу. Дополнительные функции Липопротеина-а включают в себя инициирование сигнальных путей в макрофагах и сосудистых эндотелиальных клетках, что приводит к изменениям клеточного фенотипа и проатерогенной экспрессии генов, образование пенистых клеток.
3. Гипертония. Артериальная гипертензия является одним из основных факторов риска развития атеросклероза, особенно в коронарных и церебральных артериях. Это может увеличить напряжение артериальной стенки, что может привести к нарушению процессов регенерации и образованию аневризм(патологическое выпячивание стенки артерии).
4. Курение. Курение сигарет является еще одним важным фактором риска, и это влияет на все фазы атеросклероза от эндотелиальной дисфункции до острых клинических событий, причем последний в значительной степени. Следующие наблюдения были сделаны:
В организме человека, воздействие сигаретного дыма ухудшает эндотелий-зависимую вазодилатацию, возможно, путем сокращения оксида азота (NO) .
Курение сигарет связано с повышенным уровнем нескольких маркеров воспаления, включая С-реактивного белка, интерлейкина-6 и фактора некроза опухоли альфа у мужчин и женщин
Курение сигарет может снизить доступность тромбоцитарного оксида азота ( NO), уменьшает чувствительность тромбоцитов к экзогенному оксиду азота NO (оба фактора могут привести к увеличению активации и адгезии, увеличение уровня фибриногена,а также уменьшить фибринолиз.
Курение сигарет увеличивает окислительной модификации ЛНП и снижает плазменную активность параоксоназы, фермент, который защищает от окисления липопротеидов низкой плотности.
5. Сахарный диабет. В дополнение к атерогенному эффекту от дислипидемии, исследования показали, что высокие уровни инсулина предшествуют развитию заболеваний артерий. Атеросклероз и тип 2 диабета имеют схожие патологические механизмы, в том числе повышение уровней цитокинов, таких как МСР-1 и интерлейкин-6 (ИЛ-6), которые вносят вклад в ускоренную прогрессию атеросклероза.
Источник
В статье проведен анализ уровней цитокинов у больных атеросклерозом периферических сосудов в условиях техногенного загрязнения. Показано, что пациенты с облитерирующим атеросклерозом и сопутствующей АГ, проживающие на загрязненной радионуклидами урана территории, имея повышенное содержание провоспалительных цитокинов, при наличии даже гемодинамически незначимых форм атеросклероза, должны быть отнесены к группе высокого риска прогрессирования атеросклеротического процесса.
Введение
Особенностью экологии Кыргызской Республики является наследие горно-обогатительных комбинатов по производству урана в бытность Советского Союза в виде радиоактивных хвостохранилищ [1]. Несмотря на обширные массивы данных радиационной эпидемиологии, позволяющие с определенной точностью дать оценку радиогенного риска для ситуации острого облучения, риск развития атеросклеротического поражения периферических сосудов в ситуации хронического попадания в организм радионуклидов при низких мощностях дозы в условиях горного климата до настоящего времени окончательно не определен и нуждается в дальнейшем изучении.
Проблема развития атеросклероза на фоне радиации является одной из актуальных в современной медицине в связи с продолжительностью латентного течения и выраженностью неблагоприятных исходов [2–5].
Атеросклеротическая модификация сосудов во многом обусловливается нарушением функции эндотелия и увеличением ее проницаемости, пролиферацией миоцитов сосудистой стенки, индуцируемой артериальной гипертензией (АГ), изменением гемодинамики, значительным увеличением в крови липопротеинов, богатых холестерином (ХС), курением, гипоксией, радиацией и др. В норме узкие межэндотелиальные промежутки под влиянием поступающих в кровь различных вазоактивных веществ раскрываются и частички липопротеидов низкой плотности (ЛПНП) проникают в интиму артерий и подвергаются модификации. Окисленные (модифицированные) ЛПНП, являясь индукторами атеросклероза и воздействуя на лейкоциты циркулирующей крови и эндотелиальные клетки, вызывают экспрессию на их поверхности адгезивных молекул. Происходит адгезия моноцитов циркулирующей крови к эндотелиоцитам с их последующей миграцией в интиму, далее они захватывают модифицированные ЛПНП и превращаются в пенистые клетки; в то же время происходит взаимодействие тромбоцитов с эндотелиальными клетками, стимуляция гладкомышечных клеток и накопление в очаге атеросклеротического поражения лимфоцитов, продуцирующих про- и противовоспалительные цитокины.
Инфильтрирующие сосудистую стенку клетки, активированные адгезивными молекулами и цитокинами, сами становятся источником различных провоспалительных и фиброгенных факторов.
По данным Н.В. Бутомо и соавт. (2004) [6], важным аспектом действия ионизирующего излучения является влияние на систему цитокинов, особенно увеличивается выработка интерлейкинов ИЛ-1, ИЛ-6, фактора некроза опухоли α. Вмешательство в систему цитокиновой регуляции формирования и функционирования иммунитета обусловливает новый, измененный характер ее взаимодействия с другими регуляторными системами
организма.
Известно, что одним из ключевых цитокинов, играющих важную роль в воспалительных и иммунных реакциях в очаге атеросклеротического поражения, оказывающих мощное деструктивное воздействие на эндотелий и соединительнотканные структуры сосудов и имеющих значение для раннего прогнозирования высокого риска возникновения серьезных сердечно-сосудистых событий, является ИЛ-6 [7–11].
Роль же противовоспалительных цитокинов в патогенезе атеросклероза изучена недостаточно. По данным современных авторов, ИЛ-10, продуцируемый активированными лимфоцитами, макрофагами и тканевыми базофилами, является одним из основных ингибиторов синтеза противовоспалительных цитокинов [7].
Таким образом, целью исследования явилось изучение уровней про- и противовоспалительных цитокинов ИЛ-6 и ИЛ-10 у больных атеросклерозом периферических сосудов, проживающих в горных условиях вблизи урановых хвостохранилищ.
Материал и методы
В исследование включены 73 пациента в возрасте от 38 до 85 лет. В основную группу (ОГ) вошли 27 пациентов, проживающих в условиях среднегорья вблизи урановых хвостохранилищ и страдающих облитерирующим атеросклерозом сосудов нижних конечностей с сопутствующей АГ, средний возраст которых составил 62,6±2,1 года. Группа сравнения (контрольная группа-1, КГ-1) была представлена 31 пациентом с АГ, средний возраст 61,6±1,21 года. В качестве контрольной группы-2 (КГ-2) для сопоставления использовали референсные нормы 20 практически здоровых лиц, не страдающих заболеваниями сердечно-сосудистой системы, средний возраст 64,0±5,18 года.
Антропометрические показатели, возрастной диапазон, данные сопутствующих заболеваний и продолжительность проживания на загрязненной территории всех пациентов статистически значимо не отличались во всех трех группах.
Критерии включения: пациенты с атеросклерозом сосудов нижних конечностей, АГ, здоровые лица.
Критерии исключения: хроническая сердечная недостаточность, нарушение мозгового кровообращения, онкологические заболевания, прием противовоспалительных, гиполипидемических средств и препаратов, влияющих на свертывающую систему крови.
Проводилось заполнение специально разработанной карты на основании информации, полученной в ходе анкетирования, анализа амбулаторных карт и обследования: данные анамнеза жизни, антропометрические данные, результаты лабораторных исследований (липидный спектр, свертывающая система крови), определение состояния периферических артерий с помощью дуплексного сканирования и измерения лодыжечно-плечевого индекса (менее 0,90).
Исследуемые уровни цитокинов определяли одномоментно в дублях у всех больных. Для этого забор венозной крови осуществлялся из локтевой вены в количестве 20 мл не ранее чем через 12 ч после последнего приема пищи. С целью получения сыворотки проводилось центрифугирование венозной крови. После отделения сыворотку замораживали и хранили при температуре минус 20 °C. Затем, по мере накопления достаточного количества проб с сывороткой, концентрацию цитокинов определяли методом трехстадийного сендвич-варианта твердофазного иммуноферментного анализа с применением моно- и поликлональных антител к цитокинам с помощью набора реактивов: А-8768 для ИЛ-6 и А-8774 для ИЛ-10 в лаборатории Научно-исследовательского института молекулярной биологии и медицины.
Статистическую обработку данных выполняли с использованием пакета прикладных программ SPSS-16 и программы MS Excel 2010. Для проверки нормальности распределения применялся критерий Шапиро — Уилка. Использовались непараметрические методы статистики, результаты описательной обработки представляли в виде среднего значения и ошибки среднего значения (М±m). Достоверными принимали значения при р<0,05.
Исследование было одобрено этическим комитетом научно-производственного объединения «Профилактическая медицина» Министерства здравоохранения Кыргызской Республики (заключение № 7 от 16 ноября 2017 г.).
Результаты и обсуждение
Данные о содержании цитокинов в крови у исследуемых групп представлены в таблице 1. При анализе содержания цитокинов в крови у обследованных жителей, проживающих в техногенно загрязненной среде, средние уровни показателей ИЛ-6 и ИЛ-10 (46,47±4,8 и 5,2±0,72 пг/мл соответственно) не превышали нормативных индексов согласно инструкции набора (0–50 пг/мл), несмотря на значительные размахи диапазона значений ИЛ-6 (от 2,09 до 291 пг/мл).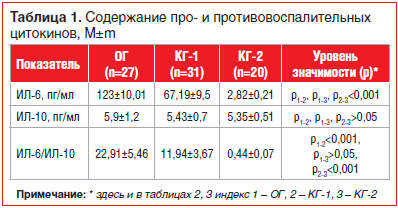
Содержание провоспалительного цитокина ИЛ-6 у пациентов с облитерирующим атеросклерозом сосудов нижних конечностей с сочетанной АГ превышало аналогичные показатели в КГ-1 в 1,83 раза и в КГ-2 — в 43,61 раза.
Установлено, что уровень противовоспалительного цитокина ИЛ-10 в сыворотке крови во всех обследуемых группах был в пределах физиологической нормы, значимых различий между группами не выявлено (р>0,05).
В рамках изучаемого вопроса исследовалось соотношение про- и противовоспалительных цитокинов во всех исследуемых группах. Известно, что в оценке состояния иммунной системы большое значение придается величине цитокинового отношения ИЛ-6/ИЛ-10, имеющего диагностическое и практическое значение, информирующего о дисфункции иммунной защиты и выраженности воспалительного процесса на доклинических стадиях развития патологии [12].
В результате анализа параметров цитокинового отношения ИЛ-6/ИЛ-10 в сыворотке крови у больных ОГ выявлено высокое значение данного показателя по сравнению со значениями в КГ-1 и КГ-2. Отмечена тенденция к более высоким показателям ИЛ-6/ИЛ-10 в крови у пациентов с гипертонической болезнью (11,94±3,67 пг/мл), чем у здоровых лиц (0,44±0,07 пг/мл).
Учитывая важную роль иммунного воспаления и нарушений холестеринового обмена в развитии атеросклероза, проведен анализ цитокинов ИЛ-6, ИЛ-10 и цитокинового индекса в зависимости от нормолипидемии, гиперхолестеринемии и гипертриглицеридемии.
Выявлено, что при нормолипидемии, когда содержание общего ХС регистрировалось на уровне <5,0 ммоль/л, триглицеридов — ниже 1,7 ммоль/л и содержание ХС ЛПВП было выше 1,0 ммоль/л, определялся высокий уровень ИЛ-6 в ОГ и в КГ-1, который статистически значимо отличался от уровня обследуемых пациентов КГ-2 (табл. 2).
Данные о содержании цитокинов крови больных периферическим атеросклерозом (ОГ) и АГ (КГ-1) в зависимости от нарушений липидного спектра, за исключением показателей здоровых лиц (КГ-2), представлены в таблице 3.
Установлено, что при концентрации общего ХС выше 5,2 ммоль/л в ОГ уровень ИЛ-6 был выше на 63,32%, чем в КГ-1 (р<0,001). Рассчитано, что цитокиновое соотношение в данной подгруппе статистически значимо было выше по сравнению с группой контроля.
Зафиксировано, что по сравнению с умеренно (5,2–6,1 ммоль/л) повышенной концентрацией общего ХС при высоком содержании общего ХС выше 6,2 ммоль/л отмечалось статистически значимое (р<0,05) изменение противовоспалительного цитокина ИЛ-10 в ОГ (11,3±1,0) по сравнению с КГ-1 (6,33±1,98).
В исследованиях, проведенных А.Б. Сумароковым (1996) [13], показано, что высокое содержание общего ХС и ХС ЛПНП имеет значение только на ранних стадиях заболевания атеросклерозом, в то время как на поздних стадиях играет более важную роль повышенный уровень триглицеридов. Стоить отметить, что гипертриглицеридемия натощак с середины 1990-х годов стала рассматриваться как независимый и прогностически значимый фактор риска сердечно-сосудистых событий [13]. При анализе содержания иммунорегуляторных про- и противовоспалительных цитокинов в зависимости от содержания уровня триглицеридов выше 1,7 мммоль/л выявлены достоверные различия в содержании ИЛ-6 между группами пациентов ОГ и КГ, однако статистически значимых различий в содержании ИЛ-10 в данных группах не установлено (см. табл. 3).
При выполнении данного исследования предполагалось, что ИЛ-6 является фактором риска развития облитерирующего атеросклероза сосудов нижних конечностей и АГ ввиду общности многих факторов риска и единых звеньев патогенеза, включая микроциркуляторные расстройства и иммуновоспалительные сдвиги. Из доступной нам литературы мы почерпнули сведения о том, что ИЛ-6 потенцирует стресс-реакции, оказывая влияние на секрецию катехоламинов и гипоталамо-гипофизарно-надпочечниковую систему [14, 15]. Также он является главным активатором синтеза большинства острофазных белков печени [16] и, влияя на гепатоциты и адипоциты, стимулирует выработку С-реактивного белка (СРБ). СРБ способен связывать и нейтрализовать медиатор парасимпатической системы — ацетилхолин, снижая его вазодилатирующий эффект, влиять на эндотелийзависимые реакции сосудов, нарушая механизмы их релаксации [5], которые играют ключевую роль как при атеросклерозе сосудов нижних конечностей, так и при АГ.
Статистически значимое увеличение значений ИЛ-6 в крови у больных с облитерирующим атеросклерозом сосудов нижних конечностей и сопутствующей АГ, проживающих на загрязненной радионуклидами урана территории, выявлено как при гипертриглицеридемии и гиперхолестеринемии, так и при нормолопидемии, механизмы которых необходимо исследовать в дальнейшем.
Регистрация ИЛ-10 на уровне референсных значений свидетельствует о подавлении противовоспалительных механизмов иммунного реагирования в условиях гипоксии и радионуклидной нагрузки. Однако высокое содержание ИЛ-10 (11,3±1,0) при увеличении концентрации общего ХС выше 6,2 ммоль/л, возможно, свидетельствует о реактивной стимуляции Т-лимфоцитов, ответственных за продукцию цитокинов, за счет усиления повреждающих этиологических факторов, таких как избыток общего ХС, ХС ЛПНП, высокого системного артериального давления, радионуклидной нагрузки и гипоксии.
Стоит отметить, что наиболее информативным показателем является цитокиновый индекс (соотношение ИЛ-6/ИЛ-10), увеличение значения которого выше 1,5 ассоциируется с риском развития системного воспаления [16]. Данное исследование продемонстрировало, что у больных облитерирующим атеросклерозом сосудов нижних конечностей на фоне АГ содержание цитокинового соотношения достоверно выше, чем у здоровых лиц и пациентов с АГ.
Таким образом, стоит отметить, что больные с атеросклерозом сосудов нижних конечностей с сопутствующей АГ, проживающие в горных условиях на загрязненной радионуклидами урана территории, на фоне изменения липидного спектра, имея повышенное содержание провоспалительных цитокинов, даже при гемодинамически незначимых формах атеросклероза сосудов нижних конечностей без окклюзии и стеноза должны быть отнесены к группе высокого риска прогрессирования атеросклеротического процесса.
Выводы
У больных атеросклерозом сосудов нижних конечностей с сопутствующей гипертонической болезнью, проживающих в горных условиях вблизи урановых хвостохранилищ, появление повышенных значений провоспалительного цитокина ИЛ-6 на фоне референсных значений противовоспалительного цитокина ИЛ-10 свидетельствует о нарушении локального функционирования цитокиновой системы и относительной депрессии противовоспалительного механизма иммунной защиты.
Для определения нарушения равновесия цитокинового баланса у данных больных необходимо рассчитать соотношение ИЛ-6/ИЛ-10 как маркер выраженности воспалительного процесса.
Дисфункция цитокинового профиля у больных атеросклерозом сосудов нижних конечностей с сопутствующей гипертонической болезнью, проживающих в горных условиях вблизи урановых хвостохранилищ, проявляется независимо от изменений липидного спектра при нормолипидемии (при уровне общего ХС <5,0 ммоль/л, триглицеридов <1,7 ммоль/л и ХС ЛПНП <1,0 ммоль/л), гиперхолестеринемии (при уровне общего ХС >5,2) и гипертриглицеридемии (при уровне триглицеридов >1,7 ммлль/л), что требует дальнейшего изучения данной проблемы.
Источник