Роль белков при атеросклерозе
К настоящему времени накоплены многочисленные данные, дающие основание считать, что в патогенезе атеросклероза большое значение имеет воспалительный процесс. Это влияет не только на клиническое течение атеросклероза и заболеваний, развивающихся на его основе — ишемическая болезнь сердца, ишемическая болезнь головного мозга и др., но зачастую является причиной серьезных осложнений и нередко определяет их прогноз и исход.
Основанием для таких выводов служат данные, согласно которым у больных, погибших от острой коронарной недостаточности, фиброзная покрышка (наружная оболочка) атеросклеротических бляшек с разрывом и тромбом обычно инфильтрирована макрофагальными пенистыми клетками.
Относительно недавно при гистологическом исследовании бляшек, «ответственных» за развитие острого инфаркта миокарда, обнаружили преобладание Т-лимфоцитов и макрофагов именно в местах поверхностных эрозий и разрывов бляшек, причем активированные макрофаги располагались непосредственно под тромбом.
Исследованиями последних лет показано, что процесс атерогенеза во многом схож с обычным воспалением. Пусковым моментом обострения атеросклероза может быть воздействие инфекционного агента (вирусы, хлами-дии, другие возбудители) или аутоантигена.
Присоединяющийся воспалительный процесс в атеросклеротических бляшках сопровождается усиленной выработкой тканевого тромбопластина и матриксных металлопротеиназ, что повышает вероятность их разрыва и риск тромбоза.
Наличие хронического воспалительного процесса приводит к нарушению иммунитета у больных атеросклерозом. С помощью иммуноцитохимических методик в атеросклеротических бляшках установлена повышенная активность ферментов, способных разрушать элементы их капсулы. Считается, что такими ферментами являются желатиназы и некоторые металлопротеиназы. Наиболее вероятный источник продукции этих ферментов — макрофаги.
К иммунологическим маркерам атеросклероза, клиническое значение которых в последние годы наиболее интенсивно изучается, относятся белки острой фазы воспаления, показатели активации иммунитета (провоспалительные цитокины, их растворимые рецепторы, неоптерин), дисфункции эндотелия (клеточные молекулы адгезии, фактор Виллебранда), органонеспецифические аутоантитела и иммунные комплексы.
Известно, что характерным лабораторным признаком воспаления является увеличение синтеза белков острой фазы воспаления, к наиболее важным представителям которых относят:
• С-реактивный белок и
• сывороточный амилоид А и др.
Их синтез регулируется цитокином — интерлейкином-6 (ИЛ-6), который вследствие этого играет фундаментальную патофизиологическую роль в развитии воспаления.

С-реактивный белок (С-РБ) и атеросклероз
Среди острофазовых белков особенно большое клиническое значение придают С-РБ. В сыворотке крови здоровых людей С-РБ выявляется в очень низких концентрациях — около 0,8 мг/л (норма — менее 1,0 мг/л). Получены убедительные данные о том, что даже небольшое увеличение концентрации С-РБ (около 3 мг/мл), находящееся за пределами чувствительности стандартных методов его определения, отражает субклиническое воспаление сосудистой стенки.
Установлено, что увеличение уровня СРБ отражает как непосредственный риск развития сосудистых осложнений, так и отдаленный прогноз течения атеросклероза, вероятность атеротромбоза у здоровых мужчин и женщин среднего и пожилого возраста, у пациентов с острым коронарным синдромом, после операций на коронарных артериях. Кроме того, повышенное содержание С-РБ является прогностическим фактором преждевременной смерти, связанной с острой артериальной недостаточностью (инфаркты миокарда, инсульты, внезапная сердечная смерть) и сокращения продолжительности жизни лиц пожилого возраста в целом.
Появились сообщения о том, что С-РБ в крови пациентов может связываться с холестерином. Образовавшийся в результате этого белково-холестериновый комплекс обладает способностью легко проникать в субэндотелиальные слои артерий и тем самым вызывать быстрый рост атеросклеротических бляшек.
D. Morrow et al. (1998) изучали прогностическую значимость С-РБ и тропонина Т у больных нестабильной стенокардией и мелкоочаговым инфарктом миокарда. Выявлена тесная связь между этими тестами и 14-дневной смертностью у обследованных больных.
Показатели 14-дневной смертности у больных нестабильной стенокардией и инфарктом миокарда без зубца Q в зависимости от уровня С-РБ и тропонина Т в крови (по D. Morrow et al.)

Из данных, приведенных в таблице, видно, что в течение ближайших двух недель среди больных с острым коронарным синдромом (нестабильная стенокардия и мелкоочаговый инфаркт миокарда), у которых уровень С-РБ достигает > 1,55 мг% и сочетается с положительным результатом при определении тропонина Т, смертность увеличивается с 0,4 до 9,1 %, т.е. более чем в 20 (!) раз.
J. Danesh, P. Appleby, R. Peto по данным метаанализа оценивали значение таких маркеров острой фазы воспаления, как фибриноген, С-РБ, альбумин и количество лейкоцитов в крови. Авторы выявили, что высокий уровень фибриногена (максимально — 10,3 мкмоль/л, или 0,35 г%), С-РБ (максимально — 2,4 мг/л), увеличенное количество лейкоцитов (максимально -8,4 х 10%), а также низкий уровень альбумина (минимально — 38 г/л) достоверно увеличивают риск обострения ИБС.
К настоящему времени накоплено немало сообщений о важном прогностическом значении С-РБ у больных инфарктом миокарда. Еще в 1963 г. I. Kushner et al. показали, что некроз сердечной мышцы — мощный стимул для синтеза С-РБ, уровень которого достигает максимальной концентрации через 36-96 ч после развития инфаркта миокарда. Содержание С-РБ коррелирует с размерами очага некроза.
Увеличение концентрации С-РБ более 20 мг% является независимым фактором риска аневризмы левого желудочка, сердечной недостаточности и кардиальной смерти в течение первого года после перенесенного инфаркта миокарда. Если в остром периоде инфаркта миокарда отмечается низкий уровень С-РБ, то в ближайшие 6 месяцев наблюдается более благоприятное течение заболевания. Прогноз также более благоприятен, если на фоне тромболизиса достигается эффективная реперфузия и концентрация С-РБ снижается.
J. Danesh et al. проанализировали результаты проспективных исследований, в которых изучалась связь между этими показателями (уровень фибриногена, С-РБ и альбумина в крови, число лейкоцитов) и риском развития ИБС.
Относительный риск развития ИБС (по J. Danesh et al.)

Из таблицы следует, что между уровнем неспецифических маркеров острой фазы воспаления и риском развития ИБС существует определенная связь.
В ходе рандомизированного испытания Physician’s Health Study было показано, что у мужчин с высоким исходным уровнем С-РБ прием низких доз аспирина снижает риск развития инфаркта миокарда на 56 %. Уместно вспомнить («новое — это хорошо забытое старое»), что еще в 1980-1981 гг. А.Г. Мрочек в экспериментальных исследованиях убедительно показал, что не только аспирин, но и другие нестероидные противовоспалительные средства, в частности индометацин и особенно вольтарен, тормозят развитие экспериментального атеросклероза.
По-видимому, аспирин и нестероидные противовоспалительные средства в этих случаях не только ингибируют агрегацию тромбоцитов, но могут оказывать противовоспалительное и антиатерогенное действие.
— Читать далее «Сывороточный амилоид А (САА), неоптерин как маркеры атеросклероза»
Оглавление темы «Атеросклероз»:
- Метаболический синдром как причина атеросклероза
- Оральные контрацептивы как причина атеросклероза. Роль половых гормонов в атерогенезе
- Болезни щитовидной железы как причина атеросклероза
- Неправильное питание как причина атеросклероза — советы по диете
- Гомоцистеиновая теория атеросклероза — теория дефицита фолиевой кислоты
- Вирусная теория атеросклероза
- Воспалительная теория атеросклероза — значение С-реактивного белка (С-РБ)
- Сывороточный амилоид А (САА), неоптерин как маркеры атеросклероза
- Формирование атеросклеротической бляшки — морфология атеросклероза
- Нарушение функции эндотелия сосудов при атеросклерозе — патогенез
Источник
Одним из самых ярких и клинически значимых нарушений обмена липопротеинов является атеросклероз.
Атеросклероз
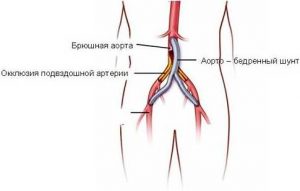
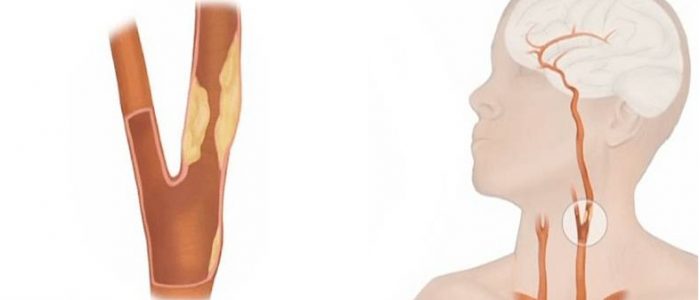
Атеросклероз – это отложение холестерина и его эфиров в соединительной ткани стенок артерий, в которых выражена механическая нагрузка на стенку (по убыванию воздействия): абдоминальная аорта, коронарная артерия, подколенная артерия, бедренная артерия, тибиальная артерия, грудная аорта, дуга грудной аорты, сонные артерии.
Стадии атеросклероза
Морфологически выделяют четыре стадии атеросклероза. Первая и вторая стадии распространены широко и при правильном питании являются обратимыми, 3 и 4 стадии уже имеют клиническое значение и необратимы.
1 стадия – повреждение эндотелия
Это «долипидная» стадия, обнаруживается даже у годовалых детей. Изменения этой стадии неспецифичны и ее могут вызывать: дислипопротеинемия, гипертензия, повышение вязкости крови, курение, вирусные и бактериальные инфекции, свинец, кадмий и т.п.
На этой стадии в эндотелии создаются зоны повышенной проницаемости и клейкости. Внешне это проявляется в разрыхлении и истончении (вплоть до исчезновения) защитного гликокаликса на поверхности эндотелиоцитов, расширении межэндотелиальных щелей. Это приводит к усилению выхода моноцитов и липопротеинов (ЛПНП и ЛПОНП) в интиму.
2 стадия – стадия начальных изменений
Отмечается у большинства детей и молодых людей.
Поврежденный эндотелий и активированные тромбоциты вырабатывают медиаторы воспаления, факторы роста, эндогенные окислители. В результате через поврежденный эндотелий в интиму сосудов еще более активно проникают моноциты и способствуют развитию воспаления. При этом ЛПНП, попавшие под интиму, начинают изменяться (модифицироваться), т.е. подвергаются окислению, гликозилированию, ацетилированию.
Моноциты, преобразуясь в макрофаги, активно поглощают измененные липопротеины при участии «мусорных» рецепторов (scavenger [‘skævɪnʤə] receptors). Таким образом, поглощение модифицированных ЛПНП макрофагами идет без участия апоВ-100-рецепторов, а, значит, нерегулируемо.
При поглощении модифицированных липопротеинов макрофаги активируются, выделяют цитокины и разнообразные факторы роста, которые стимулируют деление гладкомышечных клеток, синтез межклеточного вещества, и играют роль в развитии атеросклеротической бляшки.
Модификация липопротеинов в зоне воспаления является непосредственной биохимической причиной атеросклероза.
Окисление ЛПНП нарастает при недостаточной активности антиоксидантных систем – гиповитаминозах Е и С, нехватке металлов (железо, селен, медь, цинк), входящих в состав антиоксидантных ферментов каталазы, пероксидазы, супероксиддисмутазы.
Гликозилирование белков ЛПНП ускоряется при сахарном диабете или при других хронических гипергликемиях. Такие модифицированные липопротеины теряют способность связываться с апоВ-100-рецептором и проникать в клетки-мишени и, в результате, накапливаются в крови и в интиме сосудов.
Под действием факторов роста гладкомышечные клетки медии мигрируют в интиму и начинают пролиферировать, превращаясь в макрофагоподобные клетки. Они также накапливают модифицированные ЛПНП.
Накопление липидов в макрофагах быстро исчерпывает невысокие возможности клеток по утилизации свободного и этерифицированного ХС. Они переполняются стероидами и превращаются в пенистые клетки. Внешне на эндотелии появляются липидные пятна и полоски.
Процесс развития атеросклероза (в динамике слева-направо)
3 стадия – стадия поздних изменений
Продолжают развертываться и приобретают масштабность события, начавшиеся на второй стадии.
Внешне проявляется как выступание поверхности в просвет сосуда. Стадия дополнительно характеризуется следующими особенностями:
- увеличение количества коллагена, эластина и гликозаминогликанов, т.е. накопление межклеточного вещества,
- пролиферация и гибель пенистых клеток (апоптоз),
- накопление в межклеточном пространстве свободного ХС и этерифицированного ХС,
- инкапсулирование холестерола и формирование фиброзной бляшки.
4 стадия – стадия осложнений
На этой стадии происходят:
- кальцификация бляшки и ее изъязвление, приводящее к эмболии сосудов,
- тромбоз из-за адгезии и активации тромбоцитов,
- разрыв сосуда.
Основы лечения
В лечении атеросклероза обязательно должны быть две составляющие: диета и медикаменты. Целью лечения является снижение концентрации общего ХС плазмы, ХС ЛПНП и ЛПОНП, повышение концентрации ЛПВП.
Диета
1. Обеспечение организма витаминами: аскорбиновой кислотой, пантотеновой (коэнзим А) и никотиновой (НАДФ) кислотами, что способствует превращению холестерола печени в желчные кислоты (синтез желчных кислот). Для снижения окислительной модификации ЛПНП необходим витамин Е.
2. Снижение калорийности пищи за счет углеводов и жиров. Жиры пищи должны включать равные доли насыщенных, мононенасыщенных и полиненасыщенных жирных кислот. Доля жидких жиров, содержащих полиненасыщенные жирные кислоты (ПНЖК), должна быть около 30% от всех жиров, но не меньше 15 г/сут. Роль ПНЖК в лечении гиперхолестеролемии и атеросклероза сводится к:
- ограничению всасывания ХС в тонком кишечнике,
- активации синтеза фосфатидилхолина, что снижает вязкость желчи и облегчает ее отток в кишечник,
- усилению желчеотделения,
- снижению синтеза ЛПНП в печени и секреции их в кровь,
- увеличению синтеза ЛПВП и концентрации их в крови, что способствует удалению холестерина из тканей в печень.
3. Обеспечение организма чистой водой до физиологических норм (1,0-1.5 л/сут), что препятствует сгущению желчи.
4. Потребление высоких количеств овощей, содержащих целлюлозу (капуста, морковь, свекла) для усиления перистальтики кишечника, стимуляции желчеотделения и снижения всасывания ХС.
5. Умеренная физическая нагрузка – способствует синтезу ЛПВП и, значит, оттоку холестерина от тканей в печень.
Медикаменты
1. Препараты ω6- и ω3-жирных кислот (Линетол, Эссенциале, Омеганол и т.п.) повышают концентрацию ЛПВП в плазме, ускоряют отток ЛПНП в печень, стимулируют желчеотделение.
2. Подавление всасывания ХС в желудочно-кишечном тракте – анионообменные смолы (Холестирамин, Холестид, Questran).
3. Высокие дозы никотиновой кислоты подавляют мобилизацию жирных кислот из депо и снижают синтез ЛПОНП в печени, а, следовательно, и образование из них ЛПНП в крови.
4. Фибраты (клофибрат и т.п.) увеличивают активность липопротеинлипазы, ускоряют катаболизм ЛПОНП и хиломикронов, что повышает переход холестерола из них в ЛПВП и его эвакуацию в печень.
5. Статины (ловастатин, флувастатин) ингибируют ГМГ-SКоА-редуктазу, что снижает в 2 раза синтез ХС в печени и ускоряют его отток из ЛПВП в гепатоциты.
Предложены и совсем радикальные способы:
6. Подавление функции энтероцитов с помощью антибиотика неомицина, что снижает всасывание жиров.
7. Хирургическое удаление подвздошной кишки и прекращение реабсорбции желчных кислот.
Источник

Так, что же предпочесть?
Дорогой читатель, согласитесь, что если хорошо понимать причины атеросклероза, то можно найти и пути его профилактики. На сегодняшний момент доказано, что атеросклероз развивается при нарушении обмена транспортных белков и триглицеридов. А холестерин в этом процессе играет роль «троянского коня». И, что просто замечательно, так это то, что, в отличие от холестерина, чье производство регламентируется состоянием клеточных оболочек, уровень транспортных белков и триглицеридов в нашем обмене напрямую зависит от вида и количества принимаемой пищи. Другими словами, МЫ МОЖЕМ РЕГУЛИРОВАТЬ ЭТОТ УРОВЕНЬ СОЗНАТЕЛЬНО!
Жиры способны создавать запасы в организме, а вот у белков НЕТ такой природной функции. Именно с этим связано бесчисленное количество проблем со здоровьем нашего современника, так как человек состоит из белков. «Сердце» клетки — ядро, есть совокупность аминокислот, объединяющихся в белки. Тысячи гормонов, биологически активных веществ и ферментов являются белками. Наше тело перемещается в пространстве благодаря работе мышечной белковой массы, а главный защитник – иммунитет, «стоит» на иммуноглобулинах — особом классе белков. Транспорт любых веществ по крови и другим жидкостям вновь возложено на белки. Перечислять можно и дальше.
В сутки нам надо не менее одного — полутора граммов этого компонента на каждый килограмм веса. Это количество зависит от пола, возраста и уровня физической нагрузки. А что же мы имеем на самом деле? Как считают ученые, основные современные болезни, ВКЛЮЧАЯ И АТЕРОСКЛЕРОЗ, появились вместе с началом использования огня для приготовления пищи. Подтверждением служит факт отсутствия в дикой природе инфарктов, сахарного диабета, и ожирения, как вида нарушения жирового обмена. Этому подвержены только домашние животные, питающиеся «с нашего стола».
Дело в том, что белок необратимо меняет свою структуру уже при температуре выше 42 градусов, что называется в биохимии денатурацией или свертыванием. Такой белок нам легче разжевать и съесть, но полноценно использовать его во всех необходимых биохимических процессах организм не может. Для этого нужны строго специализированные гормоны и ферменты, а их-то и нет. Миллионы лет человек жил в дикой природе, не нуждаясь в предварительной тепловой обработке пищи. Вся его ферментная система формировалась на натуральных продуктах, которые «росли на земле, бегали, плавали или летали». Но вот пришел огонь, оседлый образ жизни, изобилие мясной пищи от домашнего скота, а с ними и определенные проблемы со здоровьем.
 Именно преимущественно пастеризованная и вареная пища приводит к ТОТАЛЬНОМУ ДЕФИЦИТУ БЕЛКА во всех звеньях обмена веществ, включая и его транспортную фракцию. Организм вынужден приспосабливаться к такой ситуации путем увеличения удельного веса перевозимых веществ на единицу транспортного белка.
Именно преимущественно пастеризованная и вареная пища приводит к ТОТАЛЬНОМУ ДЕФИЦИТУ БЕЛКА во всех звеньях обмена веществ, включая и его транспортную фракцию. Организм вынужден приспосабливаться к такой ситуации путем увеличения удельного веса перевозимых веществ на единицу транспортного белка.
Посмотрите, как трудится велосипед, везущий груз в несколько раз превышающий по размерам бедную машину. Но в организме-то эти «машины» должны проникнуть в мельчайшие сосуды – в капилляры, чей диаметр гораздо меньше этих крупных комплексов, называемых ЛПНП или «плохим» холестерином. Вот и бегают они только в КРУПНЫХ артериях, сбрасывая свой большой груз только при необходимости реконструкции поврежденных клеток этих самых артерий.
Хорошо, что одновременно с крупными комплексами белков с жирами по крови перемещаются и нормальные по размеру их объединения — ЛПВП или «хороший» холестерин, поэтому клетки, получающие свое довольствие только из капилляров, все же имеют столь необходимый холестерин, но в НЕДОСТАТОЧНОМ КОЛИЧЕСТВЕ. Об этом тут же в ЦНС посылается соответствующий «рапорт» и производство холестерина в печени УВЕЛИЧИВАЕТСЯ.
В подобной ситуации направленное уменьшение холестерина лекарственными средствами — статинами, во-первых, бесполезно. Как только лекарство будет выведено из организма, холестерин вновь начнет вырабатываться в нужных на данный момент количествах. Во-вторых, от подобного «лечения» непоправимо пострадают клетки печени, против работы которых и направлено в основном действие статинов. В-третьих, в момент действия лекарства клетки всего организма оказываются, в прямом смысле, в «блокадном режиме», так как лишены спасительного для них холестерина.
Получается ситуация, когда под «лечением» понимают только нормализацию уровней холестерина в крови, не принимая во внимание причины повышения этого уровня.
Итак, НЕДОСТАТОК ТРАНСПОРТНЫХ, да и других видов БЕЛКОВ – это один из виновников раннего ухода из жизни наших современников. О втором «соучастнике» этого процесса –ТРИГЛИЦЕРИДАХ, читаем дальше…
About Ðина ÐайкÑлова
ÐÑивеÑÑÑвÑÑ ÐÐ°Ñ Ð½Ð° Ñвоем блоге! Ðго задаÑей Ñ ÑÑиÑÐ°Ñ Ð¿Ð¾Ð¼Ð¾ÑÑ ÑиÑаÑелÑм в знакомÑÑве Ñ ÑобÑÑвеннÑм оÑганизмом и его неиÑÑеÑпаемÑми возможноÑÑÑми по Ð½Ð°Ð²ÐµÐ´ÐµÐ½Ð¸Ñ Ð¸ ÑÐ¾Ñ ÑÐ°Ð½ÐµÐ½Ð¸Ñ Ð²Ð½ÑÑÑеннего поÑÑдка. ÐаÑÑÑение Ñакого поÑÑдка и еÑÑÑ Ð½Ð°Ñи болезни. ÐÑли Ð±Ñ ÑолÑко не меÑаÑÑ ÐµÐ¼Ñ Ð² ÑÑой ÑабоÑе, но мÑ. лÑди…..
Источник