Понятие об анемии и эритроцитозе
Вопрос:
Понятие об анемиях и эритроцитозах;
их виды, значение для организма.
- Анемии. Их классификация, значение для организма.
У здорового человека концентрация
гемоглобина в периферической крови
составляет 120–140 г./л для женщин и 130–160 г./л
для мужчин. Количество эритроцитов в
норме у женщин равняется 3,90–4,70х1012
/л, у мужчин – 4,00–5,50х1012
/л.
Анемия (малокровие) – клинико-гематологический
синдром, характеризующийся снижением
количества эритроцитов и / или концентрации
гемоглобина в единице объема периферической
крови.
Различают истинную анемию
и гидремию.
Истинной
анемией называется снижение абсолютного
количества эритроцитов и гемоглобина
в организме.
Гидремия – разжижение крови за счет обильного
притока в кровь тканевой жидкости, наблюдается
у больных в период схождения отеков. При
этом количество эритроцитов и гемоглобина
в единице объема крови уменьшается, а
в организме – нет.
При оценке гематологических
показателей при анемиях следует
учитывать, во-первых, диаметр эритроцитов;
во-вторых, количество ретикулоцитов;
в третьих, насыщение эритроцитов гемоглобином;
в четвертых – тип кроветворения.
Классификация анемий
по диаметру эритроцитов. По диаметру эритроцитов все
анемии делят на 4 типа:
- микроцитарные, диаметр менее 6,0–7,0 мкм;
- нормоцитарные, диаметр 7,0–8,0 мкм;
- макроцитарные, диаметр 9,0–11,0 мкм;
- мегалоцитарные, диаметр больше 12,0–13,0 мкм.
Классификация анемий
по количеству ретикулоцитов. Эта классификация учитывает
регенераторную способность костного
мозга. Регенераторная способность костного
мозга – это его способность увеличивать
продукцию эритроцитов при их потерях
или повышенном разрушении. При достаточной
регенераторной способности костный мозг
стремиться быстро восполнить потери
эритроцитов. Для этого усиливается пролиферации
эритрокариоцитов – предшественников,
ускоряется дифференцировка эритрокариоцитов,
усиливается вымывание их в периферическую
кровь.
При этом в кровь поступают
не только зрелые эритроциты, но и ретикулоциты,
причем выраженный ретикулоцитоз (до
50–100–150 и даже более промилле) является
хорошим прогностическим признаком и
свидетельствует об адекватности назначенной
терапии.
В условиях здоровья в крови
должно содержаться 2–12 промилле ретикулоцитов,
этот показатель определяют в лаборатории.
При анемиях недостаточно
определить содержание ретикулоцитов
в промилле. Опираясь на полученную
из лаборатории цифру, нужно рассчитать
абсолютное содержание ретикулоцитов
в 1 литре крови.
Расчет: 1) общее количество
эритроцитов принять за 100 %;
2) перевести промилле
в проценты (разделить на 10);
3) методом пропорции рассчитать
численность ретикулоцитов.
При хорошей регенераторной
способности костного мозга в
условиях анемий абсолютное количество
ретикулоцитов равно 1,0–5,0х1011/л.
Эта величина показывает, достаточную
или недостаточную компенсаторную
активность проявляет костный мозг
при анемиях. Этот показатель не рассчитывают
в условиях здоровья.
По регенераторной способности
костного мозга различают следующие
формы анемий:
- регенераторная анемия – абсолютное количество ретикулоцитов составляет 1,0–5,0х1011/л., костномозговая компенсация потери эритроцитов достаточная;
- гипорегенераторная (или арегенераторная) анемия – абсолютное количество ретикулоцитов менее 1,0–5,0х1011/л., регенераторные возможности снижены, уровень костномозговой компенсации недостаточный;
- гиперрегенераторная анемия – абсолютное количество ретикулоцитов больше 1,0–5,0х1011/л., регенерация чрезмерна.
Классификация анемий по насыщенности
эритроцитов гемоглобином. За основной
критерий принимают цветовой показатель
(ЦП), который в норме равняется 0,86–1,1.
Различают анемии гипохромные (ЦП меньше
0,86), нормохромные (ЦП составляет 0,86–1,1)
и гиперхромные (ЦП больше 1,1).
Классификация анемий в соответствии
с типом кроветворения. Различают нормобластический
и мегалобластический тип кроветворения.
Выделяют:
- Анемии с нормобластическим типом кроветворения, когда деление и созревание эритроидных клеток от эритробласта до эритроцита происходит через следующие стадии: эритробласт → пронормобласт → нормоцит базофилоьный → нормоцит полихроматофильный → нормоцит оксифильный → ретикулоцит → эритроцит. Нормобластический тип кроветворения соответствует большинству анемий.
- Анемии с мегалобластическим типом кроветворения, когда эритропоэз идет в условиях дефицита витамина В12 и / или фолатов. В основе мегалобластического типа кроветворения лежат нарушения процессов синтеза ДНК кроветворными клетками-предшественницами. Характерно наличие мегалобластов в костном мозге, а также мегалоцитов и гиперхромных макроцитов в периферической крови. Мегалоцитопоэз проходит следующие стадии: промегалобласт → мегалобласт базофильный → мегалобласт полихроматофильный → мегалобласт оксифильный → мегалоцит. При В12 – (фолиево) – дефицитных анемиях этот тип кроветворения сосуществует с нормобластическим.
Классификация анемий по механизму
развития.
- Гипоэритропоэтические (дизэритропоэтические) анемии связаны с нарушением образования эритроцитов. В свою очередь нарушение эритропоэза возможно за счет преимущественного поражения стволовых клеток или преимущественного повреждения клеток-предшественниц миелопоэза и / или эритропоэза.
- Гемолитические анемии связаны с уменьшением средней продолжительности жизни и / или повышенным разрушением эритроцитов.
- Постгеморрагические анемии – это анемии вследствие острых и хронических кровопотерь
Гипоэритропоэтические
анемии, обусловленные поражением стволовых
клеток
К ним относятся гипопластические
и апластические анемии. Гипоапластические
анемии развиваются в результате повреждения
стволовых клеток и редукции или истощения
эритроидных, миелоидных и мегакариоцитарных
элементов в костном мозге. Проявляются
периферической панцитопенией и соответствующими
клиническими симптомами, имеют тяжелые
последствия в виде снижения продолжительности
жизни и быстрой гибели больного после
момента установления диагноза (1–2 года).
Гистологическое исследование выявляет
сокращение плацдарма кроветворения и
замещение кроветворного костного мозга
жировой тканью.
В соответствии с современной
классификацией гипоапластические анемии
относятся к миелодиспластичеескому
синдрому. Миелодиспластический синдром
включает в себя также сидеробластную
анемию и ночную пароксизмальную гемоглобинурию
из класса гемолитических анемий.
Врожденные (первичные)
гипоапластические анемии – примером служит анемия Фанкони,
аутосомно-рецессивное заболевание, в
основе которого лежит нарушение репарации
ДНК. Сочетает классические признаки апластической
анемии с другими пороками развития (аномалии
скелета и мягких тканей, пороки развития
почек, сердца, гипоплазия кроветворной
ткани, которая выявляется уже в раннем
детстве). Продолжительность жизни таких
больных не более двадцати лет, и погибают
они, как правило, от злокачественных новообразований
различных органов.
Приобретенные (вторичные)
гипоапластические анемии – это результат действия одного
или нескольких факторов: физических,
химических, инфекционных. Кроме того,
около 75 % диагносцированных гипоапластических
анемий являются идиопатическими, т. е.
не имеют ясной этиологии
Среди физических
факторов особого внимания заслуживает
ионизирующее облучение. Гипоаплазия
костного мозга развивается при различных
дозах облучения. Степень выраженности
гипоаплазии прямо пропорционально зависит
от дозы. В основе патогенеза анемии лежит
необратимое повреждение и гибель стволовых
клеток, вплоть до их полного исчезновения,
наблюдающегося при аплазии.
К химическим
веществам, способных вызывать гипоаплазию
можно отнести цитостатические и другие
лекарственные препараты, инсектициды,
производные мышьяка и бензола, анилиновые
красители.
Причиной развития апластической
анемии могут явиться некоторые инфекционные
заболевания. Среди них сепсис,
гистоплазмоз, инфекционный мононуклеоз,
вирусный гепатит, туберкулез.
Патогенез приобретенных
гипоапластических анемий не вполне ясен.
В настоящее время наиболее возможными
ключевыми механизмами считают:
- иммунную депрессию кроветворения;
- внутренние аномалии стволовых клеток.
Иммунная
депрессия кроветворения – возникает в ответ на действие
этиологического фактора, заключается
в изменении антигенного состава мембраны
стволовых клеток и активации Т-лимфоцитов-супрессоров.
Продукция Т-супрессоров – цитокины гамма-ИФН
и альфа-ФНО, которые являются потенциальными
ингибиторами костномозгового кроветворения.
Внутренние
аномалии стволовых клеток – это неблагоприятные мутации
в геноме стволовых клеток и связанные
с ними нарушение пролиферации и дифференцировки
стволовых клеток.
Костно-мозговое
кроветворение Характерено сниженное количество
эритрокариоцитов, уменьшение их чувствительности
к эритропоэтину, усиление неэффективного
эритропоэза и усиление апоптоза эритроидных
клеток. Также имеет место угнетение всех
ростков гемопопоэза. Клетки костного
мозга плохо утилизируют железо и слабо
синтезируют ДНК. При этой патологии повышено
сывороточное железо и нередким осложнением
может стать гемосидероз органов.
Особенности
периферической крови при гипоапластических
анемиях. Гипоапластическая анемия носит
нормохромный (реже-гипохромный) и гипоарегенераторный
характер. Отмечается тромбоцитопения
(и, как следствие, геморрагический синдром,
появление на коже синяков и петехий).
Характерна лейкопения в результате абсолютной
гранулоцитопении, относительный лимфоцитоз.
О тяжести депрессии кроветворения принято
судить именно по степени лейкопении.
Ее нарастание является признаком прогрессирования
болезни и совпадает с ухудшением состояния
больного. С лейкопенией связано ослабление
фагоцитарной функции лейкоцитов и септические
поражения слизистой рта, зева (стоматиты,
гингивиты, ангина). Причинами гибели больных
нередко является септическая пневмония
и септический шок.
Гипоэритропоэтические
анемии, обусловленные преимущественным
повреждением клеток-предшественниц миелопоэза
и / или эритропоэза
В этой группе анемий принято
выделять следующие формы:
- анемии вследствие нарушения синтеза нуклеиновых кислот (В12 и Вс – дефицитные анемии);
- анемии в результате нарушения синтеза гема (Fe – дефицитная и порфиринодефицитная анемии);
- анемии вследствие нарушения синтеза глобинов (талассемии);
- анемии в результате нарушения регуляции деления и созревания эритрокариоцитов.
Гипоэритропоэтические
анемии вследствие нарушения синтеза
нуклеиновых кислот
К ним относятся В12 и Вс
– дефицитные анемии.
В12 – дефицитная и Вс
– дефицитная анемии являются двумя различными
типами мегалобластических анемий, но
поскольку отсутствие витамина В12
(кобаламина) вызывает «капкан» метилфолата
из-за невозможности его восстановления,
дефицит В12 неизбежно приводит к
дефициту фолатов.
Классической формой В12
– дефицитной анемии является злокачественное
пернициозное малокровие (пернициозное
малокровие Аддисона-Бирмера).
В12 и Вс – дефицитные
анемии характеризуются нарушением синтеза
ДНК и носят название мегалобластических
анемий. Витамин В12 (цианокобаламин)
и фолиевая кислота участвуют в метаболизме
клеточных ядер, являясь коэнзимами в
процессах синтеза ДНК, и их недостаток
ведет к дефектам созревания ядра, что
нарушает процессы деления клетки. В то
же время синтез РНК и белков клеточной
цитоплазмы остается ненарушенным, поскольку
они не связаны с синтезом ДНК, и это также
замедляет или блокирует митотическое
деление клетки. Таким образом, важнейшей
чертой патогенеза мегалобластического
кроветворения является асинхронность
процессов созревания цитоплазмы и ядра
клетки, приводящая к появлению в костном
мозге и периферической крови клеток-предшественников
и потомков этого аномального кроветворения.
Мегалобластическое кроветворение
наблюдается в норме только в эмбриональном
периоде, полностью переходя в постнатальном
периоде на нормобластический эритропоэз.
Характерной особеннстью мегалобластического
кроветворения является ранняя гемоглобинизация
цитоплазмы при сохранившейся еще нежной
структуре ядра. При этом мегалобласты
утрачивают способность нормально вызревать
до конечной безъядерной стадии своего
развития, т.е. мегалоцита. Большая часть
мегалобластов распадается в самом костном
мозге, и только незначительная часть
вызревает, обезъядривается и поступает
в периферическую кровь. Под влиянием
специфической терапии, содержащей витамин
В12 происходит обратное развитие
патологического мегалопоэза и восстановление
нормобластического кроветворения, о
чем свидетельствует появление ретикулоцитарного
криза.
Конечная клетка мегалобластического
ряда – мегалоцит
– это крупная (10 – 15 мкм) несколько эллиптической
формы, насыщенная гемоглобином. Процент
ретикулоцитов среди мегалоцитов значительно
ниже, чем среди нормоцитов. Появление
ретикулоцитарного криза у больных предвещает
наступление ремиссии.
Мегалоциты хуже выполняют
свою функцию по доставке кислорода к
тканям, чем обычные эритроциты. Существует
несколько причин этого явления:
(для
внутрикафедрального пользования)
МИНИСТЕРСТВО
ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УО
«ГОМЕЛЬСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ»
Кафедра
патологической
физиологии
Утверждено
на заседании кафедры
протокол
№
7 от 31.08.2015
Зав.
кафедрой патофизиологии, к.м.н.
доцент_____________Т.С.
Угольник
Учебно-методическая
разработка для студентов
лечебного
факультета
Гомель
2015
Патофизиология системы крови. Гемолитические анемии. Эритроцитозы
Актуальность
темы: Гемолитические
анемии различны по этиологии, механизмам
развития, клинико-гематологической
картине, поэтому изучение этих видов
анемий особенно важно в практической
деятельности врача.
2.
Цель занятия:
изучить этиологию, патогенез и основные
проявления гемолитических анемий.
3.
Задачи занятия: Знать
классификацию, этиологию и патогенез
гемолитических анемий. Изучить основные
нарушения и компенсаторно-приспособительные
процессы в организме при анемиях и
полицитемиях.
Основные учебные вопросы (план):
Патология
системы эритрона. Анемии и эритроцитозы,
определение понятий, принципы
классификации, общая характеристика.Анемии
при лейкозах и других опухолевых
процессах.Наследственные
гемолитические анемии: эритроцитопатии,
эритроэнзимопатии, гемогобинопатии
причины и механизмы развития.Приобретенные
гемолитические анемии: виды, причины,
механизмы развития, проявления в
органах кроветворения и в периферической
крови.Роль
аутоиммунных процессов в патогенезе
анемий. Аутоиммунные гемолитические
анемии.Эритроцитозы
первичные и вторичные: причины, механизмы
развития, проявления в органах
кроветворения и в периферической
крови.Нарушения
и компенсаторно-приспособительные
процессы в организме при анемиях и
эритроцитозах.Принципы
терапии анемий.
5. Вспомогательные материалы по теме:
Группа
анемий, наследственно обусловленных
или приобретенных, общим признаком
которых является укорочение жизни
эритроцитов. При этом имеет место стойкое
(хроническая ГА) или массированное
(острая ГА) преобладание разрушения
эритроцитов над их образованием.
Проявляется заболевание синдромами
усиленного гемолиза и компенсаторного
усиления эритропоэза. Усиление гемолиза
(гемолитические кризы) наблюдается при
всех ГА и нередко развивается после
интеркуррентных заболеваний, большой
физической нагрузки, в результате
стрессов, интоксикаций и т. д. В ряде
случаев провоцирующий агент установить
не удается.
Классификация га:
I. Наследственные:
– эритроцитопатии
(мембранопатии);
– ферментопатии
(энзимопатии);
– гемоглобинопатии
(гемоглобинозы).
II. Приобретенные:
Иммунные
формы:
изоиммунные
гетероиммунные
формыаутоиммунные
формы
Неиммунные
формы:
токсико-гемолитические
инфекционные
механические
Развитие
наследственных ГА обусловлено внутренними
аномалиями эритроцитов (эндоэритроцитарные);
приобретенных — влиянием факторов,
действующих вне эритроцита
(экзоэритроцитарные).
Гемолиз
эритроцитов
при гемолитических анемиях может
происходить внутриклеточно (так же как
и физиологический гемолиз), или
непосредственно в сосудах. В связи с
этим выделяют 2 типа патологического
гемолиза:
1.
Внутриклеточный гемолиз—
разрушение «маркированных» иммуноглобулином
(Ig) G эритроцитов в РЭС при наследственной
патологии мембраны эритроцитов,
нарушениях активности ферментов, синтеза
гемоглобина, при несовместимости по
эритроцитарным антигенам между матерью
и плодом и при гемотрансфузиях.
2.
Внутрисосудистый гемолиз
— комплементзависимый лизис «маркированных»
IgM (реже IgG) эритроцитов непосредственно
в кровотоке (в сосудах) при действии
каких-либо внешних факторов, которые
вызывают прямое или опосредованное
повреждение клеток. Причиной этого
может быть разрушение мембраны эритроцитов
вследствие механической травмы (при
окклюзии сосудов, гемодиализе, протезах
клапанов сердца и др.), под влиянием
физических (ионизирующая радиация,
высокая температура), токсических (при
действии экзо- и эндотоксинов), инфекционных
и иммунных (при образовании антиэритроцитарных
аутоантител) патологических факторов.
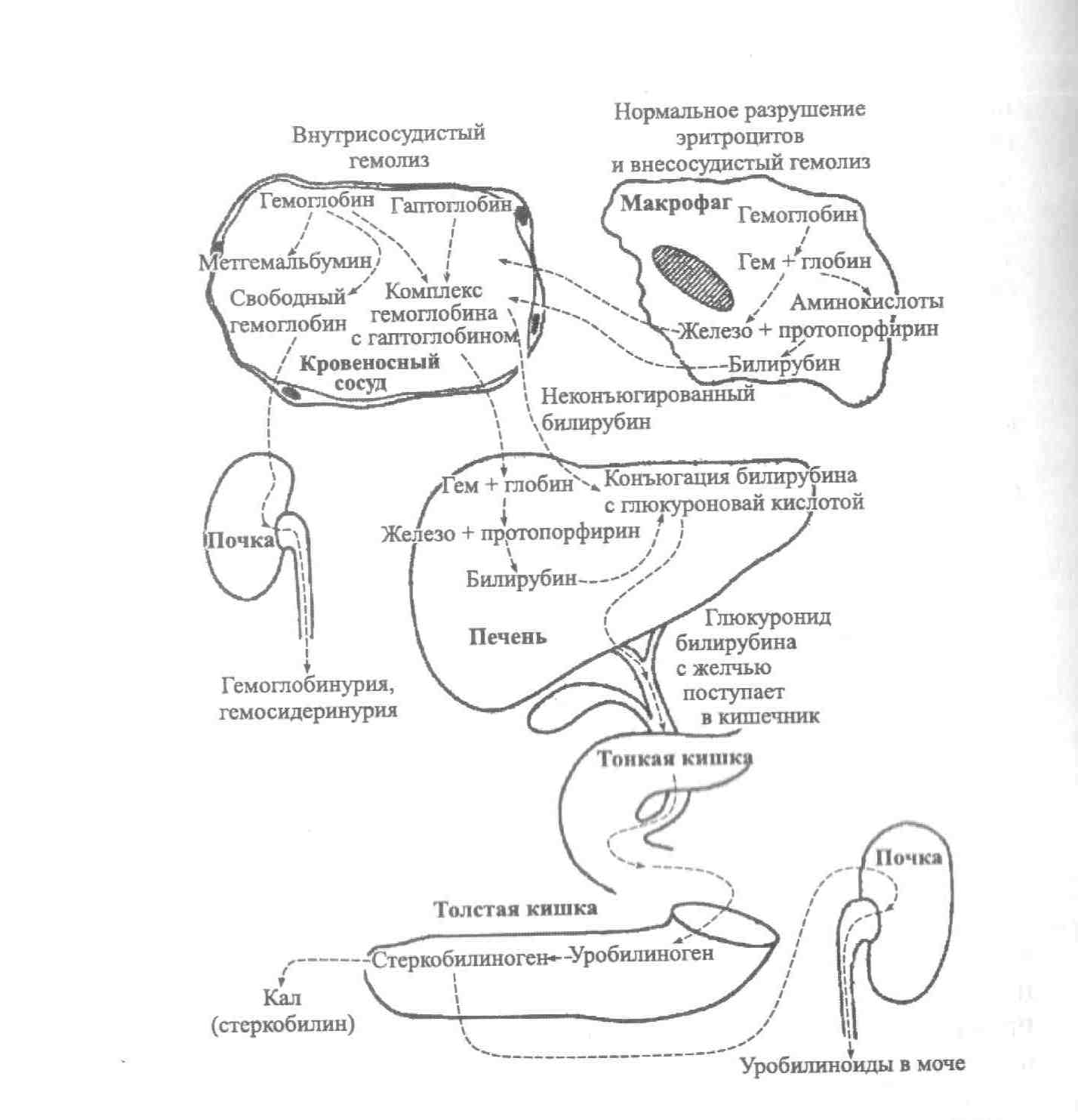
Рисунок
— 1. Механизмы внутрисосудистого и
внутриклеточного гемолиза.
Внутриклеточный
гемолиз
происходит внутри фагоцитов. Из
разрушенных эритроцитов освобождается
гемоглобин, который затем распадается
на глобин, железо и протопорфирин. Глобин
под действием протеолитических ферментов
расщепляется на аминокислоты, с плазмой
они переносятся во внутренние органы
для дальнейшего синтеза белков. Железо
при помощи трансферрина транспортируется
в кровь, затем в костный мозг и в органы,
депонирующие железо (преимущественно
в печень). Протопорфирин превращается
в биливердин, а затем в билирубин
(неконъюгированный билирубин), который
транспортируется альбумином в клетки
печени, где связывается с глюкуроновой
кислотой и метаболизируется в диглюкуронид.
Диглюкуронид выделяется в желчь, а затем
в кишечник, где превращается в уробилиноген,
затем стеркобилиноген и выводится с
мочой (уробилиноиды) и калом.
При
внутрисосудистом
гемолизе
эритроциты распадаются в кровеносном
русле, высвобожденный из эритроцитов
гемоглобин связывается с гаптоглобином
плазмы и транспортируется к клеткам
ретикулоэндотелиальной системы печени,
где происходит дальнейший распад
гемоглобина с образованием свободного
билирубина, который затем подвергается
глюкуронидированию. Не связавшийся с
гаптоглобином гемоглобин выводится с
мочой (гемоглобинурия, гемосидеринурия).
В
результате повышенного гемолиза
эритроцитов в крови накапливается
большое количество непрямого билирубина,
что приводит к развитию желтухи. Помимо
этого главным признаком повышенного
внутриклеточного гемолиза является
увеличение селезенки (спленомегалия),
в случаях внутрисосудистого разрушения
эритроцитов ведущим симптомом становится
появление гемоглобина в моче
(гемоглобинурия), что сопровождается
изменением ее окраски вплоть до черного
цвета (табл. 1).
Таблица
1.
Дифференциальные
признаки внутрисосудистого и
внутриклеточного гемолиза
Признаки | Виды | |
внутрисосудистый | внутриклеточный | |
Локализация | Сосуды | РЭС |
Локализация | Канальцы | Селезёнка, |
Желтушность | Умеренная | Выраженная |
Увеличение | Незначительное | Значительное |
Ведущие | Нормохромная | |
Гемоглобинемия Гемоглобинурия Гемосидеринурия | Гипербилирубинемия Повышенное | |
Все
формы малокровия, связанные с повышенной
гибелью эритроцитов периферической
крови, относятся к группе регенераторных
анемий с нормобластическим типом
эритропоэза.

