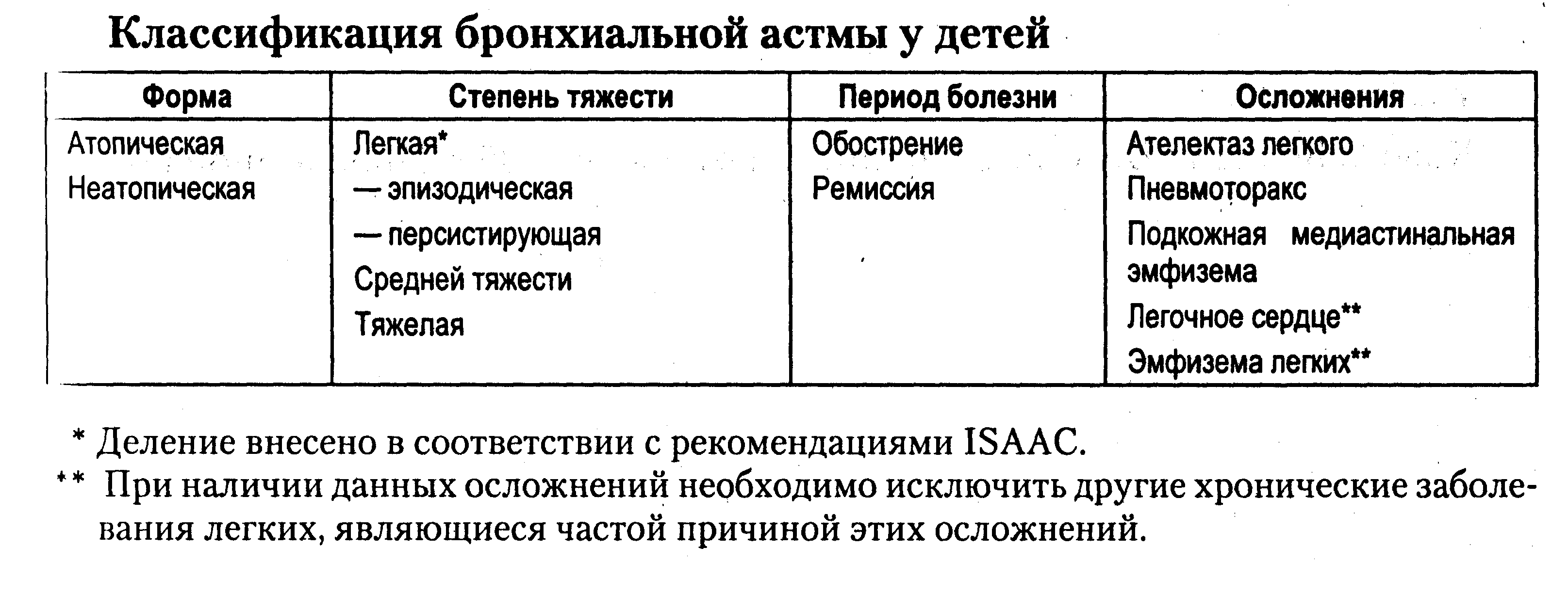
Показания к плазмаферезу при бронхиальной астме
Мембранный плазмаферез: возможности мембранного плазмафереза при лечении бронхиальной астмы
В последнее десятилетие успехи в лечении бронхиальной астмы (БА) в первую очередь связаны с широким применением ингаляционных кортикостероидов (ИКС). Согласно нормативным документам Министерства здравоохранения и международным консенсусам по лечению и профилактике БА, ИКС являются препаратами первой линии для долгосрочного лечения этого заболевания.

Положения, отраженные в согласительных документах по диагностике и лечению БА, в первую очередь базируются на роли воспаления в патогенезе БА и высокой чувствительности клеток-эффекторов к ИКС.
В большинстве случаев основные клинические проявления БА удается контролировать с помощью средних доз ИКС. Однако в ряде случаев для контроля основных клинических симптомов БА необходимо увеличивать суточную дозу ИКС до максимально допустимой или переходить на системную пероральную кортикостероидную терапию.
Кроме того, при дестабилизации течения БА наблюдается потеря чувствительности ß2-рецепторов к симпатомиметикам, что является причиной более частого использования ß2-агонистов короткого действия для купирования симптомов астмы.
В ряде исследований показана высокая эффективность лечебного плазмафереза у больных бронхиальной астмы (БА)
Показания к применению плазмафереза у больных БА могут быть самыми широкими и не требуют отмены базисной терапии.
Плазмаферез был впервые применен у больных БА С. Саггшап в 1978 году. Использование плазмафереза в первую очередь связывали с механическим удалением токсических веществ.
Дальнейшие исследовании показали, что многогранность лечебного действия плазмафереза нельзя объяснять исключительно механическим действием. В удаленной плазме находятся не только иммунные комплексы (ИК), но и продукты метаболизма различных клеток, а также биологически активные вещества. Снижение концентрации медиаторов воспаления ведет к восстановлению ß2-адренергической рецепции, уменьшает резистентность к бронхолитикам. Удаление плазмы при плазмаферезе способствует нормализации процессов перекисного окисления липидов и повышает активность антиоксидантной системы.
Особенность плазмафереза при бронхиальной астме
Его непосредственное лечебное действие. 83% пациентов отмечают клиническое улучшение непосредственно после первой процедуры. Еще одна особенность — частое ухудшение общего состояния, необходимость в дополнительном использовании ß2-симпатомиметиков через 2-3 ч после первого сеанса плазмафереза.
Как правило, такое явление носит кратковременный характер и не требует изменения базисной терапии
Последующие сеансы плазмафереза приводят к стабилизации состояния и дальнейшему клиническому улучшению, что связано, с более полной эфферентной терапией и удалением из организма антигенов-аллергенов, блокирующих рецепторы антител, продуктов тканевой деградации, ЦИК, лейкотриенов.
После сеанса плазмафереза улучшение клинических проявлений заболевания сохраняется в среднем 2-3 дня, максимум 7 дней. По нашему мнению, интервал между процедурами плазмафереза в 2-3 дня наиболее целесообразен. Увеличение интервала между сеансами более 5-6 дней ухудшает результаты лечения.
Один курс плазмафереза обычно включает от трех до пяти процедур, что зависит от индивидуальных особенностей течения заболевания, лабораторных показателей. В среднем удаляется за курс около 3 л плазмы, что составляет 1-1,5 ОЦП. При таком режиме плазмафереза не отмечаются существенные сдвиги в белковом спектре крови, электролитах, свертывающей системе крови.
Клиническое улучшение после проведённого курса плазмафереза достигает: от 6 месяцев до года, что определяется сроком накопления патологических продуктов в организме, таких, как ЦИК, цитотоксические лимфоциты, провоспалительные цитокины.
Многие пациенты отмечают повышение эффективности ß2-симпатомиметиков короткого действия после окончания курса плазмафереза. Динамика функции внешнего дыхания (ФВД) как объективный показатель эффективности лечения.
После окончания курса плазмафереза объем форсированного выдоха за первую секунду (ОФВ1) увеличивается в среднем на 10,8% по сравнению с исходным. Другие показатели ФВД коррелируют с ОФВ1.
Лучшие показатели можно ожидать у пациентов с изначально высоким уровнем ЦИК и иммуноглобулина Е (IgЕ). У этих больных положительная динамика симптомов заболевания отмечается после 1-2-го сеансов. Выраженность положительной клинической динамики находится в прямой зависимости от степени их исходного повышения.
Место лечебного плазмафереза в стандартной программе терапии БА
Плазмаферез характеризуется достаточной широтой терапевтического действия и может быть использован на фоне базисной терапии ИКС. В случае положительной динамики после плазмафереза возможна попытка уменьшить суточную дозу ИКС с расчетом на повышение чувствительности клеток-эффекторов к КС.
Самым надежным критерием в оценке плазмафереза является его клиническая эффективность. Именно клинический результат определяет целесообразность, ритм и объем процедур. Лабораторные показатели не имеют решающего значения и не обладают высокой специфичностью. Наиболее значимой в оценке эффекта терапии является динамика уровня ЦИК и IgЕ.
Таким образом, отдавая предпочтение традиционным методам лечения БА с использованием ИКС в качестве базисной терапии, следует отметить, что лечебный мембранный плазмаферез можно широко применять наряду с современны¬ми противовоспалительными и бронхолитическими препаратами. Основными показаниями к назначению плазмафереза являются нарастающая резистентность к базисной терапии ИКС, попытки уменьшить поддерживающую дозу КС, высокий уровень ЦИК и IgЕ, нежелание пациентов применять КС, противопоказания к назначению КС.
Выводы
- Лечебный мембранный плазмаферез — эффективный метод немедикаментозной терапии бронхиальной астмы, применяемый на фоне базисной противовоспалительной терапии улучшающий самочувствие в 83%.
- Курс состоит из 3-5 процедур проводимых через 2-3 дня.
- Прохождение курса плазмафереза не влияет на образ жизни: во время лечения можно продолжать ходить на работу, водить машину, заниматься спортом.
- Плазмаферез позволяет уменьшить резистентность к ИКС, повышает чувствительность ß2-адренорецепторов, усиливая бронхолитическое действие симпатомиметиков, тем самым позволяет сократить частоту ингаляций или вовсе отказаться от них.
- В перспективе, прохождение курсов плазмафереза позволяет сэкономить средства за счёт уменьшения требуемого количества ИКС.
—————
- Погибельный Александр Александрович, хирург, врач-трансфузиолог
- Запись на прием: 330003.org
- Телефон: 8 (3822) 90-30-30
- E-mail: paa@0370.ru
Плазмаферез используется в последние 40 лет. Лечебный плазмаферез это метод при котором проводится очищение крови, его можно рассматривать как аналог кровопускания, применяемого с древних времен. В отличие от кровопускания, при плазмаферезе удаляют только плазму, а клеточные элементы (эритроциты, тромбоциты и лейкоциты) возвращают пациенту. Плазмаферез также улучшает микроциркуляцию за счет снижения вязкости и свертываемости крови.
В мировой медицинской практике плазмаферез успешно применялся более чем при 60 различных заболеваниях. Пик увлечения плазмаферезом в мире наблюдался в 1980-1990-е годы. Накопленный исследователями опыт позволил дифференцировать показания для использования плазмафереза в клинической практике. В настоящее время метод плазмафереза включен в протоколы лечения некоторых заболеваний.
Для лечения больных бронхиальной астмой плазмаферез был впервые применен в 1978 г, когда еще окончательно не сформировались представления о механизмах развития бронхиальной астмы, не были созданы эффективные средства для ее базисной терапии, и был актуален поиск альтернативных методов лечения. Плазмаферез при БА нашел особенно широкое применение в странах бывшего СССР и продолжает использоваться в России и Украине. Развитию направления иммунокоррекции с использованием эфферентных методов в нашей стране способствовали работы Ю.М. Лопухина, А.Г. Чучалина, Н.А. Дидковского, Е.И. Шмелева, П.А. Воробьева.
Разработка Глобальной стратегии лечения и профилактики бронхиальной астмы и создание новых эффективных медикаментов привели к значительному прогрессу в лечении бронхиальной астмы. При этом ужесточились и требования к лечебным методам и препаратам, которые должны иметь подтвержденные с позиций доказательной медицины эффективность и безопасность. Прогресс в терапии бронхиальной астмы сократил потребность в дополнительных методах лечения. Еще одним препятствием для использования плазмафереза у пациентов с бронхиальной астмой стала сложность объективной оценки его эффективности с позиций доказательной медицины.
В результате многочисленных исследований был накоплен богатый методический опыт. Многие исследователи независимо друг от друга продемонстрировали эффективность и безопасность плазмафереза при бронхиальной астме у взрослых и детей.
Действие плазмафереза при бронхиальной астмы основано на удалении иммуноглобулинов класса Е, циркулирующих иммунных комплексов (ЦИК) и других субстанций, поддерживающих воспаление в бронхах; кроме того, плазмаферез приводит к уменьшению вязкости крови и агрегации эритроцитов. Однако до сих пор так и не сложилось окончательного мнения о механизмах влияния плазмафереза на организм больного бронхиальной астмой и показаниях к применению.
В большинстве доступных публикаций авторы применяли плазмаферез у пациентов со среднетяжелой или тяжелой стероидозависимой бронхиальной астмы, контроль которой не достигался с помощью традиционной фармакотерапии . В некоторых работах плазмаферез проводили у пациентов с бронхиальной астмой (в фазе обострения или вне обострения) с целью уменьшить объем медикаментозного лечения .
Эффективность плазмафереза при бронхиальной астмы оценивалась по динамике симптомов (удушья, кашля, отхождения мокроты, хрипов в легких), спирометрических показателей и потребности в ингаляциях, по влиянию на поддерживающую дозу системных глюкокортикостероидов (СГКС), сроки достижения и продолжительность ремиссии. Лабораторный мониторинг имел вспомогательное значение для подтверждения патогенетического действия плазмафереза (уровни в крови эозинофилов, ЦИК) и оптимизации режимов его проведения (содержание белка и электролитов в плазме крови, коагулограмма).
Методика плазмафереза у различных исследователей не была унифицирована. Плазмаферез проводили как дискретным, так и непрерывным методом с использованием центрифуг, гравитационных или фильтрационных фракционаторов крови. Единственным общим правилом было удаление относительно небольших объемов плазмы (порядка 1% массы тела) и замещение ее солевым раствором. Объем удалявшейся плазмы у взрослых пациентов варьировал от 200 до 1000 мл за одну процедуру. Это связано с тем, что из соображений безопасности для замещения плазмы не использовались потенциально аллергенные белковые препараты (как и цитратные антикоагулянты). Доза гепарина на 1 процедуру составляла от 5000 до 15 000 ЕД, интервалы между процедурами — 1-7 дней (от 2 до 6 процедур на курс лечения). Большинство авторов считает, что проведение 3-4 процедур плазмафереза оптимально для достижения эффекта.
Лечебный плазмаферез способен приводить к различным (в том числе тяжелым) осложнениям, которые могут быть обусловлены кровопотерей, массивным удалением белков плазмы, неадекватным ее замещением или реакциями на плазмозаменители. При разработке режимов плазмафереза при бронхиальной астме в различных исследовательских центрах требования безопасности были учтены в первую очередь, и ни в одной из публикаций мы не встретили сообщений о серьезных осложнениях плазмафереза у пациентов с бронхиальной астмой.
Необходимо отметить, что оценка эффективности плазмафереза, как правило, проводилась на небольших группах пациентов, численность которых не превышала нескольких десятков человек, без проведения рандомизации, а часто и без формирования групп сравнения. Плазмаферез обычно добавляли к лечению больных, которые были резистентны к фармакотерапии, и оценивали динамику течения заболевания.
Авторы большинства публикаций сообщали об уменьшении выраженности симптомов бронхиальной астмы после курса плазмафереза. Пациенты отмечали урежение приступов удушья, уменьшение их тяжести, а также интенсивности кашля и одышки, значительно облегчалось отхождение мокроты . Уменьшалась потребность в ингаляциях бронхорасширяющих средств, становилось возможным снизить дозу глюкокортикоидов.
Попытки объективизации действия плазмафереза, несмотря на их методическую сложность, все же предпринимались в нескольких сравнительных исследованиях. Бритов А.Н. и др. сравнивали эффект плазмафереза, проводившегося дискретным методом с использованием центрифугирования, с плацебо-процедурой у 15 больных бронхиальной астмой . Плацебо-процедура, при которой пациентам после центрифугирования возвращали цельную кровь, оказывала заметно меньшее влияние на выраженность симптомов бронхиальной астмы, чем плазмаферез. В сравнительном исследовании Татарского А.Р. и др. также было показано преимущество сочетания фармакотерапии с плазмаферезом у больных бронхиальной астмой. У 16 пациентов с тяжелой бронхиальной астмой после курса плазмафереза в сочетании с пульс-терапией метилпреднизолоном была достигнута ремиссия заболевания продолжительностью 6-8 мес, отмечалось стойкое снижение уровней ЦИК в крови. В группе из 6 пациентов, получавших только пульс-терапию метилпреднизолоном, длительность ремиссии была значительно меньшей.
По данным разных авторов, при резистентной к фармакотерапии бронхиальной астме длительность ремиссии, достигнутой после курса плазмафереза, колебалась от 1 до 12 мес, при этом объем базисной терапии удавалось значительно уменьшить . Сравнение эффектов гемосорбции и плазмафереза у больных с обострением бронхиальной астмы показало, что плазмаферез позволял быстрее добиться ремиссии, которая, однако, была менее продолжительной, чем при проведении гемосорбции .
Лишь в одном сообщении у 4 пациентов с тяжелой стероидозависимой бронхиальной астмой после курса плазмафереза в течение последующих 6 мес не было выявлено ни положительной, ни отрицательной динамики симптомов, потребности в ингаляциях бронхолитиков или дозы глюкокортикоидов.
Таким образом, даже при наличии современного арсенала эффективных препаратов для лечения бронхиальной астмы плазмаферез можно использовать в качестве дополнительного лечебного метода у тех пациентов, у которых базисной фармакотерапии недостаточно для достижения адекватного контроля заболевания.
Статью подготовил и отредактировал: врач-хирург Пигович И.Б.
Видео:
Полезно:
Наиболее распространенным и доступным методом воздействия на внутреннюю среду организма является плазмаферез. Для лечения бронхиальной астмы плазмаферез впервые использовал G. Gartman в 1978 году. Чаще эффект от проводимой терапии объясняют удалением из организма циркулирующих патологических компонентов крови. В то же время, по существующим данным литературы, не всегда удается найти корреляцию между клиренсом того или иного патологического агента и проявления клинического эффекта, что позволяет предположить наличие и других, еще не изученных механизмов. Однако экстракорпоральная элиминация патологических субстанций остается до настоящего времени наиболее надежным ориентиром как для определения объема терапевтического вмешательства, так и для решения вопросов дальнейшего совершенствования экстракорпоральных методов лечения.
Существует два основных метода плазмафереза - гравитационный и фильтрационный. Первый выполняется путем центрифугирования крови с постоянным или прерывистым ее потоком в специальных аппаратах.
Второй метод основан на фильтрации крови в специальные плазмофильтры. Наиболее физиологичным и доступным считается мембранный плазмаферез. Успех проведения плазмафереза связан с использованием плазмофильтров нового поколения ПФМ-01-ТТ «Роса». Основой этого Плазмофильтры является плоская пористая трековая лавсановая мембрана толщиной 10 мкм с порами диаметром около 0,4 мкм. Везде поры мембраны свободно проходят все жидкие компоненты крови, а форменные элементы задерживаются. Промышленное производство плазмафильтрив ПФМ — 01-ТТ «Роса» налажено компанией «ТРЕКПОР ТЕХНОЛОДЖИ», официальный дистрибьютор в Украине — ООО «Солар-Украина».
Полученная путем фильтрации плазма имеет достаточно высокое качество, соответствует требованиям службы крови, предъявляемые к донорской крови. Диаметр пор Плазмофильтры позволяет удалять такие высокомолекулярные соединения, как иммуноглобулины и циркулирующие иммунные комплексы (ЦИК).
Существуют четыре основных методики проведения мембранного плазмафереза: Двухигольные, с постоянным потоком крови через плазмофильтр, безапаратни, «шприцевые» методики для новорожденных и детей раннего возраста, одноигольные с использованием насосов крови.
Наиболее усовершенствованным является аппарат для мембранного плазмафереза АМПлд-ТТ «Гемофеникс» производства «ТРЕКПОР ТЕХНОЛОДЖИ». Основой аппарата является камерный насос желудочкового типа с впускным и выпускным клапанами, который в период «диастолы» насасывают кровь из вены, а в период «систолы» направляет ее в плазмофильтр с последующим возвращением в эту же вену.
1.Методика проведения мембранного плазмафереза у больных
бронхиальной астмой
Мембранный плазмаферез проводят с помощью аппарата АМПлд-ТТ «ГЕМОФЕНИКС» с применением Плазмофильтры ПФМ — 01-ТТ «РОСА».
Успешное проведение плазмафереза возможно в случае выполнения целого ряда требований, о наличии специального орудия, подготовленного медицинского и технического персонала, строгого соблюдения правил асептики и антисептики.
Перед началом плазмафереза врач проводит следующие исследования:
врачебный осмотр;
определение группы и резус-принадлежности крови, полный клинический анализ крови с подсчетом количества тромбоцитов и определением гематокрита;
определение общего белка крови;
определения времени свертывания крови, протромбинового индекса и фибриногена сыворотки крови.
Другие исследования могут проводиться в зависимости от конкретной ситуации и наличия сопутствующих заболеваний.
Для проведения плазмафереза выполняется Венопункция (чаще всего локтевой вены) с введением венозного катетера диаметром 1,4-2,0 мм. Следует обращать внимание на соответствие диаметра катетера калибра. Для профилактики тромбообразования в катетер вводят гепарин в дозе 150 ЕД / кг, что обеспечивает более надежный режим антикоагуляции в экстракорпоральном контуре в условиях меньшего расходования раствора цитрата натрия.
С целью предотвращения свертывания крови в системе требуется постоянное добавление к забираемая крови раствора Глюгицир (2,2% раствор натрия цитрата).
Каждая фаза забора крови составляет 10 мл и требует добавления 1,0 мл Глюгицир при системной гепарин (1,5 мл без гепарин). Количество антикоагулянта зависит от количества удаляемой плазмы и составит в среднем 150 — 200 мл.
При этом необходимо учитывать, что общая доза Глюгицир может изменяться в зависимости от состояния свертывающей системы крови. В процессе удаления плазмы происходит повышение вязкости крови вследствие увеличения объема клеточной массы. В этих условиях необходимо дополнительно создавать гемодилюцию крови раствором натрия хлорида, который использовался для первоначального заполнения экстракорпорального контура. В этот раствор целесообразно добавить 5000 ЕД гепарина, который компенсирует потерю с удаленной плазмой ранее введенного гепарина, обеспечивает более равномерный уровень системной гепарин во время всего периода плазмафереза.
В большинстве случаев за одну процедуру можно удалить 1/3 -1 / 2 объема циркулирующей плазмы (ОЦП), зависит от таких показателей как масса тела, гематокрит, альбумины крови. Удобной для подсчета является количество удаляемой плазмы, равной 1% от массы тела. В большом количестве случаев оптимальным является удаление 600-900 мл плазмы за одну процедуру. Удаление большего объема может доставить такие побочные явления, как слабость, снижение артериального давления, потерю белков плазмы. Эта так называемая «щадящая» методика не требует восстановления удаленной плазмы белковыми препаратами и не нарушает водно-солевой баланс.
Количество сеансов за один курс плазмафереза зависит от индивидуальных различий течения заболевания, лабораторных показателей и в большинстве случаев составляет 4-5 процедур с интервалом 2-3 суток. За один курс плазмафереза удаляется около 1-1,5 ОЦП или около 3 л плазме. При таком режиме удаления плазмы обычно не отмечается нарушений свертывающей системы крови, водно-электролитного баланса, белков, жиров, углеводов, гормонов и т.д. Восстановление удаленной плазмы проводится физиологическим раствором, образует благоприятные условия гемодилюции и улучшения микроциркуляции. Оптимальным считается введение физиологического раствора в количестве, на 200 мл превышает объем удаляемой плазмы.
4. Обоснование применения мембранного плазмафереза у больных бронхиальной астмой.
В патогенезе БА центральное место занимают разнообразные иммунопатологические реакции, вызывающие и поддерживающие бронхоспазм, воспаление слизистой оболочки бронхиального дерева, и определяют основные клинические проявления заболевания уже на ранней стадии БА, когда симптомы могут проявляться эпизодически.
По мере прогрессирования заболевания от ранней интермиттирующей к тяжелой персистирующей БА в патологический процесс вовлекаются клетки воспаления, их медиаторы, цитокины и другие разнообразные биологически активные вещества. Характер воспаления в бронхах, клеточный состав слизистой оболочки, характер и количество медиаторов воспаления (гистамина, триптазы, эйкозаноидов, лейкотриенов, провоспалительных интерлейкинов) определяют тяжесть течения БА. Таким образом, при более легких формах БА главное место в патогенезе отводится активированным эозинофильным и упитанным клеткам, при прогрессировании заболевания повышается роль Т-лимфоцитов, особенно Т2-хелперов.
Общепринятые лечебные мероприятия с применением противовоспалительных препаратов направлены на подавление активности клеток-эффекторов. Постоянный прием ИКС позволяет контролировать течение БА. Однако, в некоторых случаях с целью контроля основных клинических симптомов БА возникает необходимость в приеме субмаксимальных и максимальных доз ИКС или приходится переходить на прием пероральных кортикостероидов. Дестабилизация БА сопровождается также потерей чувствительности b2-адренорецепторов к симпатомиметиков. Ухудшение течения БА в большинстве случаев связано с накоплением циркулирующих иммунных комплексов, медиаторов воспаления, продуктов тканевой деградации. В этом случае проведение эфферентной терапии с помощью мембранного плазмафереза весьма эффективным патогенетическим методом лечения.
Использование плазмафереза в терапии основано частности на представлении о механическое удаление токсичных продуктов. Однако, по мере расширения терапевтических возможностей плазмафереза выяснилось, что клинический эффект не всегда можно объяснить механической теорией.
Наверное, не существует универсального механизма лечебного действия плазмафереза. В удаленной плазме находятся не только антитела и иммунные комплексы, патологическое воздействие которых доказано, но и продукты метаболизма различных клеток, компоненты разрушенных, старых и дефектных клеток, другие биологически активные вещества.
Удаление плазмы и отмывания клеток от плазмы ведет не только к высвобождению клеток от адсорбированных на их поверхности продуктов, но и изменяет жизнедеятельность клеток, повышает их функциональную активность, влияет на взаимодействие с другими клетками и регулирующими факторами. Итак, деплазмування может считаться одним из механизмов эффективности плазмафереза при различных патологических состояниях и особенно при БА.
Общеизвестно, что одним из важных патогенетических механизмов БА является дисбаланс адренергической системы, в основе которого лежит функциональная блокада b2-адренорецепторов, искаженное восприятие клетками-мишенями органов и тканей стимуляции катехоламинами.
Плазмаферез способствует восстановлению физико-химических свойств клеточных мембран, что является одним из механизмов снижения функциональной β2-адренорецепторов к симпатомиметиков и кортикостероидов. Таким образом, после проведенного плазмафереза восстанавливается активность ферментных систем, рецепторов, тесно функционально и морфологически с ней связанных, восстанавливается активность системы аденилатциклазы — цАМФ, с помощью которой осуществляются адренергические эффекты; отмечено также освобождение поверхностных рецепторов иммунокомпетентных клеток. В процессе проведения плазмафереза происходит удаление из крови различных веществ, блокирующих клеточные мембраны. К факторам эндогенного происхождения, которые блокируют мембраны, можно отнести: высокие концентрации медиаторов аллергических реакций, катехоламины, холестерин и продукты его перекисного окисления, перекиси ненасыщенных жирных кислот, кетоны, эпоксиды, продукты метаболизма кортизола. К продуктам экзогенного происхождения — значительные дозы симпатомиметиков, вводимые экзогенно, и их метаболиты, продукты метаболизма экзогенно введенных КС, антибактериальных и других лекарственных препаратов, ксенобиотиков другого происхождения.
Среди многообразия эффектов мембранного плазмафереза можно выделить прямые, связанные со способностью мембран извлекать из крови больных БА продукты экзо-и эндогенного происхождения, которые блокируют, и косвенные, обусловленные восстановлением в следующем периоде нормального функционирования различных биологических систем.
5. Показания и противопоказания для проведения мембранного плазмафереза у больных бронхиальной астмой
Мембранный плазмаферез может применяться при различных заболеваниях, связано в известной мере с его безопасностью и эффективностью.
При изучении лечебных возможностей плазмафереза у больных БА было установлено, что этот метод практически не имеет противопоказаний, или противопоказания имеют относительный характер, и могут быть устранены при подготовке к плазмафереза. К ним относятся активный воспалительный процесс, астматический статус, недостаточность кровообращения III стадии, тромбофлебиты, склонность к кровотечению.
Основными показаниями к проведению мембранного плазмафереза могут быть следующие:
нарастающая резистентность к базисной терапии ингаляционными кортикостероидами;
попытки уменьшить поддерживающую дозу ингаляционных или системных КС;
высокий уровень ЦИК и Ig E;
нежелание пациентов применять КС;
наличие противопоказаний к назначению КС.
6. Клиническая оценка эффективности мембранного плазмафереза у больных бронхиальной астмой
По мнению большинства исследователей, клиническая эффективность мембранного плазмафереза прежде должна оцениваться по динамике основных симптомов заболевания. Именно клинический результат определяет целесообразность, ритм и объем проводимых процедур. Лабораторные показатели, такие как белковый спектр крови, уровень электролитов, показатели свертывающей системы крови должны использоваться для оценки характера и объема плазмафереза и вероятности побочных реакций.
В процессе длительной медикаментозной терапии с использованием высоких доз b2-симпатомиметиков и ИКС наблюдается снижение чувствительности различных рецепторов бронхиального дерева, выражается в снижении бронходилятирующее действия симпатомиметиков, необходимости увеличения суточной дозы ИКС. С этих позиций крайне важным является восстановление и повышение чувствительности рецепторов бронхов к медикаментозных препаратов. В этих условиях положительные результаты были получены после проведения мембранного плазмафереза. Одним из важнейших клинических эффектов мембранного плазмафереза является повышение эффективности b2-симпатомиметиков.
| Показатели | До плазмафереза | После 1-ого сеанса | После 2-ого сеанса | После 3-ого сеанса | После 4-ого сеанса |
| ЖЄЛ | 3,37+0,37 | 3,42+0,36 | 3,4+0,42 | 3,47+0,31 | 3,52+0,29 |
| ФЖЄЛ | 2,64+0,26 | 2,36+0,31 | 2,55+0,27 | 2,89+0,25 | 3,01+0,32* |