Патогенез анемии при опухоли
Анемия при опухолях (онкологических заболеваниях) — причины, механизмы развитияАнемия нередко осложняет течение различных новообразований. До 40 % больных со злокачественными лимфомами и более половины больных с множественной миеломой уже к моменту постановки диагноза имеют выраженную анемизацию. У 1/4 больных с миеломой содержание гемоглобина не превышает 80 г/л, а количество больных с анемией среди больных с лимфомами по окончании лечения увеличивается до 70 %. Считается, что эта проблема менее значима при солидных опухолях. Тем не менее анализ данных донорских регистров США свидетельствует, что до 50— 60 % больных с опухолями гинекологической сферы, мочеполовых органов и легкого получали заместительные гемотрансфузии в период проведения химиотерапии. Более половины из 7000 больных с анемией, включенных в контролируемые популяционные исследования по применению эритропоэтина у больных с неоплазиями, имели солидные опухоли. В 2001 г. проведено проспективное изучение частоты анемии у больных с опухолевыми заболеваниями в Европе (ECAS). Содержание гемоглобина было сниженным у 31 % первичных больных, не получавших лечения, и у 42 % больных, которым проводили химио- или радиотерапию. Если у больных не было анемии на момент постановки диагноза, то в большинстве случаев (62 %) она развивалась в процессе лечения. Анемия возникала у 63 % больных, получавших химиотерапию (у 75 % после режимов, содержащих препараты платины, и у 54 % после прочих), у 42 % больных после сочетанного применения химио- и радиотерапии и у 20 % больных только после лучевого воздействия. Лишь 40 % больных с анемией, выявленной исходно или на протяжении лечения, получали заместительные гемотрансфузии или эритропоэтин.
Патогенез анемий при опухоляхПри опухолевых заболеваниях патогенез анемии многообразен. Основные причины — кровотечение, дефицит витаминов и железа, аутоиммунный гемолиз, метастазирование в костный мозг, токсичность цитостатиков и др. Анемия нередко развивается у больных, не имеющих для этого видимых причин. Такая «не спровоцированная» анемия может определяться гиперпродукцией провоспалительных цитокинов (ИЛ-1, ФНО и ИФН-у) при опухолевых заболеваниях. Повышение концентрации этих соединений обычно наблюдается при заболеваниях, сопровождающихся хроническим воспалением, например при ревматоидном артрите, и также сопровождается анемизацией. Возникающая при этом анемия называется анемией опухолевого или хронического заболевания. Отрицательное влияние анемии на качество жизниПри исследовании качества жизни больных с опухолевыми заболеваниями слабость выделена как одна из наиболее распространенных жалоб. В частности, слабость осложняет проведение химиотерапии у 76 % больных, тошнота — у 54 % и боль у 24 % больных. В генезе слабости могут играть роль такие факторы, как нарушение нейромышечной проводимости, повышение уровня метаболизма белков, снижение питания и аффективные расстройства (депрессия). В то же время при многовариантном статистическом анализе одним из самых значимых независимых прогностических факторов слабости была анемия. Современные данные свидетельствуют о появлении слабости, снижающей показатели качества жизни, при содержании гемоглобина менее 120 г/л. В контролируемых исследованиях по лечению анемии максимальное снижение слабости и прирост показателей качества жизни наблюдались при повышении содержания гемоглобина до 120 г/л. Слабость, снижение физической и социальной активности часто недооцениваются врачами, которые не склонны считать эти проблемы важными по сравнению с болью, рвотой или инфекцией. В современных работах по выявлению значимости основных жалоб больных с опухолевыми заболеваниями слабость и социальная дезадаптация занимают лидирующее место. В одном из исследований на вопрос, что следует лечить в первую очередь: слабость или боль, большинство больных выбрали слабость. На тот же самый вопрос 95 % врачей ответили противоположным образом. Снижение эффективности противоопухолевого лечения при анемииАнемия и как следствие тканевая гипоксия могут сказаться на эффективности лекарственного и лучевого противоопухолевого лечения. Противоопухолевый эффект радиации связан с образованием свободных радикалов, которые взаимодействуют с основаниями ДНК в присутствии молекулярного кислорода, что останавливает клеточную пролиферацию и вызывает гибель клеток. Недостаток кислорода замедляет этот процесс. В клетке, находящейся в состоянии гипоксии, свободные радикалы не фиксируются к ДНК и мембранам и, таким образом, смерть клетки может не наступить. Впервые снижение эффекта облучения при гипоксии описал врач из Вены Готвальд Шварц в 1909 г.. Он обратил внимание на то, что при наложении на кожу радиоактивной пластины лучевая реакция непосредственно под ней значительно снижена. Исследователь объяснил свое наблюдение тем, что сдавление сосудов под тяжестью радиоаппликатора вызывает анемизацию подлежащей области и снижает эффект облучения. В последующем эта гипотеза была подтверждена в эксперименте с облучением культур бактерий, находящихся в гипоксическом состоянии, и в клинических наблюдениях. Так, в исследовании D. М. Brizel непосредственная эффективность радиотерапии и долговременная выживаемость больных с опухолями головы и шеи были в 2 раза ниже при напряжении кислорода в опухоли менее 10 мм рт. ст.. Было отмечено, что гипоксическое состояние опухоли коррелировало с содержанием гемоглобина в крови. В других исследованиях показано, что ткани опухоли находятся в более гипоксическом состоянии, чем окружающие нормальные ткани. Обычно гипоксия опухоли возникает в тот момент, когда ее рост превышает способность локальной микрососудистой сети доставлять достаточное количество кислорода к опухолевым клеткам. Оксигенация опухоли в основном определяется объемом кровотока, степенью развитости микроциркуляции и содержанием гемоглобина; таким образом, снижение количества гемоглобина крови может ухудшить оксигенацию опухоли. Изучали влияние собственно анемии на чувствительность опухоли к радиотерапии. В одном из ретроспективных исследований прослежена долговременная выживаемость 889 больных с чешуйчато-клеточным раком головы и шеи, получавших радиотерапию. Пятилетняя выживаемость мужчин с содержанием гемоглобина более 130 г/л и женщин более 120 г/л составила 58,2 %, что контрастировало с уровнем этого показателя (28,4 %) для больных, у которых содержание гемоглобина оказалось ниже. На модели фибросаркомы у мышей на опухолевые клетки, находящиеся в состоянии гипо- и нормоксии, воздействовали различными цитотоксичными препаратами. Оказалось, что клетки, находящиеся в состоянии гипоксии, были в 2—6 раз более резистентными к таким цитостатикам, как циклофосфамид, кармустин (BCNU), карбоплатин и мелфалан, чем опухолевые клетки, находящиеся в состоянии нормальной оксигенации. Клиническая значимость этих наблюдений неясна, однако данные, полученные в последние годы у больных раком шейки матки, подтверждают концепцию о способности гипоксии индуцировать селекцию клеток, резистентных к апоптозу, и то, что данный механизм определяет злокачественную прогрессию опухоли. — Также рекомендуем «Лечение анемии при опухолях (онкологических заболеваниях) — эффективность эритропоэтина» Далее рекомендуем для ознакомления следующие статьи:
|
Г.Н. ГОРОХОВСКАЯ, профессор кафедры госпитальной терапии №1 ГОУ ВПО МГМСУ, доктор медицинских наук; Н.Н. ШАРКУНОВ, клинический ординатор ГКБ №40 Департамента здравоохранения города Москвы
В медицинской литературе не нашел применения термин «раковая анемия». Чаще всего анемию рассматривают как один из симптомов заболевания или как осложнение лечения без выделения в самостоятельную нозологическую единицу. Подобная механистическая интерпретация снижения концентрации гемоглобина в крови ведет к недопониманию глубоких дальнейших последствий для физического, социального и психологического состояния онкологического больного. Насколько специфична анемия при онкологическом заболевании, каковы ее последствия и степень влияния на эффективность проводимого лечения? Это лишь часть вопросов, на которые важно иметь ответы.
Характерная особенность — многофакторность патогенеза
Анемия — синдром, патологическое состояние организма, развившееся в результате заболевания и нередко углубляющееся в процессе химиотерапии. При этом регистрируется снижение уровня Hb крови ниже физиологической нормы (
Противоопухолевое лечение также влияет на количество эритроцитов в крови. Основными патогенетическими факторами, снижающими уровень гемоглобина, являются миелосупрессия и блокирование выработки эритропоэтина, продуцируемого интерстициальными клетками коркового слоя почек.
Таким образом, анемия злокачественного заболевания (АЗН) может быть определена как сложный симптомокомплекс, синдром, патологическое состояние, развивающееся при злокачественном процессе вследствие болезни и лекарственного лечения. Снижение уровня гемоглобина ниже физиологической нормы влияет на качество жизни пациента, прогноз жизни и течения заболевания и, вероятно, на эффективность специфического лечения.
Характерной особенностью АЗН является многофакторность патогенеза. Отчетливо выделяются следующие механизмы: угнетение эритропоэза, сокращение продолжительности жизни эритроцитов, нарушение обмена железа.
АЗН относится к гипорегенераторным анемиям с относительно уменьшенным числом ретикулоцитов, не соответствующим степени анемии. Имеются различия между анемиями различных типов АЗН по их тяжести, процентам микро- и макроцитарных форм. В большинстве случаев, однако, АЗН — это гипорегенераторная анемия с низким числом ретикулоцитов (ретикулоцитопения), с величинами гемоглобина между 80 г/л и 100 г/л. Средний объем эритроцита и концентрация клеточного гемоглобина в пределах нормы.
Большинство проявлений — из-за анемической гипоксии
Патофизиология хронической анемии при ЗН включает интенсивное взаимодействие между популяцией опухолевых клеток и иммунной системой, что приводит к активации макрофагов и повышенной экспрессии различных цитокинов. Все характерные патофизиологические черты АЗН (уменьшение периода жизни эритроцитов, уменьшенная реутилизация железа костным мозгом, неадекватная продукция эритропоэтина /ЭПО/ и супрессия эритроидных предшественников) являются результатом активации иммунной и воспалительной систем злокачественными клетками.
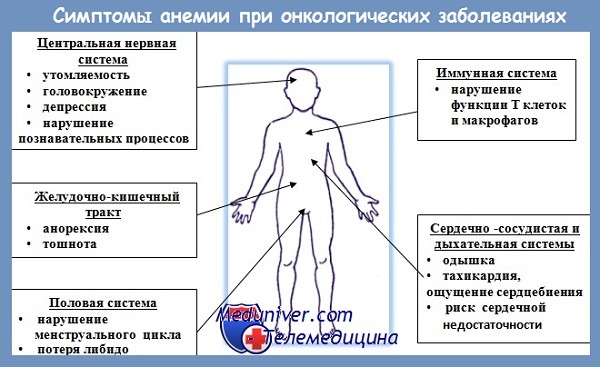
Как правило, пациенты с анемией отмечают проявления, обусловленные развитием анемической гипоксии. При легких формах это может быть слабость, быстрая утомляемость, общее недомогание, а также снижение концентрации внимания. Люди с более выраженной анемией могут жаловаться на одышку при незначительной или умеренной нагрузке, сердцебиение, головную боль, шум в ушах, могут также встречаться нарушения сна, аппетита, снижение либидо. При тяжелой анемии или при наличии сопутствующей патологии возможно развитие сердечной недостаточности.
Часто встречаемым диагностически важным симптомом умеренной или выраженной анемии является бледность (кожных покровов, видимых слизистых и ногтевых лож). Также ценное значение имеют такие симптомы, как усиление сердечного толчка и сердечных тонов, появление функциональных систолических шумов при аускультации сердца.
Кроме общих симптомов, непосредственно связанных с развитием гипоксии, при анемии могут быть и другие проявления в зависимости от этиологии и патогенеза. Например, развитие неврологической симптоматики при сопутствующем дефиците витамина B12, желтуха — при гемолитическом компоненте.
Дефициту железа при АЗН свойственны так называемые сидеропенические симптомы: выраженные изменения кожи, ногтей, волос, которые не встречаются при других видах анемий, мышечная слабость, не соответствующая глубине анемии, извращения вкуса (патофагия) и запаха (патоосмия). У больных часто наблюдаются сухость и трещины кожи на руках и ногах, ангулярный стоматит.
Полный клинический анализ крови необходим
Следует обратить внимание на необходимость при первичном исследовании проводить полный клинический анализ крови, включающий определение количества гемоглобина, подсчет числа эритроцитов и ретикулоцитов, цветового показателя и показателя гематокрита, а также количества лейкоцитов, тромбоцитов, лейкоцитарной формулы и СОЭ. Существующая в поликлинике практика исследования только трех показателей (гемоглобин, лейкоциты, СОЭ) не только не информативна, но и вредна, так как может привести к ошибочным заключениям. Фрагментарные исследования крови допустимы только при динамическом наблюдении за результатами терапии.
При установлении характера и причин развития анемий важен синдромный подход, включающий оценку числа лейкоцитов, тромбоцитов, лейкоцитарной формулы и величины СОЭ. При обнаружении, например, признаков, типичных для миело- и лимфопролиферативных заболеваний, как острых, так и хронических, трактовка генеза анемии не представит особых трудностей. Если при анемии имеются преходящая лейкемоидная реакция типа нейтрофильного лейкоцитоза и тромбоцитоза, это может помочь в диагностике острой постгеморрагической анемии, а выявление наряду с анемией лейкопении и тромбоцитопении сразу вызывает обоснованное подозрение на аплазию кроветворения или В12-дефицитную анемию. Столь же велико и диагностическое значение величины СОЭ при анемиях.
С помощью определения цветового показателя и разделения анемий на гипо-, нормо- и гиперхромные возможно ограничить круг диагностических поисков. Так, при обнаружении гипохромных анемий следует предполагать хроническую железодефицитную анемию, или сидеробластную, а при обнаружении гиперхромных анемий ожидаются В12- или фолиево-дефицитные анемии и т.д. Необходимо, однако, отметить, что при современном инструментальном подсчете числа эритроцитов возможны ошибки в определении цветового показателя, дезориентирующие врача: и железодефицитные, и В12-дефицитные анемии нередко оказываются нормохромными.
В этой связи большое значение приобретает изучение врачом-лаборантом морфологии эритроцитов и ее описание в анализе крови. По факту обнаружения гипохромии и микроцитоза эритроцитов может быть диагностирован дефицит железа, а по обнаружению макроцитоза, мегалоцитоза, гиперхромии эритроцитов, колец Кебота, базофильной пунктуации — дефицит витамина В12.
Основное лечение донорскими эритроцитами
Основой лечения выраженных анемий при хронических заболеваниях остается заместительная терапия донорскими эритроцитами. Следует подчеркнуть крайне негативное отношение к гемотрансфузиям при анемии хронических заболеваний: каждая гемотрансфузия требует отдельного обоснования — резкое снижение уровня гемоглобина, нарастание гипоксии, сосудистые реакции и т.д. Нельзя шаблонно назначать переливания эритроцитов «в плановом порядке». Кроме опасности вирусного инфицирования, повторные гемотрансфузии сопровождаются гемосидерозом, угнетают, по принципу обратной связи, собственный эритропоэз.
В некоторой степени гемотрансфузиям противопоставляется терапия рекомбинантным эритропоэтином (рч-ЭПО). Во всяком случае, если встает вопрос о гемотрансфузиях при этом виде анемий, необходимо обсуждать и терапию эритропоэтином. Впервые эритропоэтин был выделен и воспроизведен в 1977 г. М.I. Yake. Применение его рекомбинантной формы в качестве средства терапии анемии при хронической почечной недостаточности было разрешено лишь в 1987 г., хотя начало экспериментального применения в клинике относится к 1985 году (J.W. Eschabach). С 1990 г. эритропоэтин применяется для лечения ВИЧ-инфицированных больных, а с 1993 г. — для терапии анемии у больных с онкологической патологией.
Это пример патогенетического лечения, восполняющего дефицит эндогенного гематогормона. На рынке лекарств уже несколько лет доступны эпрекс, неорекормон, эритро-стим. Активно исследуется новый стимулятор эритропоэза — дарбопоэтин.
Показанием для ЭПО-терапии пациента с АЗН следует считать уровень гемоглобина меньше 100 г/л, и почти всегда требуется лечение рч-ЭПО, если уровень гемоглобина меньше 80 г/л. Вначале нужно дифференцировать другие возможные причины анемии. В ситуации, когда число ретикулоцитов повышено, следует иметь в виду гемолитический процесс или острую кровопотерю как возможные причины. Если число ретикулоцитов неадекватно степени анемии (т.е. меньше, чем 3—5%), нужно иметь в виду алиментарную недостаточность (железо, витамин В12 или фолаты).
Если симптомы анемии выражены и мы заключили, что анемия является следствием низкой продукции эритроцитов и обусловлена или самой болезнью, или миелосупрессивной терапией, или обеими причинами, то должна быть предписана соответствующая терапия. В этой связи мы должны обсудить «про» и «контра» ЭПО-терапии.
Трансфузия обеспечивает более быстрый паллиатив симптомов анемии, но с некоторыми неудобствами для пациента и определенным риском острой или хронической реакции или переноса инфекции. С другой стороны, ЭПО-терапия свободна от факторов риска, удобна для пациента, который сам может сделать себе дома инъекцию, хотя эффект более медленный по сравнению с гемотрансфузией.
Заблуждение, весьма распространенное
К сожалению, большинство врачей привыкли считать неизбежным развитие легкой или умеренной анемии у онкологических больных. Считается, что снижение уровня Hb до 10 г/дл и даже до 8 г/дл не приносит значимого вреда пациенту.
Насколько ошибочна подобная точка зрения, показали исследования взаимосвязи качества жизни и анемии, при этом своевременная и адекватная коррекция анемии значимо улучшала благополучие пациентов. Показано достоверное влияние коррекции анемии на эффективность химиотерапии, в том числе и в сочетании с лучевым лечением. Результаты проспективных и ретроспективных исследований, проведенных за последнее десятилетие, убедительно свидетельствуют, что проблема анемии, ее значение для больного явно недооценены. Внедрение в клиническую практику ряда новых цитостатиков, активное использование агрессивных режимов лечения, включая одновременную химио- и лучевую терапию (например, при локализованном мелкоклеточном раке легкого), использование высоких доз интерферонов и интерлейкинов позволяет повысить эффективность лечения злокачественного заболевания. Но интенсификация лечения ухудшает качество жизни пациентов и требует активной поддерживающей терапии, одной из составляющих которой является своевременная коррекция анемии с применением современных препаратов — стимуляторов эритропоэза.