Наследственная анемия мкб 10
- D55 Анемия вследствие ферментных нарушений.
- Исключена: фермент дефицитная анемия, вызванная лекарственными средствами (059.2)
- D55.0 Анемия вследствие недостаточности глюкозо-6-фосфатдегидрогеназы [Г-6-ФД], Фавизм, Г-6-ФД-дефицитная анемия
- D55.1Анемия вследствие других нарушений глутатионового обмена. Анемия вследствие недостаточности ферментов (за исключением Г-б-ФД), связанных с гексозомонофосфатным [ГМФ] шунтом метаболического пути. Гемолитическая несфероцитарная анемия (наследственная) типа I.
- D55.2Анемия вследствие нарушений гликолитических ферментов. Анемия: гемолитическая несфероцитарная (наследственная) типа II, вследствие недостаточности гексокиназы, вследствие недостаточности пируваткиназы, вследствие недостаточности триозофосфатизомеразы
- D55.3 Анемия вследствие нарушений метаболизма нуклеотидов
- D55.8 Другие анемии вследствие ферментных нарушений
- D55.9 Анемия вследствие ферментного нарушения неуточнённая
- D56 Талассемия
- D56.0 Альфа-талассемия.
- Исключена: водянка плода, обусловленная гемолитической болезнью (Р56.-)
- D56.1 Бета-талассемия Анемия Кули. Тяжёлая бета-талассемия. Серповидно-клеточная бета-талассемия. Талассемия: промежуточная, большая
- D56.2 Дельта-бета-талассемия
- D56.3 Носительство признака талассемии
- D56.4 Наследственное персистирование фетального гемоглобина [НПФГ]
- D56.8 Другие талассемии
- D56.9 Талассемия неуточнённая. Средиземноморская анемия (с другой гемоглобинопатией). Талассемия (малая) (смешанная) (с другой гемоглобинопатией)
- D57 Серповидно-клеточные нарушения.
- Исключены: другие гемоглобинопатии (D58.-) серповидно-клеточная бета-талассемия (D56.1)
- D57.0 Серповидно-клеточная анемия с кризом, Hb-SS болезнь с кризом
- D57.1 Серповидно-клеточная анемия без криза. Серповидно-клеточная(ое): анемия, болезнь, нарушение.
- D57.2 Двойные гетерозиготные серповидно-клеточные нарушения. Болезнь. Hb-SC. Hb-SD. Hb-SE.
- D57.3 Носительство признака серповидноклеточности. Носительство гемоглобина S[Hb-S]. Гетерозиготный гемоглобин S
- D57.8 Другие серповидно-клеточные нарушения
- D58 Другие наследственные гемолитические анемии
- D58.0 Наследственный сфероцитоз. Ахолурическая (семейная) желтуха. Врожденная (сфероцитарная) гемолитическая желтуха. Синдром Минковского — Шоффара
- D58.1 Наследственный эллиптоцитоз. Эллиптоцитоз (врожденный). Овалоцитоз (врожденный) (наследственный)
- D58.2 Другие гемоглобинопатии. Аномальный гемоглобин БДУ. Врожденная анемия с тельцами Гейнца — Болезнь: НЬ-С, НЬ-D, НЬ-Е. Гемоглобинопатия БДУ. Гемолитическая болезнь, обусловленная неустойчивым гемоглобином.
- Исключены: семейная полицитемия (D75.0), болезнь НЬ-М (D74.0), наследственное персистирование фетального гемоглобина (D56.4), полицитемия, связанная с высотой (D75.1), метгемоглобинемия (D74.-)
- D58.8 Другие уточнённые наследственные гемолитические анемии. Стоматоцитоз
- D58.9 Наследственная гемолитическая анемия, неуточнённая
- D59 Приобретённая гемолитическая анемия
- D59.0 Медикаментозная аутоиммунная гемолитическая анемия
- D59.1 Другие аутоиммунные гемолитические анемии. Аутоиммунная гемолитическая болезнь (холодовый тип) (тепловой тип). Хроническая болезнь, вызываемая холодовыми гемагглютининами. «Холодовая агглютининовая»: болезнь, гемоглобинурия. Гемолтическая анемия: холодовой тип (вторичная) (симптоматическая), тепловой тип (вторичная) (симптоматическая). Исключены: синдром Эванса (D69.3), гемолитическая болезнь плода и новорождённого (Р55.-), пароксизмальная холодовая гемоглобинурия (D59.6)
- D59.2 Медикаментозная неаутоиммунная гемолитическая анемия. Медикаментозная фермент дефицитная анемия
- D59.3 Гемолитико-уремический синдром
- D59.4 Другие неаутоиммунные гемолитические анемии. Гемолитическая анемия: механическая, микроангиопатическая, токсическая
- D59.5 Пароксизмальная ночная гемоглобинурия (Маркиафавы — Микели).
- Исключена: гемоглобинурия БДУ (R82.3)
- D59.6 Гемоглобинурия вследствие гемолиза, вызванного другими внешними причинами. Гемоглобинурия: от нагрузки, маршевая, пароксизмальная холодовая.
- Исключена: гемоглобинурия БДУ (R82.3)
- D59.8 Другие приобретённые гемолитические анемии
- D59.9 Приобретённая гемолитическая анемия неуточнённая. Идиопатическая гемолитическая анемия хроническая.
Рубрика МКБ-10: D58.0
МКБ-10 / D50-D89 КЛАСС III Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм / D55-D59 Гемолитические анемии / D58 Другие наследственные гемолитические анемии
Определение и общие сведения[править]
Микросфероцитарная гемолитическая анемия (синонимы: врожденный микросфероцитоз, болезнь Минковского-Шоффара, микроцитемия, сфероцитарная анемия) как самостоятельная болезнь стала известна после классических работ О. Минковского (1900) и Шоффара (Chauffard А.М., 1907).
Наследственный микросфероцитоз — это группа наследственных гемолитических анемий, характеризующихся появлением шаровидных эритроцитов (микросфероцитов) и обусловленных дефектом белков цитоскелета эритроцитов. В результате теряется часть мембраны эритроцита, уменьшается отношение площади поверхности к объему, и эритроцит превращается в микросфероцит.
Эпидемиология
В большинстве случаев заболевание наследуется аутосомно-доминантно (75% случаев). Распространенность его составляет 1 на 1000-4500. У 20% больных нарушения со стороны крови отсутствуют, что указывает либо на аутосомно-рецессивное наследование, либо на спонтанную мутацию (наблюдается сравнительно редко). Выраженность гемолиза и соответственно тяжесть заболевания весьма вариабельны. Чем более выражены проявления болезни, тем раньше ставится диагноз. Как правило, наследственный микросфероцитоз диагностируют в детстве, легкие формы с субклиническим течением — в зрелом возрасте, а иногда болезнь проявляется вскоре после рождения.
Этиология и патогенез[править]
Наследственный сфероцитоз вызван мутациями в одном из следующих генов: SPTA1 (1q21), SPTB (14q23.3), ANK1 (8p11.21), SLC4A1 (17q21.31) и EPB42 (15q15-q21), которые кодируют клеточные мембранные белки эритроцитов: спектрин 1 альфа-цепь, спектрин 1 бета-цепь, анкирин-1, транспортный белок полосы 3 и белок мембраны эритроцитов полосы 4.2, соответственно. Дефекты в этих белках приводят к потере сцепления мембраны эритроцитов и снижению площади поверхности мембраны, что приводит к образованию сферического слоя эритроцитов, снижению деформируемости и преждевременному разрушению в селезенке.
Спектрин — белок цитоскелета эритроцита; мутации его гена нарушают либо синтез цепей спектрина, либо самосборку его гетеродимеров. Спектрин представляет собой длинную фибриллярную молекулу длиной 200-260 нм и толщиной 2-3 нм. Его масса в клетке составляет около 30% массы мембранных белков. Молекула спектрина состоит из двух неидентичных субъединиц — альфа (240 000 Да) и бета (225 000 Да). Альфа- и бета-субъединицы ассоциируются в подвижные гетеродимеры. У каждого второго больного выявлены мутации гена анкирина — белка, соединяющего трансмембранный белок полосы 3 со спектрином. Недостаточность анкирина наследуется аутосомно-рецессивно или аутосомно-доминантно; аутосомно-рецессивное наследование встречается реже, но анемия при нем тяжелее. У четверти больных обнаружены мутации белка полосы 3. Это транспортный трансмембранный белок, его молекулярная масса около 100 000 Да. Белок носит название полосы 3, поскольку при электрофорезе в полиакриламидном геле он занимает соответствующее положение относительно других белков. Белок полосы 3 принимает участие в переносе кислорода из легких к тканям и углекислого газа из тканей к легким. Делеция гена белка полосы 3 делает мембрану эритроцита ригидной и защищает эритроциты от внедрения малярийных плазмодиев. Недостаточность этого белка наследуется аутосомно-доминантно и приводит к легкой анемии.
У большинства из оставшейся четверти больных выявлены мутации гена спектрина, нарушающие либо синтез цепей спектрина, либо самосборку его гетеродимеров. Недостаточность α -цепи спектрина наследуется аутосомно-доминантно и обычно протекает легко. Недостаточность β-цепи спектрина — тяжелое заболевание с аутосомно-рецессивным типом наследования. Видимо, неоднородность генетических нарушений обусловливает разнообразие в течении наследственного микросфероцитоза. Дефекты белков цитоскелета приводят к тому, что мембрана эритроцитов утрачивает стабильность и ее участки отщепляются. Эритроцит превращается в микросфероцит, неспособный к деформации. Микросфероциты не могут пройти через красную пульпу селезенки, в особенности протиснуться через щели в стенках ее синусов. Оказавшись в условиях гипоксии, в которых невозможно поддерживать метаболизм, микросфероциты теряют еще часть мембраны. В результате в крови появляется субпопуляция совершенно круглых эритроцитов.
Клинические проявления[править]
Основные проявления наследственного микросфероцитоза — анемия, желтуха, спленомегалия. Анемия обусловлена внутриклеточным распадом эритроцитов. Желтуха обусловлена непрямой гипербилирубинемией, бывает непостоянной и, как правило, слабее выражена в раннем детском возрасте. Из-за высокого содержания билирубина в желчи часто образуются пигментные желчные камни, в том числе и у детей. Спленомегалия наблюдается почти всегда. Во время системных инфекций интенсивность гемолиза может увеличиваться, что приводит к дальнейшему увеличению селезенки. При тяжелых формах наследственного микросфероцитоза у больных отмечаются деформации скелета: башенный череп, микрофтальмия, высокое верхнее нёбо, изменяется расположение зубов. У некоторых больных бывают укорочены мизинцы. Иногда возникают трофические язвы ног.
Выделяют четыре формы наследственного сфероцитоза: легкая (нормальный гемоглобин (Hb), ретикулоциты <3%, билирубин <17 мкмоль/л), мягкая (Hb 11-15 г/дл, ретикулоциты 3-6%, билирубин 17-34 мкмоль/л ), умеренная (Hb 8-12 г/дл, ретикулоциты> 6%, билирубин> 34 мкмоль/л) и тяжелая (Hb <8 г/дл, ретикулоциты> 10%, билирубин> 51 мкмоль/л).
Наследственный сфероцитоз: Диагностика[править]
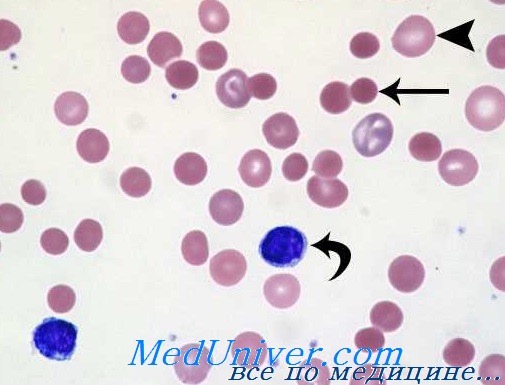
1. Лабораторные данные и инструментальные исследования, необходимые для диагностики наследственной микросфероцитарной анемии: общий анализ крови — нормохромная анемия различной степени выраженности, появление микросфероцитов (эритроцитов уменьшенного диаметра шарообразной формы без просветления в центре) и ретикулоцитов в большом количестве. Анемия резко усиливается после активного гемолиза. Могут наблюдаться гемолитические кризы. Вне криза анемия умеренная, а при легком течении заболевания может отсутствовать. Микросфероциты характеризуются уменьшением диаметра (средний диаметр 4-6 мкм), увеличением их толщины и шарообразной формой. Чем тяжелее форма заболевания, тем большее количество микросфероцитов определяется в периферической крови. Количество лейкоцитов и тромбоцитов обычно нормальное. В период гемолитического криза наблюдаются лейкоцитоз и выраженный сдвиг лейкоцитарной формулы влево. СОЭ увеличивается только в периоде обострения заболевания, особенно во время гемолитического криза. Общий анализ мочи — определяется уробилинурия, а во время гемолитического криза — альбуминурия, микрогематурия. Биохимический анализ крови — повышено содержание билирубина преимущественно за счет неконъюгированного (непрямого) билирубина, во время гемолитического криза возможно повышение активности АЛТ ЛДГ, повышение содержания железа.
2. Осмотическая стойкость эритроцитов — отмечается снижение максимальной и минимальной осмотической стойкости эритроцитов. В норме минимальная стойкость составляет 0,44-0,48%, максимальная — 0,36-0,40% раствора натрия хлорида. При наследственной микросфероцитарной анемии гемолиз начинается при более высокой концентрации натрия хлорида: минимальная осмотическая резистентность понижена: 0,6-0,7%, а максимальная осмотическая резистентность повышена: 0,25-0,3%.
3. Миелограмма — в стернальном пунктате определяются характерные признаки гиперплазии красного кроветворного ростка — увеличение количества эритрокариоцитов. Гранулоцитарный и мегакариоцитарный ростки не изменены.
Отмечается значительное сокращение продолжительности жизни эритроцитов (по данным теста с радиоактивным хромом). В анализе кала возможно высокое содержание стеркобилина.
4. При УЗИ органов брюшной полости определяются увеличение селезенки, камни в желчном пузыре. При длительно существующем микросфероцитозе и частых обострениях возможно увеличение печени (вследствие нарушения оттока и застоя желчи).
Дифференциальный диагноз[править]
Дифференциальный диагноз включает наследственный эллиптоцитоз, наследственный стоматоцитоз, Южноазиатский овалоцитоз, дефицит глюкозо-6-фосфатдегидрогеназы, дефицит пируваткиназы, аутоиммунную гемолитическую анемию и альфа-талассемию.
Наследственный сфероцитоз: Лечение[править]
Лечение включает в себя купирование желтухи (фототерапия и обменное переливанием крови для предотвращения гипербилирубинемической энцефалопатии) и переливание эритромассы в случае тяжелой симптоматической анемии. Спленэктомия обычно приводит к исчезновению анемии и четкому улучшению гемолитических маркеров. Спленэктомия не показана пациентам с легкой формой, если нет жизненных показаний и ее желательно отсрочить до достижения возраста 6 лет. Лапароскопическая спленэктомия. Комбинированная спленэктомия и холецистэктомия могут быть полезны у пациентов с желчными камнями. Для предотвращения инфекций рекомендуется вакцинопрофилактика и назначение антибиотиков. Добавление фолатов рекомендуется, особенно после инфекционных осложнений. Уровни ферритина в сыворотке следует проверять ежегодно.
Прогноз
Прогноз варьируется и зависит от тяжести заболевания и сопутствующих осложнений.
Профилактика[править]
Прочее[править]
Источники (ссылки)[править]
Гематология [Электронный ресурс] : национальное руководство / под ред. О.А. Рукавицына — М. : ГЭОТАР-Медиа, 2015. — https://www.rosmedlib.ru/book/ISBN9785970433270.html
https://www.orpha.net
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
Рубрика МКБ-10: D64.0
МКБ-10 / D50-D89 КЛАСС III Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм / D60-D64 Апластические и другие анемии / D64 Другие анемии
Определение и общие сведения[править]
Сидеробластные анемии
Сидеробластные анемии представляют собой группу редких гетерогенных наследственных или приобретенных нарушений костного мозга, которые могут быть изолированными или быть частью некоторых синдромов. Сидеробластные анемии характеризуются снижением синтеза гемоглобина из-за нарушения утилизации железа (уровни плазмтического железа могут быть нормальными или повышенными), наличием ринг-форм (кольцевидных) сидеробластов в костном мозге из-за патологической перегрузки железом митохондрий, которые визуализируются окрашиванием Перлса.
Группа включает приобретенные (идиопатические) сидеробластные анемии и конституциональные сидеробластные анемии. Последние включают в себя синдромальные сидеробластные анемии, такие как синдром Пирсона, митохондриальную миопатию с сидеробластной анемией, Х-сцепленную сидеробластную анемию с атаксией, тиаминовый мегалобластный анемический синдром и несиндромальные сидеробластные анемии: Х-сцепленную и аутосомно-рецессивную сидеробластные анемии.
Cиндром Пирсона
Cиндром Пирсона характеризуется наличием рефрактерной сидеробластной анемии, вакуолизации стволовых клеток костного мозга и патологии экзокринной функции поджелудочной железы.
Всего было описано порядка 60 случаев синдром Пирсона у мальчиков и девочек. Гематологические симптомы манифестируют в детском возрасте, хотя описано и несколько случаев у новорожденных.
Этиология и патогенез[править]
Хотя наследование от матери было описано для синдрома Пирсона, заболевание, как правило, носит спорадический характер. В целом синдром Пирсона — это митохондриальная цитопатия, обусловленная делециями митохондриальной ДНК, что является важным диагностическим признаком патологии. Данные делеции приводят к нарушениям митохондриальной функции дыхательной цепи. Случайное распределение митохондриальной ДНК при делении клеток приводит к присутствию в одной клетке как нормальной, так и мутировавшей ДНК. Это сосуществование, названное гетероплазмией, объясняет высокую изменчивость в клинической экспрессии как между разными пациентами, так и между различными органами пораженного субъекта. Патологические проявления возникают, когда некоторый критический уровень мутантной ДНК накапливается в конкретной ткани.
Клинические проявления[править]
Клинические проявления синдрома Пирсона включают макроцитарную сидеробластную анемию, иногда сопровождаемую тяжелой нейтропенией или тромбоцитопенией.
Вакуоли в клетках-предшественниках гранулоцитов и эритробластах, обнаруживаемые на миелограмме, также характерны для данного синдрома. Окраска по Перлзу обнаруживает наличие кольцевидных сидеробластов.
Кроме того проявляется фиброзная экзокринная дисфункция поджелудочной железы с симптомами мальабсорбции и поносом и нарушениями окислительного фосфорилирования, приводящим к лактатемии и увеличением соотношения лактат/пируват. Другие органы также могут быть затронуты, либо одновременно, либо по ходу течения заболевания: часто это почечная тубулопатия с аминоацидурией, гепатомегалия, сиптомы цитолиза и холестаза, эндокринные нарушения, нервно-мышечные расстройства, а в некоторых случаях поражения сердца и атрофия селезенки.
Наследственная сидеробластная анемия: Диагностика[править]
Дифференциальный диагноз[править]
Наследственная сидеробластная анемия: Лечение[править]
Не существует специфического лечения синдрома Пирсона. Терапия является симптоматической и включает в себя лечение инфекций и метаболических нарушений, переливание крови в случае развития тяжелой анемии (иногда совместно с назначением эритропоэтина), назначение ферментов полжелудочной железы и коррекция эндокринных нарушений.
Прогноз
Смерть часто происходит в возрасте до трех лет в результате сепсиса, метаболический криза с лактоацидозом или гепатоцеллюлярной недостаточности. Пациенты, которые выживают в младенческом возрасте, как правило, подвергаются фенотипической эволюции: гематологические проявления исчезают сами по себе, в то время появляются, либо прогрессируют неврологические расстройства и миопатия. У некоторых пациентов развивается типичный синдром Кернс-Сейра с офтальмоплегией, атаксией, пигментным ретинитом, дефектами проводимости и миопатией.
Профилактика[править]
Прочее[править]
Аутосомно-рецессивная сидеробластная анемия со взрослым началом
Синонимы: GLRX5-связанная сидеробластная анемия
Аутосомно-рецессивная сидеробластная анемия со взрослым началом — очень редкая несиндромальная аутосомно-рецессивная пиридоксин-рефрактерная сидеробластная анемия в результате дефекта сплайсирования глутаредоксина-5 (GLRX5). GLRX5-связанная сидеробластная анемия описана у одного взрослого пациента с микроцитарной гипохромной анемией, перегрузкой печени железом и диабетом 2 типа .
Источники (ссылки):[править]
https://www.orpha.net