Морфология костного мозга при анемии
Отмечается
эритропения, снижение содержания
гемоглобина до 30-40 г/л, анизоцитоз,
пойкилоцитоз, гипохромия, снижение
ретикулоцитарного индекса, лейкопения
за счет снижения количества нейтрофилов.
Патогномоничный признак железодефицита
в костном мозге – резкое снижение
местных запасов железа (снижается
количество сидеробластов – клеток,
содержащих гранулы железа). Отмечается
умеренная гиперплазия эритроидного
ростка. Гемоглобинизация клеток эритрона
нарушена: увеличено количество базофильных
и полихроматофильных форм, снижено
количество оксифильных. По мере истощения
запасов железа ферритин и гемосидерин
исчезают и из костного мозга, и из других
мест хранения.
Особую роль в диагностике играют
биохимические показатели:
Уровень
ферритина сыворотки снижен – менее 12
нг/мл.Железо
сыворотки снижено.Увеличена
общая железосвязывающая способность.Увеличена
ненасыщенная, латентная железосвязывающая
способность.Резко
снижено насыщение трансферрина.
Анемии, связанные с дефицитом витамина в12(мегалобластические).
Витамин
В12
содержится в мясе, яйцах, сыре, молоке,
почках, печени. Витамин В12
в продуктах связан с белком, от которого
он освобождается в процессе кулинарной
обработки и под воздействием
протеолитических ферментов ЖКТ, после
чего он связывается в желудке с внутренним
фактором Кастла. Внутренний фактор –
это гликопротеид, который образуется
в фундальной части и в области тела
желудка париетальными клетками. Комплекс
«витамин В12 –
фактор Кастла» связывается со
специфическими рецепторами клеток
подвздошной кишки. Витамин В12
всасывается медленно, за сутки может
всосаться не более 6-9 мкг. Незначительная
часть витамина В12
может всосаться без фактора Кастла.
Витамин
В12
в плазме связывается с транскобаламинами.
Известно три транскобаламина – I,
II,
III.
Основное количество витамина переносится
транскобаламином II. Этот белок
синтезируется в печени.
Содержание
витамина В12
в организме здорового человека составляет
2-5 мг, депо находится в печени. Запасы
витамина В12
настолько велики, что их хватает на 3-6
лет.
Все
клетки организма имеют рецепторы для
комплекса «транскобаламин II
– витамин В12».
У
человека выявлены две метаболически
активные формы витамина В12:
1.
Метилкобаламин. Эта активная форма
обеспечивает нормальное эритробластическое
кроветворение и нормально протекающие
метотические процессы в других клетках
организма. В ходе реакции с метилкобаламином
из уридинмонофосфата образуется
тимидинмонофосфат, который включается
в ДНК. Необходимым условием для течения
этой реакции является участие активной
коферментной формы фолиевой кислоты –
5, 10 – метилен-тетрагидрофолиевой
кислоты.
Метилкобаламин
участвует в метилировании гомоцистеина
в метионин.
2.
5-дезоксиаденозилкобаламин. Этот
метаболит необходим для нормального
обмена жирных кислот. Так при распаде
некоторых жирных кислот образуется
пропионовая кислота. Распад пропионовой
кислоты обеспечивается рядом ферментативных
реакций, в ходе которых синтезируются
производные янтарной кислоты, входящие
в цикл Кребса. Одним из промежуточных
продуктов является метилмалоновая
кислота. Метилмалоновая кислота
образуется также при распаде валина и
метионина. 5-дезоксиаденозилкобаламин
участвует в образовании янтарной кислоты
из метилмалоновой. Предполагается
участие аденозилкобаламина в биосинтезе
миелина. При дефиците витамина В12
накапливается избыток пропионовой и
метилмалоновой кислот. Они переходят
в жирные кислоты с физиологическим
нечетным числом атомов углерода в
молекуле. Включаясь в липиды нейронов,
они нарушают процессы миелинизации и
вызывают жировую дистрофию клеток.
Соседние файлы в папке ЛЕКЦИИ
- #
- #
- #
- #
- #
- #
Источник
—
группа заболеваний и состояний,
характеризующихся уменьшением общего
количества гемоглобина. Уменьшение
содержания в единице объема крови.
При
анемии в периферической крови нередко
появляются эритроциты различной величины
(пойкилоцитоз), формы (анизоцитоз), разной
степени окраски (гипохромия, гиперхромия);
в эритроцитах иногда обнаруживаются
включения — базофильные зерна (так
называемые тельца Жолли), базофильные
кольца (так называемые кольца Кабо) и
т. Д.
На
основании пунктата грудины можно судить
о состоянии (гипер или гипорегенерация)
и типе эритропоэза (эритробластический,
нормобластический и мегалобластический).
Этиология
и патогенез.
Причинами развития анемии могут быть
кровопотеря, недостаточная эритропоэтическая
функция костного мозга( зависит от
дефицита необходимых для нормального
кроветворения веществ- железа, витамина
б12, фолиевой ксилоты), повышенное
кроворазрушение.
Классификация.
В зависимости от этиологии и главным
образом патогенеза различают три
основные группы анемий:
вследствие
кровопотери (постгеморрагические
анемии);
вследствие
нарушенного кровообразования;
вследствие
повышенного кроворазрушения (гемолитические
анемии).
В
каждой группе выделяются формы анемии.
По характеру течения анемии делят на
острые и хронические. В соответствии с
морфологическим и функциональным
состоянием костного мозга, отражающим
его регенераторные возможности, анемия
может быть регенераторной, гипорегенераторной,
гипопластической(гипорегенраторной),
апластической(арегенераторной),
диспластической.
51. Постгеморрагические анемии. Причины, морфологическая характеристика.
Анемии
вследствие кровопотери могут иметь
острое или хроническое течение.
Острая
постгеморрагическая анемия
наблюдается после массивных кровотечений
из сосудов желудка при язвенной болезни,
из язвы тонкой кишки при брюшном тифе,
при разрыве маточной трубы в случае
внематочной беременности, разъедании
ветви легочной артерии при туберкулезе
легких, разрыве аневризмы аорты или
ранении ее стенки и отходящих от аорты
крупных ветвей.
Чем
крупнее калибр пораженного сосуда и
чем ближе к сердцу он расположен, тем
опаснее для жизни кровотечение. При
кровотечениях из сосудов мелкого калибра
смерть обычно наступает при потере
более половины общего количества крови.
В таких случаях постгеморрагической
анемии отмечается бледность кожных
покровов и внутренних органов; посмертные
гипостазы выражены слабо.
Патологическая
анатомия.
Если кровотечение оказалось не
смертельным, то кровопотеря возмещается
благодаря регенераторным процессам в
костном мозге. Клетки костного мозга
плоских и эпифизов трубчатых костей
усиленно пролиферируют, костный мозг
становится сочным и ярким. Жировой
(желтый) костный мозг трубчатых костей
также становится красным, богатым
клетками эритропоэтического и миелоидного
ряда. Появляются очаги внекостномозгового
кроветворения в селезенке, лимфатических
узлах, тимусе и тд.
Хроническая
постгеморрагическая анемия
развивается в тех случаях, когда
происходит медленная, но длительная
потеря крови. Это наблюдается при
небольших кровотечениях из распадающейся
опухоли желудочно-кишечного тракта,
кровоточащей язвы желудка, геморроидальных
вен кишечника, из полости матки, при
геморрагическом синдроме, гемофилии.
Патологическая
анатомия.
Кожные покровы и внутренние органы
бледны. Костный мозг плоских костей
обычного вида; в костном мозге трубчатых
костей наблюдаются выраженные в той
или иной степени явления регенерации
и превращения жирового костного мозга
в красный. Нередко отмечаются множественные
очаги внекостномозгового кроветворения.
В связи с хронической кровопотерей
возникает гипоксия тканей и органов,
которая обуславливает развитие жировой
дистрофии миокарда, печени, почек.
Появляются множественные точечные
кровоизлияния в серозных и слизистых
оболочках, во внутренних органах.
52.
Анемии
вследствие нарушения кровообразования.
Классификация, причины, механизмы
развития, морфологическая характеристика.
Представлены
дефицитными анемиями, возникающими при
недостатке железа, витамина В12, фолиевой
кислоты, гипо- и апластическими анемиями.
1)Анемии
вследствие недостатка железа или
железодефицитные анемии.
Они могут развиваться прежде всего при
недостаточном поступлении железа с
пищей (алиментарная железодефицитная
анемия детского возраста). Они возникают
также при экзогенной недостаточности
железа в связи с повышенными запросами
организма у беременных и кормящих
женщин, при инфекционных заболеваниях.
Также вследствие резорбционной
недостаточности при заболлеваниях ЖКТ
и после резекции желудка или кишечника.
Анемии вследствие недостатка железа —
гипохромные.
2)Анемия
вследствие недостатка витамина B 12 и/или
фолиевой кислоты.
Их характеризует извращение эритропоэза.
Это мегалобластические гиперхромные
анемии. Витамин B 12 и фолиевая кислота
являются необходимыми факторами
гемопоэза.

3)Для
эндогенных гипо- и апластических
анемий наиболее характерно поражение
эритробластического ростка крови
(эритрона) с потерей способности костного
мозга к регенерации. Происходит гибель
активного костного мозга плоских и
трубчатых костей, он замещается желтым,
жировым. Среди
эндогенных фаткоров- наследственные с
развитием семейной апластической анемии
(фанкони) и гипопластической анемии
(эрлиха). В
качестве экзогенных факторов, ведущих
к развитию гипопластических и апластических
анемий, могут выступать радиация,
токсические вещества,некоторые
лек.препараты. При экзогенных полнгого
подавления гемопоэза не происходит,
отмечается угнетение регенераторной
способности костного мозга. Также такие
анемии возникают при замещении костного
мозга лейкозными клетками, метастазами
злокачественной опухоли, рака или
костной тканью.
53.Железодефицитные
анемии .Причины.Морфологические
проявления.
Вызванна
недостатком железа в организме.
Гипохромная анемия.
Причины:
1)Повторные
или длительные кровотечения
2)алиментарная
недостаточность железа(при кормлении
искусств молоком)
3)повышен расход
железа период роста,беременности,при
нарушении всасывания,приинфекциях,нарушениедепонрирования
железа(при гепатите,циррозе)
Следствие:
-атрофические и дистрофические процессы
в тканях и в органах,особенно в пищевом
канале(глоссит,гингивит,кариес зубов)
и в сердце.
-исчезновение гемосидерина
в макрофагоцитах печени и селезенки,снижение
кол-ва сидеробластов и сидероцитов в
костном мозге. Это приводит к уменьшению
транспорта железа в костный
мозг.
-продолжительность жизни
эритроцитов уменьшается.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
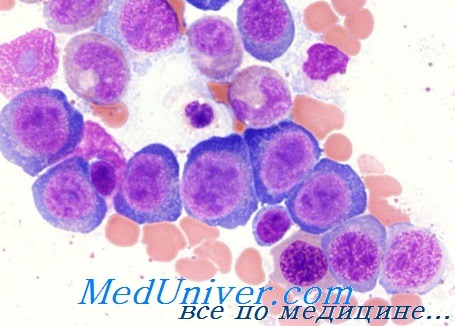
Мегалобастическая анемия — морфология, причиныМегалобластическая анемия — это патологическое состояние, заключающееся в общем клеточном расстройстве, в основе которого лежит нарушение клеточного деления за счет заниженного синтеза нуклеиновых кислот, что, в большинстве случаев, является результатом недостаточности витамина В12 или фолиевой кислоты. В гематологическом плане это заболевание характеризуется мегалобластическим преобразованием и неэффективностью миелопоэза. Мегалобластическая анемия коренным образом отличается от гипохромной анемии, при которой нарушение касается клеточного созревания (за счет неполноценности синтезирования гемоглобина), равно как и от апластической анемии, при которой нарушается дифференциация «клеток-штамм» в кровяные клетки. Мегалобластоз — патофизиологические рамки, морфологияОсновным нарушением, обусловливающим мегалобластическую морфологию является недостаточное синтезирование ДНК (биохимическими механизмами, описанными далее). Результаты этого дефицита следующие: а) Увеличивается межмитотическая фаза, во время которой продолжается синтез РНК и белков. Это объясняет утрату количественного равновесия между ДНК и РНК, что, в морфологическом плане проявляется изменением отношения ядро-цитоплазма в пользу последней. б) Кровяные клетки не подвергаются нормальному числу делений (в основном это касается последних трех делений эритробластического ряда) (Weicker, Rohr), при этом ядро остается большим и выглядит как «молодое », в то время как в цитоплазме развивается характеристика зрелой клетки (асинхронизм созревания ядра и цитоплазмы). в) Отмеченное мегалобластическое расстройство обусловливает усиленное внутрикостномозговое разрушение этих клеток, пропорционально степени дефицита (неэффективность кроветворения, отражающаяся в высоком уровне лактикодегидрогеназы и билирубина, и ростом «ранней фракции» последней). Показатель разрушения находящихся в кровообращении элементов также высок, а средняя продолжительность жизни эритроцитов равняется 1/2—1/3 нормы. г) Последствием неполноценного кроветворения является анемия, которая (под стимулирующим влиянием эритропоэтина) способствует развитию эритробластической гиперплазии (при изменении отношения Э:Г, росте клеточной костаномозговой массы и гематопоэтической преобразовании жирного костного мозга), что усиливает дефицит фолиевой кислоты или витамина В12 (за счет увеличенного расхода) и замыкает порочный круг усугублением мегалобластоза и анемии.
В основе количественных и качественных изменений остальных двух костномозговых рядов находятся те же нарушения, которые поражают и эритробластный ряд. Неэффективный грапулоцитопоэз поддерживается не только морфологическими альтерационными изменениями, но также повышением уровня мурамидазы в сыворотке (Perillie). Неэффективность мегакариопоэза, отмечаемая при мегалобластной анемии, которую подсказывал контраст между ростом общей массы мегакариоцитов костного мозга и периферической тромбоцитопзнией, была подтверждена работами Harker и Finch, установивших среднюю выработку, на ядерную единицу, шести тромбоцитов вместо сорока (норма). Рост разрушения гранулоцитов и тромбоцитов на периферии — возможно путем увеличенной секвестрации селезенкой — может способствовать, в различной степени, развивающейся при этом цитопении. Подобные клеточные альтерационные изменения наблюдаются и в других клеточных системах, в основном у тех, характерной чертой которых составляет коэффициент быстрого деления, в том числе эпителий пищеварительного тракта (в отдельных случаях и клетки зародыша, плодных придатков). В этом следует искать объяснение некоторых клинических признаков или осложнений (глоссит, затруднения пищеварения, расстройство поглощения, перинатальные осложнения и пр.). Общим диагностическим элементом мегалобластных анемий является определение мегалобластной морфологии всех кровяных клеток костного мозга и периферической крови. Термином мегалобласт определяются предшественники эритроцитов. В принципе мегалобласт крупнее соответствующего нормального эритробласта с измененным отношением ядро-цитоплазма в пользу последней. Ядро промегалобласта (диаметром 20—30 u) объемистое, нередко расположено эксцентрично, хроматинная структура в виде жемчужин, содержит несколько крупных ядрышек синеватой окраски; цитоплазма синего цвета, наиболее ясная зона расположена вокруг ядра, причем может сохраниться и на последующих стадиях. На стадии базофильного мегалобласта ядро уменьшается, отсутствуют ядрышка, хроматинная структура более плотная, однако не наблюдаются характерные для базофильного нормобласта скопления, базофильность цитоплазмы станитовся более резкой. На стадии полихроматофильного мегалобласта отражен наиболее ярко асинхронизм созревания между ядром (еще крупным, с едва начинающим организоваться в виде блоков хроматинном) и цитоплазмой (растянутой, полихроматофильной, нередко с наличием телец Жолли). Диаметр оксифильного мегалобласта колеблется от 10 до 18 u, его цитоплазма полностью оксифильная и хроматинная структура ядра еще выявима. Мегалоцит характеризуется более крупными размерами (от 12 до 14 u), отсутствием ясной центральной зоны (большей толщиной) и часто чуть овальной формой. Происходящие в гранулоцитном ряде мегалобластические изменения отражаются в увеличенном, в принципе, размере клетки и обильности цитоплазмы. Эти признаки проявляются более четко в гигантских метамиелоцитах, имеющих крупное ядро, весьма скудную хроматинную структуру, не соответствующей форме ядра, при этом цитоплазма продолжает оставаться базофильной. Наблюдается тенденция к гиперсегментированию в результате чего образуется форма гиперсегментированных гранулоцитов (6, 8, 10 и более сегментов), хроматинная структура которых, однако, менее плотная (в отдельных случаях сегментирование частичное, в виде надреза). Изменения мегакариоцитов менее четкие, в некоторых случаях их размеры отклоняются от нормы, зернистость недостаточная. Хроматинная структура менее плотная, естественная тенденция к сегментированию ядра усиливается, появляются отделившиеся сегменты или сегменты в виде «виноградной грозди» или «взрывных» мегакариоцитов. Тромбоциты крупнее (макро- или даже мегатромбоциты) с лучше выраженной структурой, чем нормальная. Что касается этиопатогенеза мегалобластической анемии отмечаем, что значительные достижения последних двух десятилетий в изучении этого заболевания привели к выделению следующих трех основных категорий, из них первые две включают случаи, обусловливаемые недостатком витамина В12 и фолиевой кислоты (с возможным их сочетанием при определенных обстоятельствах), а третья — более редкие случаи этого заболевания, независимые от первых двух недостатков, вызываемые известными или еще неизвестными причинами. — Также рекомендуем «Обмен витамина В12 в норме и его источники. Значение цианокобаламина» Оглавление темы «Анемии»:
|
Источник