Микроангиопатическая анемия у детей
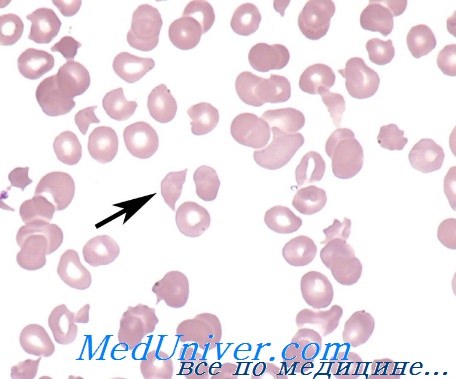
Микроангиопатическая гемолитическая анемия — история изучения, причиныМикроангиопатическая гемолитическая анемия (МГА) относится к группе приобретенных гемолитических анемий по внеэритоцитным причинам, точнее — к подгруппе механических гемолитических анемий. Микроангиопатическая гемолитическая анемия представляет собой частную форму гемолитической анемии, характеризующуся наличием раздробленных эритроцитов («шлемообразные », треугольные, зубчатые, микросфероциты) на мазках крови и признаками внутрисосудистого расплавления крови. Часто тромбоцитопения и расстройство свертывания (Brain) сопровождают микроангиопатическую гемолитическую анемию. Подобно иным видам анемии, микроангиопатическая гемолитическая анемия не составляет самостоятельную единицу, а лишь синдром, развивающийся при ином заболевании или синдроме. Болезни, при которых была описана микроангиопатическая гемолитическая анемия носят общий характер — патологическое изменение небольших сосудов, артериол и капилляров (микроаигиопатия). В 1891 г. Ehrlich впервые отметил наличие раздробленных эритроцитов («шистоциты») на мазке страдающего анемией. В 1949 Schwartz и Motto описали присутствие 0,1—0,5% «надрезанных» («burr cells») эритроцитов в мазках крови больных уремией, раком желудка и пептической геморрагической язвой. В 1954 г. Monroe и Strauss сообщили о выявлении раздробленных эритроцитов на срезах отдельных кровеносных сосудов больного, погибшего от тромботической тромбогемолитической пурпуры. Они выдвинули гипотезу, по которой раздробление эритроцитов якобы происходит в ненормальных кровеносных сосудах. В 1962 Brain, Dacie и Hourihane впервые использовали термин «микроангионатическая гемолитическая анемия». В период с 1962 по 1972 гг. Brain и Dacie, в сотрудничестве с другими исследователями, поставили эксперимент микроангиопатической гемолитической анемии на животных, изучили механизм дробления эритроцитов в пробирке, описали процесс внутрисосудистого свертывания у страдающих микроангиопатической гемолитической анемией, реакцию на лечение гепарином и сочетание микроангиопатической гемолитической анемии с метастатическим раком. Понятие микроангиопатической гемолитической анемии общепринято и подтверждено другими авторами. С 1961 г. в литературе был опубликован ряд сообщений о гемолитической анемии, в условиях которой, после хирургического вмешательства на сердце по поводу клапанопластики, протезирования синтетическими клапанами и исправления внутрисердечных дефектов. Гемолитическая анемия с дроблением эритроцитов описана у больных, страдающих тяжелой недостаточностью клапанов (в частности сужение аорты) и коарктацией аорты.
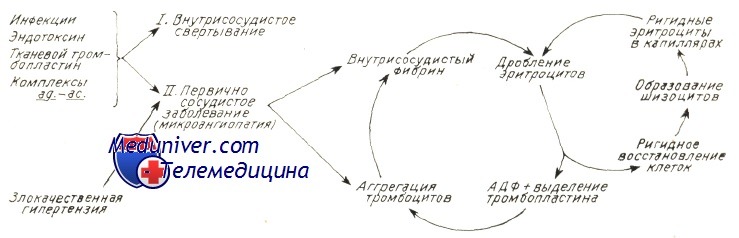
Причины (этиология) микроангиопатической гемолитической анемииМикроангиопатическая гемолитическая анемия описана в сочетании с рядом иных заболеваний. Наличие процесса расплавления крови с последующим дроблением эритроцитов предполагает следующие патогенетические механизмы: В патологии человека микроангиопатическая гемолитическая анемия описана в сочетании с сосудистыми заболеваниями, обусловленными обоими механизмами. В случае первичного сосудистого нарушения или вызванного процессом внутрисосудистого свертывания тромбы фибрина и тромбоциты частично закупоривают просвет мелких сосудов. Волоски фибрина действуют на движущиеся эритроциты подобно «гильотине » и тем самым обусловливают их дробление. Те фрагменты эритроцитов, у которых поверхностная оболочка меньше соответствующего объема, быстро захватываются макрофагами селезенки. Другие же, у которых отношение площадь/ объем превышает норму (за счет перехода гемоглобина в плазму или в результате дробления) подвергаются процессу рубцевания («повторному запечатыванию») оболочки и остаются в кровообращении, представляя собой «ключ» к постановке диагноза основного заболевания. В результате этого процесса рубцевания оболочки появляются жесткие эритроциты — сфероциты, «шлемообразные» эритроциты, которые подвергаются повторному дроблению при переходе через капилляры. Дробление эритроцитов сопровождается выделением АДФ и фосфолипидного прокоагулянта, что снова ведет к аггрегации тромбоцитов и отложению фибрина в мелких сосудах, тем самым усиливая процесс внутрисосудистого свертывания. На рисунке приводится модель патогенеза микроангиопатической гемолитической анемии. Необходимо отметить, что не у всех больных с рассеянным внутрисосудистым свертыванием наблюдается микроангиопатическая гемолитическая анемия. Для ее развития важно, чтобы фибрин удержался в кровообращении достаточный период времени. Сохранение запасов фибрина в мелких сосудах зависит от ритма дефибринизации, клиренса макрофаговой системы и местного фибринолиза.
Болезни, сопутствующие микроангиопатической гемолитической анемии (МГА)1. Тромбогемолитическая тромботическая пурпура (РТТ) 2. Уремический гемолитический синдром При микроангиопатической гемолитической анемии, встречающейся в заболеваниях метастазом рака, эритроциты разрушаются механическим путем в малых сосудах, измененных: — Также рекомендуем «Диагностика микроангиопатической гемолитической анемии — дифференциация» Оглавление темы «Гемолитические анемии»:
|
Источник
Термин «микроангиопатическая
гемолитическая анемия» (МАГА), предложенный
Симмерсом в 1952 году, используется для
обозначения гемолитического синдрома,
в основе которого лежит фрагментация
эритроцитов во время их циркуляции по
измененным мелким сосудам.
Наиболее часто МАГА наблюдается
иммунокомпетентной патологии и синдроме
диссеминированного внутрисосудистого
свертывания (ДВС), обусловливающих
развитие:
гемолитико-уремического синдрома;
тромботической тромбоцитопенической
пурпуры;синдрома острой дефибринации при
преждевременной отслойке плаценты,
эмболии околоплодными водами и других
заболеваниях.
Этиология и патогенез.
Поражение мелких сосудов (в основном
артериол) при иммунокомплексной патологии
и ДВС состоит в нарушении целостности
сосудистого эндотелия и внутрисосудистом
отложении фибрина. Эритроциты, проходя
через небольшие отверстия между нитями
фибрина или контактируя с отростками
клеток поврежденного эндотелия,
травмируются, в результате чего они
распадаются на отдельные фрагменты
(шистоциты) или теряют часть оболочки,
принимая форму микросфероцитов.
Интенсивность фрагментации эритроцитов
зависит от распространенности
микроангиопатии и скорости тока
эритроцитов через пораженные сосуды.
Последняя во многом определяется
величиной артериального давления,
которое при многих заболеваниях,
сопровождающихся иммунокомплексной
патологией и синдромом ДВС, оказывается
повышенным.
Клиника.
Течение МАГА во многом зависит от
основного заболевания.
При гемолитико-уремическом синдроме,
наблюдающемся в основном у детей после
инфекционных заболеваний и вакцинаций,
симптомы гемолитической анемии (слабость,
повышенная утомляемость, бледность и
желтушность кожных покровов) сочетаются
с признаками быстро нарастающей почечной
недостаточности (отсутствие аппетита,
рвота, боли в поясничной области, олигурия
и анурия).
При тромботической тромбоцитопенической
пурпуре, которая чаще встречается в
возрасте 30-40 лет и характеризуется более
распространенными сосудистыми
поражениями, в клинической картине
преобладает геморрагический синдром,
являющийся следствием глубокой
тромбоцитопении, и неврологические
нарушения: потеря сознания, делирий,
афазия, атаксия и др.
При острой дефибринации, развивающейся
при сепсисе, преждевременной отслойке
плаценты, эмболии околоплодными водами
и некоторой другой акушерской патологии,
в клинике доминируют профузные
кровотечения, обусловленные полной
потерей способности крови к свертыванию.
Поскольку гемолиз при МАГА, сопровождающей
эти состояния происходит в основном
внутрисосудистого, селезенка и печень,
как правило, не увеличены.
Лабораторные данные.
Выраженность анемии при МАГА зависит
от распространенности сосудистых
поражений. При просмотре мазка крови
обращает на себя внимание присутствие
большого количества фрагментов
эритроцитов (шистоцитоз). Отмечается
также микросфероцитоз, наличие
нормобластов, полихромазия и умеренный
ретикулоцитоз. Число лейкоцитов увеличено
за счет нейтрофилов. В большинстве
случаев наблюдается тромбоцитопения
вследствие потребления кровяных
пластинок в процессе ДВС.
Наиболее выраженная тромбоцитопения
наблюдается при тромботической
тромбоцитопенической пурпуре и острой
дефибринации.
Проба Кумбса отрицательная, продолжительность
жизни эритроцитов укорочена.
В костном мозге – эритроидная гиперплазия
и некоторое увеличение числа мегакариоцитов
за счет молодых форм.
Увеличение уровня свободного гемоглобина
сыворотки, низкая концентрация
гаптоглобина и умеренная гипербилирубинемия
свидетельствуют о внутрисосудистом
характере гемолиза.
При развитии почечной недостаточности
в плазме повышается содержание остаточного
азота, азота, мочевины и креатинина. При
острой дефибринации наблюдается
удлинение протромбинового и тромбинового
времени, снижение концентрации факторов
V,VIII,
фибриногена и повышение содержания
продуктов деградации фибрина (ПДФ).
При хроническом ДВС, который наблюдается
при гемолитико-уремическом синдроме и
тромботической тромбоцитопенической
пурпуре, концентрация в крови свертывающих
факторов, включая фибриноген, может
быть нормальной или даже повышенной.
Однако, содержание ПДФ, как правило,
увеличено, а уровень антитромбина IIIснижен.
Диагностика.
В диагностике МАГА ведущее значение
имеет обнаружение шистоцитоза в мазках
крови и признаков ДВС: прогрессирующей
тромбоцитопении, фибриногенопении,
повышенного содержания ПДФ, наличия
активированных факторов X,XIIи снижения уровня
антитромбинаIII.
Лечение.
Лечение МАГА включает:
Терапию основного заболевания, вызвавшего
развитие ДВС,Терапию ДВС с помощью гепарина в дозе
25-30 ед/кг/ч, переливаний плазмы (источник
антитромбина III), альбумина,
реополиглюкина и введения
антифибринолитических препаратов
(контрикал, трасилол и др.),Обменные переливания крови и плазмаферез,
При значительной анемизации –
заместительные гемотрансфузии.
Прогноз.
Прогноз при МАГА целиком зависит от
основного заболевания. Так, если при
гемолитико-уремическом синдроме погибают
5% больных, то при тромботической
тромбоцитопенической пурпуре смертность
в первые три месяца достигает 80%, а менее
10% больных живут более одного года.
ПРИЛОЖЕНИЕ I.
Нормальные гематологические показатели
здорового человека.
Показатель | Пол | Пределы нормальных | Единицы измерения |
Гемоглобин (Hb) | Мужчины | 133-177 | г/л |
Женщины | 117-157 | ||
Эритроциты (RBC) | Мужчины | 4,6-6,5 | х1012/л |
Женщины | 3,8-5,8 | ||
Гематокрит (HCT) | Мужчины | 0,4-0,54 | % |
Женщины | 0,37-0,49 | ||
Средний объем | 80-100 | фл* | |
Среднее содержание | 27-32 | пг* | |
Средняя концентрация | 310-370 | г/л | |
Ретикулоциты | 2-10 | ‰ | |
Лейкоциты (WBC) | 4,0-8,0 | х109/л | |
| 1-6 | % | |
0,04-0,3 | х109/л | ||
| 45-70 | % | |
2,0-5,5 | х109/л | ||
| 20-45 | % | |
1,5-4,0 | х109/л | ||
| 2-9 | % | |
0,08-0,60 | х109/л | ||
| 1-6 | % | |
0,04-0,4 | х109/л | ||
| <1 | % | |
<0,1 | х109/л | ||
Тромбоциты (PLT) | 150-400 | х109/л | |
Сывороточное железо | мужчины | 9-28 | ммоль/л |
женщины | 7-26 | ||
Общая железосвязывающая | 45-70 | мкмоль/л | |
Ферритин сыворотки | мужчины | ||
женщины | |||
Шиллинг-тест | >10% дозы, выделенной | ||
Фолаты сыворотки | 2,5-20,0 | мкг/л | |
Фолаты эритроцитов | 160,0-640,0 | мкг/л | |
Скорость оседания | < 10 мм в течение | мм/ч | |
Масса циркулирующих | мужчины | 25-35 | мл/кг |
женщины | 20-30 | мл/кг | |
Объем плазмы | 40-50 | мл/кг | |
Период полураспада | 25-30 дней | ||
Гемоглобин А2 | 1,5-3,2 | % общего Hb | |
Гемоглобин F | 0,5-0,8 | % общего Hb | |
*Примечание: пг – пикограмм (10-12г) фл – фентолитр | |||
Оглавление.
Глава |
Эритропоэз. |
Гемоглобин. |
Железо, |
Иммунология |
Морфофизиология |
Глава |
Глава |
Апластические |
Миелодиспластический |
Хроническая |
Мегалобластные |
Глава |
Мембранопатии. |
Наследственные мембранопатии. |
Пароксизмальная ночная гемоглобинурия |
Энзимопатии. |
Гемолитическая анемия вследствие |
Гемоглобинопатии. |
Качественные (структурные) |
Серповидно-клеточная анемия |
Гемоглобинопатия С |
Гемоглобинопатия SC |
Гемоглобинопатия D |
Гемоглобинопатия E |
Количественные гемоглобинопатии. |
β-талассемии. |
α-талассемии. |
H-гемоглобинопатия. |
Аутоиммунные |
АИГА с неполными тепловыми агглютининами. |
АИГА с полными холодовыми агглютининами. |
АИГА с двухфазными гемолизинами |
Глава |
Приложение. |
в соответствующих главах учебного
пособия приводятся подробные классификации
анемий этих типов.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Этот термин предложил Саммерс, но его истинный патогенетический смысл впервые раскрыли Брайн и Даси. Данная анемия характеризуется наличием венценосных (burr) эритроцитов в мазке крови и обычно, но не всегда сопровождается тромбоцитопенией. Венценосные клетки представляют собой фрагментированные или деформированные эритроциты, первоначально описанные Шварцем и Вотто, а позднее Ахермонм, обычно при болезнях почек. Венценосные клетки называют также «шлемовидными». Их часто сопровождают малые темно окрашивающиеся треугольные клетки и то или иное количество микросфероцитов. Хорошее изображение всех этих вариантов приведено в работе Брайна. Их нельзя считать артефактом, возникающим в процессе приготовления мазка (в отличие от зубчатости), так как венценосные клетки могут быть распознаны, когда эритроциты суспендированы в собственной плазме больного или другой жидкой среде.
Механизм образования венценосных клеток: патогенез МАГА
Венценосные клетки и МАГА наблюдаются не только при тех заболеваниях, когда можно ясно обнаружить васкулит с отложением фибрина в артериолах и капиллярах: имеются также убедительные данные, полученные in vivo и in vitro, что фрагментация и вызванный ею гемолиз обусловлены механической травмой быстро движущихся эритроцитов, которые наталкиваются на внутрисосудистые нити фибрина. Экспериментальное внутривенное введение тромбина или эндотоксина Е. coli кроликам приводило к острому внутрисосудистому гемолизу и появлению венценосных клеток в степени, пропорциональной количеству фибриновых тромбов, образовавшихся в почечных клубочках и микрососудах других тканей. Дефибринирование, вызванное у кроликов свертывающим кровь ядом малайской гадюки, вело к аналогичному гемолизу и изменениям эритроцитов.
Гематологическая диагностика
Диагноз зависит исключительно от обнаружения значительных количеств венценосных клеток в хорошо приготовленном мазке крови в сочетании с признаками гемолиза и обычно тромбоцитопенией. Тяжесть анемии и тромбоцитопении, а также степень компенсаторной эритроидной реакции весьма вариабельны. Это объясняется тем, что МАГА может быть следствием самых различных болезней и гемолиз колеблется в широких пределах — от сверхострого (например, при септицемии) до хронического (например, у больных с сердечными протезами). Как и при других формах внутрисосудистого гемолиза, уровень гемоглобина в плазме может быть повышен, гаптоглобины, как правило, отсутствуют, у больных с хроническим гемолизом могут наблюдаться гемосиденурия и увеличенная экскреция железа с мочой.
Продукты деградации фибрина в сыворотке (ПДФ) повышены при МАГА, вызванной заболеванием почек или злокачественной гипертонией, когда в патологический процесс вовлечены мелкие кровеносные сосуды. Однако при гемолизе, вызванном имплантацией протезов сердечных клапанов, этого повышения не наблюдается.
У некоторых больных с МАГА даже при нормальном уровне фибриногена в плазме увеличен катаболизм фибриногена, меченного радиоактивным веществом. Тромбоцитопения объясняется потреблением тромбоцитоз в микротромбах и может служить примером их повышенной деструкции, а не недостаточного образования. Следовательно, в костном мозге имеется нормальное количество мегакариоцитов наряду с эритроидной гиперплазией. Острые формы МАГА иногда сопровождаются потреблением циркулирующих факторов свертывания (коагулопатия потребления), которую можно обнаружить и, по-видимому, предупредить назначением гепарина. Это было доказано в одном случае острого некроза печени и в ряде тяжелых случаев гемолитического уремического синдрома. У других больных с этим синдромом, а также у больных с пересаженными почками наблюдалась МАГА с избирательной тромбоцитопенией и без нарушений свертываемости и изменений уровня ПДФ. Во многих случаях МАГА играет второстепенную роль, и на первый план выступает основное заболевание.
Можно сделать здесь одно практическое замечание, связанное с диагностикой, а именно; наличие венценосных клеток надо подтвердить в новых свежих мазках, полученных при пункции пальца. Необходимо исключить возможность искусственной фрагментации эритроцитов или появления зубчатых форм из-за таких факторов, как медленное подсыхание мазка, наличие детергента или жира на предметном стекле, дегенеративные изменения (или нагревание) крови, взятой с антикоагулянтом, или повреждение клеток вследствие изгнания крови под давлением через тонкую иглу. Это важно, так как присутствие истинных венценосных клеток может быть главным указанием на диагноз (например, при гемолитическом уремическом синдроме). Кроме того, измерения гемоглобина и подсчеты эритроцитов, повторяемые в течение суток, покажут, является ли процесс молниеносным, как при грамотрицательной септицемии.
К родственным формам механического или травматического гемолиза, но без венценосных клеток в крови, наблюдаемым обычно у молодых взрослых, относятся гемоглобинурия Марча или гемоглобинурия, связанная с физической нагрузкой, и сходный тип гемолиза, возникающий при занятиях карате, который, очевидно, объясняется травматической внутрисосудистой фрагментацией эритроцитов, особенно старых, в связи с тем, что ткани подвергаются непривычным ударам твердыми предметами.
Женский журнал www.BlackPantera.ru:
Митчел Уиллоуби
Источник