Механизм аутоиммунной гемолитической анемии
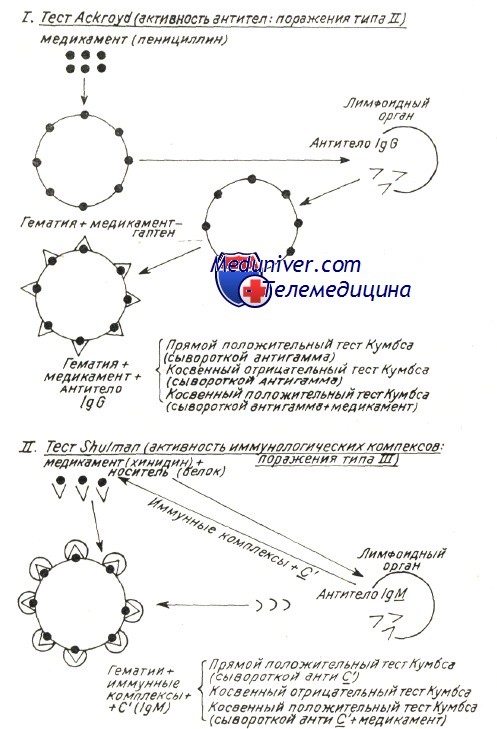
Механизмы развития аутоиммунной гемолитической анемии — патогенезВ механизме развития аутоиммунного гемолиза, независимо от вида антител, спорными представляются две проблемы: Начало аутоиммунного процесса общая проблема механизмов при всех аутоиммунных заболеваниях (Берчану), среди которых аутоиммунная гемолитическая анемия представляется как постоянная модель патогенетического исследования, применимая ряду аутоиммунных процессов. Существует ряд объяснений, в зависимости от вида аутоиммунной гемолитической анемии. Так, при вторичных формах после вирусной инфекции или сенсибилизации к медикаментозным препаратам происходит изменение антигенных структур оболочки эритроцита в результате собственно действия вируса или медикаментозного препарата. Прикрепление частиц вируса и химических антигенов к оболочке может создать новый иммуногенный комплекс, в котором инородные антигены выполняют роль сенсибилизирующего гаптена. Развивающиеся при этом антитела активны также в отношении антигенов эритроцитной оболочки и обусловливают расплавление крови. Таков механизм гемоцитолиза, описанный Ackroyd при гемоцитопении за счет сенсибилизации к медикаментозным препаратам. Поражение оболочки под воздействием вируса, медикаментозного препарата и прочих токсических веществ химической или инфекционной природы — среди широкого диапазона антигенов эритроцита — может «вскрыть» и его слабые антигены. Известно, что к последним иммуная переносимость небольшая, и что, под действием собственно острого, в частности хронического инфекционного процесса она нарушается, в результате чего развиваются аутоиммуные антиэритроцитные антитела, специфичные в отношении слабых антигенов. Проведенные в этом направлении исследования в условиях аутоиммунной гемолитической анемии доказали, что полные или неполные тепловые или холодовые антитела, выявляемые описанными выше способами в своем большинстве располагают групповой специфичностью, подобно изоантителам изоиммуной гемолитической анемии. Характеристика аутоантител при генуинной аутоиммунной гемолитической анемии в зависимости от иммунологических испытаний (видоизменение по Leddy) В таблице приведены не только физическая и биологическая характеристики антител, но и их групповая специфичность. Тепловые антитела вида IgG, выявляемые посредством прямой или косвенной реакции Кумбса с применением сыворотки антигамма и исследованные после их смыва с красных кровяных клеток, равно как и свободные антитела сыворотки специфично изоиммунные в отношении определенного резус-фенотипа. По данным Worlledge 38% тепловых антител антирезус, в то время как Weiner и Vos утверждают, что, с учетом форм резус с «делецией гена» эта пропорция равняется 70%. Доказать это удалось после пересмотра случаев, оказавшихся отрицательными к резус-специфичным антителам, но в которых, тем не менее, определяется наличие специфичности к более слабым резус-антигенам. Это антитела специфичные в отношении «нулевых» резус-гематий или тех, которые содержат лишь антигены ZW, рассматриваемые как D-like (Dacie и Worlledge, Eyster). Видимо они представляют собой антигенное вещество предшествующее антигенам резус-группы (Weiner и сотр.). Итак, иммунологические анализы доказали специфичность тепловых антител, при этом был уточнен ряд подгрупп Rr», h’ в рамках Rh наряду с группами ZW, реже JK и К (Yokoyama). Резус и иммуноглобулиновая специфичности объясняют их закрепление на красных кровяных клетках, но без связывания комплемента; это последнее явление видимо можно проследить лишь в отдельных подклассах иммуноглобулинов. По Muller-Eberhard связывание комплемента наблюдается только на подгруппах IgG1…IgG3 (исключается IgG4). В связи с этим не дано объяснение тому факту, что тепловые антитела, в принципе относящиеся к подгруппе IgG1 с анти-резус специфичностью, либо не связывают комплемент, либо связывают его очень редко.
Холодовые антитела проявили специфичность также к слабым антигенам, таким как антиген 1, который, вопреки этой слабости выявляется в размере примерно 100% той или иной популяции, как отметили Weiner и Vos на 20 тыс. образцов отобранной сыворотки. Лишь небольшой процент располагает специфичностью к антигену i, как было обнаружено в редких случаях гемолитической анемии после инфекционного моно-нуклеоза (Walheim и сотр.). Итак, удалось определить, что располагающие групповой специфичностью анти-I антитела это связывающие комплемент IgM. Другой механизм развития аутоантител можно проследить при гемолитической анемии за счет злокачественной лимфопролиферации, когда происходит расстройство клеточной системы иммунитета (КСИ). Следует предполагать, что в процессе злокачественной эволюции лимфоцитов в условиях хронической лимфатической лейкемии, ЛС или даже ОЛЛ разрастанием охвачены также «клоны» клеток, которые, по теории Burnet, рассматриваются как «запрещенные ». Таковыми являются линии лимфоидных клеток, ответственных за переносимость к сельфу, но остающихся неактивными или «спящими» в период зародышевой «клональной селекции» (Burnet). Их злокачественная пролиферация видимо обусловливает и развитие специфических антител к сельф-антигенам эритроцита в результате активации последних. Однако злокачественная пролиферация может ограничиться активными лимфоидными клетками вида В, ускальзывающими от избирательного угнетающего контроля клеток Т, сохраняющих врожденную иммуную переносимость. Таким образом создается иммуная функциональная диссоциация, обусловливающая выработку аутоиммуных антител. Независимо от гипотезы клиническое наблюдение доказало, что развитие антител и гемолиз прекращаются лишь после уничтожения образующего аутоантитела злокачественного клонуса, посредством цитостатической терапии. Возможно, что механизм пролиферации «запрещенных» клонусов действует и при гемолитической анемии с холодовыми антителами как следствие вирусной инфекции, такой как вирусная пневмония. Известно, что у индивидов в норме титр антител — холодовых агглютининов — невелик, составляя примерно 1/8—1/16. Резкая пролиферация за счет вирусной инфекции обусловливает активацию отдельных латентных лимфоидных клонусов, которые, возможно, ответственны за образование холодовых агглютининов (Van Loghem). В таких случаях, когда, по истечении определенного периода, расплавление крови не прекращается, показанная при гемолитической анемии с Холодовыми антителами цитостатическая терапия может оказать угнетающее действие на эти разросшиеся и образующие аутоантитела клонусы, подобно тому как наблюдается при злокачественной лимфопролиферации. Поскольку присутствие гемолитических аутоантител наблюдается и при некоторых реактивных процессах пролиферации во многих аутоиммунных и иммунодефицитных заболеваниях (Берчану) принято считать, что у подобных больных происходит более сложное нарушение иммунитета, неустойчивость гомеостатической системы иммунитета. В связи с этим, у страдающих иммунодефицитом к нонсельфу возможны отклонения иммунитета с понижением переносимости к сельфу. В механизме развития аутоиммунных заболеваний выявлено определенное отношение между иммунодефицитами к нонсельфу, состояниями гиперсенсибилизации, обусловливающими иммуные комплексы путем хронических неконтролируемых инфекций и развитием аутоиммуной болезни (Берчану). Тот факт, что аутоиммунные процессы, такие как аутоиммунная гемолитическая анемия при заболеваниях за счет отсутствия антител, улучшаются или даже исцеляются правильным назначением иммуноглобулина, подтверждает наличие нарушенного равновесия и лабильности иммунитета. И наконец, принято считать, что при определенных вирусных или микробных инфекциях, в частности отдельных новообразованиях — яичниковых и желудочных (Van Loghem) — в организме появляются антигены, структура которых близка к структуре антигенов отдельных эритроцитных групп. Эти перекрестнореагирующие антигены определяют развитие перекрестнореагирующих антител гемолитического действия и в отношении эритроцитов.
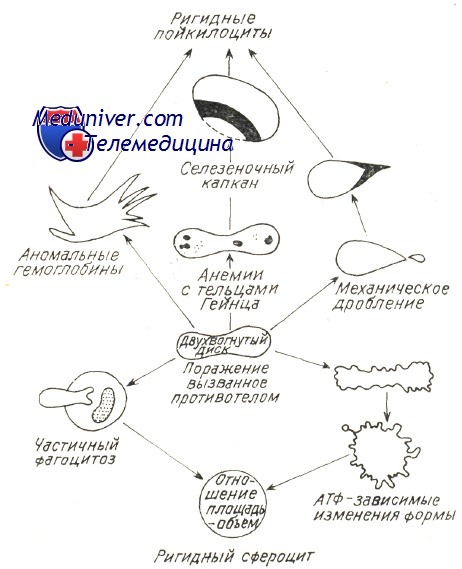
Во всех отмеченных стимулирующих иммунитет механизмах в патологических условиях (злокачественная лимфопролиферация, хроническое заболевание с чрезмерной нагрузкой на иммуную систему, заболевать за счет иммунодефицита), особенно когда аутоиммуная гемолитическая болезнь носит многолетний затяжной характер, следует предполагать нарушение врожденной иммуной переносимости с образованием гемолитических аутоантител, равно как и прочие аутоиммуные расстройства (Берчану). В принципе нарушается наиболее слабая иммуная переносимость к антигенам невысокой иммуногенной способности — Rh, I, i, Т. Реже встречаются случаи нарушения переносимости к крепким антигенам группы АВО, причем они редки в условиях злокачественной лимфопролиферации, когда развиваются «панагглютинины», расплавляющие эритроциты всех групп и переливание крови становится весьма опасным. По новым гипотезам о развитии аутоиммуных заболеваний предполагается наличие нарушения сотрудничества систем Th и Т8; дефицит Ts способствует дерепрессии «запрещенных » клонов В и выделению аутоантител (Берчану). Разрушение красных кровяных клеток в условиях аутоиммуного гемолиза подвергалось основательным исследованиям, в частности изучением реакций в пробирке между антителами и эритроцитами; при этом наблюдалось и действие комплемента в условиях гемолиза за счет холодовых антител, в частности при пароксизмальной холодовой анемии (Rosse и Dovramashkin). Электронномикроскопическое исследование оболочки эритроцита в условиях острого гемолиза при пароксизмальной гемоглобинурии показало, что, под воздействием связывающих комплемент холодовых антител на оболочке образуются «поры ». В связи с этим нарушается обмен катионов после проникновения воды в гематии и развивается острое внутрисосудистое расплавление крови. Поскольку существуют не расплавляющиеся гематии, со связанным на их оболочке комплементом, равно как и находящиеся в процессе расплавления гематии, на которых закрепляются лишь антитела (IgG), принято считать, что антитела необходимы для развертывания приоцесса гемолиза, который, следовательно, прижизненно не представляется возможным лишь под воздействием комплемента (Evans и сотр.). Фракции связанного комплемента видимо направляют механизм расплавления. Фракция С3 играет первостепенную роль в процессе гемолиза с холодовыми антителами. Issit установил роль фракции С3b, как при внутрисосудистом, так и печеночном внутриклеточном расплавлении крови. Явление пожирания красных кровяных клеток периферическими моноцитоидными макрофагами, неизменно наблюдаемое при гемолизе в условиях пароксизмальной гемоглобинурии, равно как и гистопатологическое исследование оперированной селезенки (Jandl) уже давно уточнили этот механизм. Недавно проведенные исследования выявили, что, в концентратах периферических лейкоцитов, несущие на себе Иг и комплемент эритроциты пожираются моноцитами. В зависимости от концентрации иммунных комплексов на эритроцитах увеличивается процент эритрофагоцитоза и наблюдается явление расположения розеткой гематий вокруг макрофагов (Abramson и сотр., Huber, и сотр.). В условиях аутоиммуной гемолитической болезни доказано наличие ряда механизмов внутриклеточного патологического расплавления крови, сокращающего продолжительность жизни красных кровяных телец. Возможно неполные антитела типа IgG или закрепленный на оболочке комплемент изменяют функциональную структуру эритроцита в отношении его подвижности в синусоидных органах, печени и селезенке, затем, посредством явления «секвестрации», его захватывает и разрушает макрофаг. Недавно уточнилось, что в селезенке, секвестрация осуществляется макрофаговыми рецепторами на несущий эритроцитом IgG. Макрофаги печени располагают рецепторами на С, вот почему несущие этот иммуноглобулин эритроциты разрушаются преимущественно в печени (Brown, Гологан и Берчану, Берчану). Этим объясняется положительный результат удаления селезенки лишь при гемолитической анемии с тепловыми антителами типа IgG (Бутояну и Берчану). В последние годы определилось, что в любом гемолитическом процессе, в том числе за счет ауто- или изоиммунных антител, происходит нарушение отношения объема и площади красной юровяной клетки, в связи с чем уменьшаются ее пластичность и элластичность (Weed). В главах, рассматривающих нормальное расплавление крови, говорилось о том, что элластичность гематий способствует их прохождению через поры синусовидиых эндотелиев, диаметром меньше 3 и. При этом эритроциты, располагающие большой степенью эластичности приспосабливают свою форму к размеру пересекаемого отверстия. Исследования в пробирке, при помощи оболочек с порами определенных размеров, уточнили условия прохождения в зависимости от «показателя элластичности», соответствующего показателю «фильтрации» (Jandl, Teitel). При иммуном патологическом гемолизе закрепленные на оболочке антитела или комплемент вызывают ее частичный разрыв и тем самым сокращение площади. Гематии приобретают вид сфероцита, как это отмечается в основном при приступах острого расплавления крови за счет тепловых или холодовых антител. После изменения отношения объем/площадь красные кровяные тельца становятся жесткими, пластичность понижается и прижизненно они более не проходят через поры эндотелия, а в пробирке — через поры циркуляционной мембраны. Итак наблюдается секвестрация гематий, «сенсибилизированных» гуморальными иммунными факторами, обусловливающими этим путем резкое пожирание красных кровяных клеток. Weed предложил схему, объясняющую механизм внутрисосудистого расплавления крови при любом гемолитическом эндоили экзоэритроцитном заболевании. Изменение эластичности, жесткость гематий предшествуют внутриклеточному гемолизу, обусловленному изменением количественного отношения площадь/объем и набуханием гематий в связи с изменением проницаемости или осаждением патологического гемоглобина. — Также рекомендуем «Лечение аутоиммунной гемолитической анемии — схема» Оглавление темы «Гемолитические анемии»:
|
Источник
Аутоиммунная гемолитическая анемия
(АИГА) — распространенная форма
приобретенных ГА. Выделяют два варианта
болезни:
• симптоматическую форму, при которой
анемия развивается на фоне определенного
заболевания (гемобластоза, системного
заболевания соединительной ткани,
хронического активного гепатита,
опухоли, НЯК и др.);
• идиопатическую форму, когда
обнаружить определенное заболевание
не удается (острое инфекционное
заболевание, беременность, роды и травма
в анамнезе не служат причиной АИГА, а
лишь провоцируют ее обострение).
При АИГА вырабатываются антитела к
собственному антигену эритроцитов.
Первый этап патогенеза АИГА — изменение
антигена эритроцитов под влиянием
лекарственных препаратов, вирусов или
бактерий. Возможна также соматическая
мутация единичного иммуноцита. Дальнейшая
реакция антител и антигенов эритроцитов
обусловливает развитие гемолиза и
анемии.
АИГА может развиваться при участии
различного вида аутоантител, вызывающих
гемолиз при различной температуре.
Различают два типа антител — тепловые
(реагируют с эритроцитами при температуре
тела не ниже 37 °С) и холодовые (реагируют
с эритроцитами при температуре ниже 37
°С). На этом основании выделяют четыре
вида АИГА:
• АИГА с неполными тепловыми
агглютининами;
• АИГА с тепловыми гемолизинами;
• АИГА с холодовыми агглютининами;
• АИГА с двухфазными гемолизинами.
Образующийся комплекс «эритроцит +
антитело» поглощают макрофаги селезенки
(внутриклеточный гемолиз). Также могут
вырабатываться аутоиммунные антитела
к тромбоцитам, что приводит к развитию
тромбоцитопении.
Чаще всего регистрируют АИГА, обусловленные
тепловыми аутоантителами. Последние
принадлежат к IgG и служат неполными
тепловыми агглютининами, максимально
демонстрирующими свое действие при
температуре 37 °С. Гемолиз происходит
внутриклеточно и существенно реже —
внутри сосудов.
Холодовые аутоантитела принадлежат к
IgM и представлены агглютининами. Гемолиз
возникает в результате их соединения
с эритроцитами и комплементом. Действие
антител начинается при низкой температуре
(ниже 32 °С): в мелких сосудах дистальных
отделов тела (пальцы рук, ног, кончики
ушей и носа) образуются крупные
конгломераты из агглютинированных
эритроцитов, а сами сосуды спазмируются.
Гемолиз происходит преимущественно
внутриклеточно, но обнаружение
гемоглобинурии указывает и на
внутрисосудистый гемолиз. При переходе
пациента в теплое помещение гемолиз
прекращается.
Значительно реже возникают АИГА,
обусловленные действием двух других
типов аутоантител — тепловых и двухфазных
холодовых гемолизинов. При обоих
вариантах агглютинации эритроцитов не
происходит. Гемолиз возникает при
осаждении аутоантител (гемолизинов) на
эритроцитах, в связи с чем он происходит
внутри сосудов и сопровождается
выделением черной мочи (гемоглобинурия).
Под действием тепловых
гемолизинов гемолиз происходит в обычных
условиях (пребывание на холоде — не
обязательное условие). Во время пребывания
больного на холоде двухфазные гемолизины
осаждаются на эритроцитах, но собственно
гемолиз начинается лишь после перехода
больного в теплое помещение.
Клиническая картина
Клиническая картина АИГА полиморфна и
обусловлена:
• быстротой развития гемолиза
(кризовое или более спокойное течение);
• преобладающим патогенетическим
механизмом гемолиза (те или иные
аутоантитела приводят к гемолизу при
различных внешних условиях);
• изменениями в органах (в частности,
в печени и селезенке);
• местом, где происходит гемолиз
(селезенка, сосудистое русло);
• фоновыми заболеваниями (при
вторичных АИГА).
В связи с этим при конечном сходном
результате — гемолизе эритроцитов и
развитии всех признаков ГА — на всех
трех этапах диагностического поиска
можно получить совершенно различные
данные.
Ha первом
этапе диагностического поиска больные
с гемолитическими кризами, обычно
развивающимися после травм и инфекционных
заболеваний, предъявляют жалобы на
повышение температуры тела, боли в
пояснице, озноб и возникновение
желтушности. При АИГА, спровоцированных
воздействием холода, отмечают
непереносимость низких температур: у
больных синеют дистальные участки
конечностей, нос и уши. Как правило, они
плохо себя чувствуют в холодное время
года.
На втором
этапе диагностического поиска (без
учета симптомов основного заболевания
при вторичных формах АИГА) обычно
возникают две ситуации:
• в период ремиссии, кроме легкой
желтушности и незначительного увеличения
селезенки (иногда — печени), можно не
обнаружить никаких изменений;
• в период криза симптомы более яркие
и представлены повышением температуры
тела, более интенсивной желтухой и
сосудистыми изменениями по типу синдрома
Рейно (особенно при АИГА, провоцируемой
действием низких температур).
Информация, полученная на первом и
втором этапе, не дает оснований для
установления диагноза АИГА, а тем более
для идентификации ее серологического
варианта. Может возникнуть лишь
предположение об этом заболевании
(особенно при развитии несомненных
гемолитических кризов, синдроме Рейно
или выделении черной мочи в период
криза). Для уточнения диагноза необходимо
доказать аутоиммунность ГА и отвергнуть
ряд заболеваний печени и желчных путей,
способных сопровождаться сходными
симптомами.
На третьем
этапе диагностического поиска обнаруживают
в большей или меньшей степени выраженный
синдром гемолиза (в зависимости от
существования или отсутствия
гемолитического криза). Чрезвычайно
важно обнаружение аутоантител. Основной
метод определения неполных тепловых
агглютининов — проба Кумбса, основанная
на агглютинации антиглобулиновой
сывороткой эритроцитов больного с
фиксированными на них антителами (прямая
проба Кумбса) или агглютинации с помощью
антиглобулиновой сыворотки эритроцитов
здорового человека, «нагруженных»
антителами из сыворотки крови больного
(непрямая проба Кумбса). Аутоантитела
также обнаруживают с помощью
агрегатгемагглютинационной пробы,
которая во много раз чувствительнее
пробы Кумбса.
Полные холодовые агглютинины обнаруживают
путем инкубации при различных температурах
эритроцитов донора и сыворотки больного.
Агглютинация происходит при определенных
разведениях сыворотки и температуре,
при этом чем выше температура, при
которой возможна агглютинация, тем
тяжелее протекает болезнь.
Двухфазные гемолизины определяют с
помощью эритроцитов донора, фиксирующих
на себе антитела больного при низкой
температуре. В дальнейшем при инкубации
такой смеси происходит гемолиз
эритроцитов. Иногда для обнаружения
гемолизинов используют пробу Кумбса:
чем более высокая температура требуется
для гемолиза, тем тяжелее протекает
заболевание.
При формах АИГА, протекающих с выработкой
гемолизирующих аутоантител (гемолизинов),
в моче присутствуют гемоглобин и
гемосидерин, так как гемолиз протекает
внутри сосудов. Моча приобретает темную
окраску (вплоть до черной).
На третьем этапе диагностического
поиска при симптоматических формах
АИГА можно обнаружить изменения,
обусловленные основным заболеванием:
опухолью, гемобластозом, диффузным
заболеванием соединительной ткани,
поражением печени и др.
Диагностика
Диагностика АИГА основана на обнаружении
сочетания признаков гемолиза и определении
аутоантител. Естественно, что в процессе
диагностики следует исключить ГА,
обусловленные воздействием различных
химических средств, малярийного
плазмодия, механическим повреждением
оболочки эритроцита, а также наследственной
этиологии.
Лечение
При назначении лечения учитывают фазу
аутоиммунной ГА (ремиссия или гемолитический
криз).
В период криза средством выбора служат
глюкокортикоиды, которые всегда
прекращают или уменьшают гемолиз. В
острой фазе назначают большие дозы
преднизолона (по 60-90 мг/сут) или
эквивалентные дозы других глюкокортикоидов.
При наступлении ремиссии их постепенно
уменьшают, переводя больного на
поддерживающие дозы (по 5-10 мг/сут).
Продолжительность гормонального лечения
при проведении гематологического и
серологического контроля (до исчезновения
или существенного уменьшения количества
аутоантител) составляет 2-3 мес.
В межприступном периоде можно назначать
другие иммунодепрессанты, например
аминохинолиновые препараты (хлорохин),
которые следует принимать длительно
(до одного года).
При плохой переносимости глюкокортикоидов,
противопоказаниях к их применению или
недостаточной эффективности рекомендовано
применение цитостатических
иммунодепрессантов (циклофосфамид,
метотрексат). Эти средства особенно
эффективны при АИГА, связанной с
холодовыми агглютининами.
В случаях, когда применение глюкокортикоидов
и цитостатических средств не позволяет
достичь четкого улучшения, хороший
эффект может оказать спленэктомия. При
выраженной анемии рекомендовано
переливание эритроцитарной массы, но
кровь необходимо подбирать индивидуально,
с помощью непрямой пробы Кумбса, когда
переливаемые эритроциты «нагружают»
антителами сыворотки крови больного.
Если проба Кумбса с эритроцитами донора
отрицательная, то такую кровь можно
переливать.
Прогноз
При незначительном гемолизе и отсутствии
гемолитических кризов прогноз
удовлетворительный. Усиление гемолиза
с резким снижением концентрации
гемоглобина значительно ухудшает
прогноз.
Профилактика
Меры первичной профилактики ГА в
настоящее время разработаны недостаточно.
При установлении диагноза ГА больных
ставят на диспансерный учет и периодически
проводят исследования крови. Кроме
того, им запрещают контакт с веществами,
способствующими усилению гемолиза.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник