Мегалобласты при в12 дефицитной анемии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 января 2019;
проверки требуют 5 правок.
Перницио́зная анеми́я (от лат. perniciosus — гибельный, опасный) или B12-дефицитная анемия или мегалобластная анемия или болезнь Аддисона — Бирмера или (устаревшее название) злока́чественное малокро́вие — заболевание, обусловленное нарушением кроветворения из-за недостатка в организме витамина B12. Особенно чувствительны к дефициту этого витамина костный мозг и ткани нервной системы.
Основные сведения[править | править код]
Это синдром, связанный с недостатком B12 и фолиевой кислоты в организме. Характеризуется наличием в костном мозге большого количества крупных незрелых предшественников эритроцитов (мегалобластов).
Витамин B12всасывается в основном в нижней части подвздошной кишки. Анемия может быть вызвана недостаточным потреблением витамина B12 в пищу, недостаточной выработкой внутреннего фактора Касла в париетальных клетках желудка, патологическими процессами в подвздошной кишке с нарушением всасывания или конкуренцией за витамин B12 со стороны ленточных червей или бактерий.
При дефиците витамина B12 на фоне анемической клинической картины (или без неё) могут возникнуть и неврологические расстройства из-за связанного с дефицитом витамина B12 нарушения синтеза жирных кислот. Может наблюдаться демиелинизация и необратимая гибель нервных клеток. Симптомами такой патологии являются онемение или покалывание конечностей и атаксия.
Проявления[править | править код]
- Ярко-красный, а затем «лакированный» язык.
- Желудочная ахилия.
- Малокровие с наличием патологических эритроцитов.
- Поражение нервной системы.
- Желтоватый цвет кожи.
- Образование в костном мозге аномальных крупных клеток вместо эритроцитов (переход на мегалобластический тип кроветворения).
Причины[править | править код]
- Недостаток витамина B12 в питании или нарушение его всасывания
- Расстройство кишечника
- Долгое использование медицинских препаратов, приводящих к уменьшению кислотности в желудке
- Гастрэктомия
- Аутоиммунное поражение внутреннего фактора Касла или париетальных клеток.
- Заражение ленточными червями (лентец широкий)
- Токсическое воздействие на стенку желудка
- Рак желудка
- Наследственный дефект, передается аутосомно-рецессивно
Осложнения[править | править код]
В отсутствие лечения развиваются анемия и дегенерация нервов, так как костный мозг и ткани нервной системы особенно чувствительны к дефициту витамина B12.
Историческая справка[править | править код]
В 1855 году английский врач Томас Аддисон, а затем в 1872 году более подробно немецкий врач Антон Бирмер описали болезнь, которую назвали злокачественной (пернициозной) анемией. Вскоре французский врач Арман Труссо предложил называть эти болезни аддисоновой анемией и болезнью Аддисона.
В 1926 году Дж. Уипл, Дж. Майнот и У. Мерфи сообщили, что пернициозная анемия лечится введением в рацион питания сырой печени и что в основе заболевания лежит врожденная неспособность желудка секретировать вещество, необходимое для всасывания витамина B12 в кишечнике. За это открытие они в 1934 году получили Нобелевскую премию.
См. также[править | править код]
- Внутренний фактор
- https://en.wikipedia.org/wiki/Vitamin_B12_deficiency
Примечания[править | править код]
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
Ссылки[править | править код]
- Анемия
- Наше здоровье
- Da-med.ru ::: B12-дефицитная анемия (Пернициозная анемия)
Источник
В12-дефицитная анемия (мегалобластическая, пернициозная, болезнь Аддисона-Бирмера) — это заболевание, характеризующееся нарушением процесса кроветворения по причине дефицита в организме витамина В12. Оно проявляется главным образом патологиями костного мозга, нервной системы и желудочно-кишечного тракта.
Почему развивается болезнь
Гемоглобин — это белок, из которого состоят эритроциты — красные кровяные тельца. Его функция состоит в транспорте кислорода к клеткам и выведении углекислого газа. При недостатке эритроцитов и угнетенной функции гемоглобина развивается малокровие.
В зависимости от этиологического фактора и клинических проявлений бывают разные виды анемий. Мегалобластная анемия (она же пернициозная анемия) возникает вследствие недостатка витамина В12 или фолиевой кислоты — веществ, принимающих активное участие в синтезе новых эритроцитов в организме. Механизм развития данной болезни проявляется изменением формы и увеличением размеров эритроцитов.
Причины В12 дефицитной анемии:
- Недостаточная выработка в желудке специфического белка, благодаря которому витамин В12 способен всасываться в кровь (фактора Касла). Такая разновидность анемий называется злокачественной (болезнь Аддисона-Бирмера). Однако такая форма хорошо поддается терапии.
- Оперативное удаление подвздошной кишки, в которой происходит всасывание витамина В12, или части желудка, в которой синтезируется фактор Касла.
- Недостаточное поступление в организм витамина В12 с продуктами животного происхождения (мясо, рыба, молоко, морепродукты). Наиболее часто по такой причине от анемии В12 страдают вегетарианцы.
- Патологии кишечника, которые приводят к нарушению всасывания питательных веществ (болезнь Крона, НЯК).
- Прием лекарственных средств, которые снижают кислотность в желудке (ингибиторы протонной помпы).
- Нарушение механизма поступления витамина В12 внутрь клетки при нормальном всасывании его.
- Состояния, при которых потребность в витаминах превышает его поступление в организм (беременность, паразитарные заболевания).
Как часто Вы сдаете анализ крови?
Симптоматика и как обнаружить заболевание
В результате анемии происходит пониженное снабжение кислородом клеток. Это приводит к быстрой утомляемости, слабости, головокружениям и обморокам, звону в ушах, бледности кожных покровов и слизистых оболочек, одышке, сердцебиению, снижению аппетита и массы тела.
Выделяют три больших синдрома, в которые включаются основные симптомы мегалобластической анемии:
- Анемический синдром. Проявляется слабостью, головокружением, обморочными состояниями, шумом в ушах, мельканием «мушек» в глазах, одышкой, тахикардией, покалыванием в грудной клетке.
- Гастроэнтерологический синдром. Характеризуется снижением аппетита и веса, тошнотой, рвотой, запорами, жжением и изменением окраски (малиновый) языка (глоссит).
- Неврологический синдром. Включает симптомы поражения периферической нервной системы, такие как онемение и покалывание конечностей, неустойчивость походки, мышечная слабость. При длительном и выраженном дефиците витамина В12 возможно развитие поражения спинного и головного мозга, которое проявляется в утрате вибрационной чувствительности в ногах, судорогах.
Виды
Согласно международной классификации болезней (МКБ-10) выделяют следующие виды:
- D51.0 — недостаточность внутреннего фактора Касла, что приводит к анемии Аддисона-Бирмера (злокачественная анемия);
- D51.1 — нарушение всасывания в сочетании с выделением белка с мочой (протеинурия);
- D51.2 — пернициозная анемия, симптомами которой бывают онеменение или покалывание конечностей (в результате недостаточности транскобаламина II);
- D51.3 — анемии, ассоциированные с пищей;
- D51.8 — другие виды недостаточности В12 с анемией;
- D51.9 — мегалобластные анемии неуточненные.
Степени
Клинические признаки В12-дефицитной анемии являются показанием для лабораторного исследования крови.
Основным критерием классификации анемий по степени тяжести является содержание гемоглобина в крови. В зависимости от уровня гемоглобина различают такие степени:
- легкая (содержание гемоглобина в крови от 90 до 110 г/л);
- среднетяжелая (гемоглобин от 90 до 70 г/л);
- тяжелая (гемоглобин менее 70 г/л).
В норме уровень гемоглобина в крови составляет 130-160 г/л у мужчин и 120-150 г/л у женщин. Содержание гемоглобина от 110 до 120 г/л является промежуточным между нормой и анемией.
Симптомы В12 дефицитной анемии могут еще не появиться, в то время как в крови уже видны нарушения. Диагноз мегалобластная анемия ставится главным образом по картине крови.
Диагностические меры
Пернициозная анемия имеет ряд специфичных клинических симптомов и изменений в лабораторных анализах, поэтому ее диагностика не представляет большой сложности для врача-гематолога.
При обнаружении типичной триады анемического, желудочно-кишечного и неврологического синдромов назначается исследование гемограммы и миелограммы.
В периферической крови при данном заболевании возникают следующие характерные изменения:
- цветной показатель выше 1,0 (гиперхромная);
- количество эритроцитов снижено в большей степени, чем уровень гемоглобина;
- содержание и концентрация гемоглобина в эритроците повышена;
- макроцитоз — в мазке крови определяются большие гиперхромные эритроциты;
- анизопойкилоцитоз — обнаруживаются эритроциты измененной (каплеобразной) формы;
- базофильная зернистость эритроцитов;
- эритроциты, содержащие тельца Жолли, тельца Кебота;
- анизоцитоз тромбоцитов;
- гиперсегментация ядер нейтрофилов;
- единичные эритрокариоциты, мегалобласты;
- снижение количества ретикулоцитов;
- у большинства больных наблюдается лейко- и тромбопения — снижение количества лейкоцитов и тромбоцитов.
В красном костном мозге обнаруживаются следующие патологические изменения:
- гиперплазия красного ростка с мегалобластным типом кроветворения;
- промегалобласты, мегалобласты;
- асинхронное дозревание ядра — цитоплазма оксифильная, ядро — незрелое;
- деление клеток (митоз);
- тельца Кебота и тельца Жолли в эритроцитах;
- изменения в гранулоцитарном ряду: гигантские метамиелоциты и палочкоядерные.
Однократное введение витамина В12 приводит к полной трансформации мегалобластного типа кроветворения в нормобластный, поэтому терапевтический курс не рекомендуется назначать до проведения стернальной пункции, иначе исследование костного мозга будет неинформативным.
Дополнительные исследования, которые могут помочь в постановке диагноза дефицитная анемия:
- определение уровня билирубина в крови — обнаруживается повышение непрямого билирубина;
- уровень лактатдегидрогеназы — повышение;
- ФЭГДС с биопсией — атрофический гастрит;
- с целью контроля эффективности терапии и дифференциальной диагностики проводят повторное определение числа ретикулоцитов в крови на 6-7 день терапии (должно наблюдаться увеличение их числа — «ретикулоцитарный криз», что является показателем эффективности и правильности диагноза).
Отличить данное заболевание необходимо в первую очередь от фолиеводефицитной анемии. Эти две патологии имеют такое сходство клинико-лабораторных проявлений, что раньше злокачественная анемия (болезнь Аддисона-Бирмера) называлась В12-фолиеводефицитной.
Сразу подтвердить или опровергнуть диагноз фолиеводефицитной анемии можно с помощью определения уровня фолатов в сыворотке крови. Его снижение служит основанием для установления данного диагноза. Но такое исследование во многих учреждениях недоступно. Поэтому чаще прибегают к тактике поэтапного назначения витамина В12 и фолиевой кислоты.
Лечение
Лечение болезни может проводиться как в амбулаторных условиях, так и в стационаре, в зависимости от тяжести состояния больного.
Медикаментами
Терапию мегалобластной анемии неуточненного генеза начинают с назначения витамина В12. Раствор цианокобаламина вводят в суточной дозе 500 мкг внутримышечно ежедневно в течение 2 недель. Если в конце первой недели не наступает «ретикулоцитарный криз» — наиболее вероятен диагноз фолиеводефицитной анемии.
В случае положительного результата после 2 недель переходят на режим дозирования цианокобаламина 500 мкг 1 раз в неделю. Терапию продолжают до нормализации показателей красной крови: гемоглобина, процентного содержания ретикулоцитов, количества эритроцитов.
Учитывая, что, согласно современным представлениям, анемия Аддисона относится к аутоиммунным заболеваниям (аутоиммунный атрофический гастрит приводит к прекращению синтеза фактора Касла), лечение пернициозной анемии позволяет лишь добиться стойкой гематологической ремиссии. Для поддержания ремиссии и профилактики рецидивов заболевания больным показано введение цианокобаламина 1 раз в месяц в дозе 500 мкг пожизненно. Такие больные подлежат диспансерному наблюдению у гематолога.
Больным с выраженными неврологическими нарушениями доза цианокобаламина должна быть увеличена на 50% первые полгода терапии.
При тяжелом состоянии пациента — симптомах гипоксии, сердечно-сосудистой недостаточности, пренициозной комы — показано экстренное переливание эритроцитарной массы.
Народными средствами
В 1926 году был впервые предложен метод терапии мегалобластной анемии назначением специальной диеты, содержащей сырую телячью печень.
Для этого лучше всего подходит нежирная сырая телячья печень, которую необходимо дважды пропустить через мясорубку и принимать по 200 г перед каждым приемом пищи.
Некоторые другие народные средства могут помочь ослабить симптомы заболевания. Некоторые из них:
- при сильной слабости принимать 1 ст. л. чеснока с медом перед каждым приемом пищи;
- отвар соцветий красного клевера принимать по 1 ст. л. 3 раза в день;
- отвар плодов шиповника принимать по 1 стакану 3 раза в день после еды в качестве горячего напитка.
В современных условиях болезнь Аддисона-Бирмера хорошо поддается лечению синтетическими препаратами витамина В12, которые хорошо переносятся и стоят недорого. Поэтому народная медицина имеет лишь вспомогательное значение. Лечиться от диагноза анемия В12 какими-либо народными рецептами можно, лишь посоветовавшись с врачом-гематологом.
Возможные последствия и прогноз
Термин «пернициозная анемия» («злокачественное малокровие»), как уже говорилось ранее, имеет лишь историческое значение. Прогноз заболевания благоприятный. Несмотря на то что мегалобластная анемия чаще всего протекает хронически и требует пожизненного поддерживающего терапевтического курса, качество жизни пациентов, находящихся в ремиссии, страдает мало. Эти люди могут вести активный образ жизни.
Важный прогноз остается у пациентов с запущенной формой анемии, сопровождающейся развитием гипоксии, легочно-сердечной недостаточности и комы. Эти состояния требуют немедленного начала интенсивной терапии, отсрочка которой может привести к летальному исходу.
Источник
Медицина / Патология / Патология (статья)
B9- и B12-дефицитные анемии
Статья |
21-10-2018, 18:11
|
 АнемияМегалобластная анемия – одна из форм анемии, представляющая большую группу заболеваний, которые возникают в результате нарушения синтеза ДНК в эритроидных клетках; характеризуется мегалобластным типом кроветворения. Нарушение синтеза ДНК происходит при дефиците витаминов B9 (фолиевая кислота) и B12 (цианокобаламин), некоторых генетических нарушениях (наследственных патологиях, сопровождающихся нарушением активности ферментов, принимающих участи в синтезе коферментов фолиевой кислоты или утилизации оротовой кислоты (оротовая ацидурия)).
АнемияМегалобластная анемия – одна из форм анемии, представляющая большую группу заболеваний, которые возникают в результате нарушения синтеза ДНК в эритроидных клетках; характеризуется мегалобластным типом кроветворения. Нарушение синтеза ДНК происходит при дефиците витаминов B9 (фолиевая кислота) и B12 (цианокобаламин), некоторых генетических нарушениях (наследственных патологиях, сопровождающихся нарушением активности ферментов, принимающих участи в синтезе коферментов фолиевой кислоты или утилизации оротовой кислоты (оротовая ацидурия)).
При мегалобластной анемии в костном мозге определяются клетки с характерными морфологическими признаками: крупные, незрелые по внешнему виду ядра, окруженные относительно более зрелой цитоплазмой. С точки зрения биохимии основной причиной этого состояния является нарушение синтеза ДНК: в S-фазе клеточного цикла клетки прекращают развиваться (при частичной репликации ДНК клетка не может завершить процесс деления). При этом синтез РНК не нарушен. Происходит нарушение дифференцировки ядра. Учитывая, что синтез цитоплазматических компонентов очень интенсивный (особенно гемоглобина), площадь клеток-эритроидных предшественников очень расширена – это способствует образованию макроцитов (гиперхромных эритроцитов крупных размеров) или мегалоцитов. Такие изменения также характерны для гранулоцитарных предшественников и мегакароцитов.
Впервые мегалобласная анемия была описана английским ученым Аддисоном (Addison) в 1849 году. Аддисон обозначил ее как злокачественную (пернициозную). Врач Фенвик (Fenwick) из Лондона в 1870 году при вскрытии больного с пернициозной анемией обнаружил атрофию слизистой оболочки желудка. Немецкий врач Биермер (Biermer, Цюрих) в 1872 году в отношении этой патологии применил термин «прогрессирующая пернициозная анемия». А в 1880 ученый Эрлих (Ehrich) в костном мозге больных пернициозной анемией обнаружил крупные клетки со специфической структурой – мегалобласты. В начале XX века пернициозная анемия была одной из самых распространенных патологий крови и считалась неизлечимой.
Специалистам, которые изучали эту патологию и методы ее лечения, было присвоено пять Нобелевских премий. В 1930 году Касл (Castle) предполагал, что в мясе животных содержится «внешний фактор», который связывается с «внутренним фактором», в результате чего образуется так называемое гемопоэтическое вещество, способное усваиваться и депонироваться в печени. Ученые Минот (Minot), Марфи (Murphy) и Випл (Whipple) получили Нобелевскую премию в области медицины и физиологии за новый метод лечения пернициозной анемии сырой печенью. В 1948 году сразу две группы ученых (в США под руководством Фолкерса (Folkers) и в Великобритании под руководством Лестера-Смита (Lester-Smith)) выделили внешний фактор, витамин B12. Также Нобелевскую премию получила Дороти Кроуфут-Хоткин (Dorothy Crowfoot-Hodgkin) за изучение структуры пенициллина и витамина B12.
Витамин B12 (цианокобаламин) обладает структурой корриноида, в основе которой находится углеродная структура коррина, схожего по строению с порфирином. Цианокобаламин – сложная по структуре молекула с центральным атомом кобальта, который связан с четырьмя пиррольными кольцами и нуклеотидом. Витамин B12 имеет две коферментные формы – аденозилкобаламин и метилкобаламин. В крови человека основная форма витамина B12 – метилкобаламин.
Витамин B12 содержится только в продуктах животного происхождения (печень, почки, мясо, молоке и молочных продуктах). Небольшое количество этого витамина синтезируется в кишечнике человека. Цианокобаламин практически не содержится в продуктах растительного происхождения. У травоядных животных синтез витамина B12 происходит в желудке благодаря микроорганизмам, обитателям бобовых и корнеплодов, затем витамин попадает в паренхиматозные ткани и мышцы этих животных. Максимальная концентрация цианокобаламина в печени и почках животных (примерно 100 мкг/100 г продукта). В мясе содержание цианокобаламина гораздо ниже (примерно 0,5-2,0 мкг/100 г). Содержание витамина B12 в молоке и яйцах еще ниже, кроме этого, из-за прочной связи с протеином кобалафилином, содержащийся в этих продуктах витамин плохо усваивается. Цианокобаламин под действием протеолитических ферментов высвобождается в желудке и при кулинарной обработке продуктов.
Через стенки кишечника цианокобаламин попадает в кровь, где вступает в связь с транскобаламином II (транспортным протеином) и через воротную вену распределяется по кровеносной системе, откуда попадает в ткани-мишени.
Содержание цианокобаламина в организме взрослого человека составляет от 2 до 5 мг. Основной запас витамина B12, которого хватает на несколько лет (3-6), находится в печени. Экскреция (выведение из организма) цианокобаламина осуществляется через кишечник (с калом) и почки (с мочой), и составляет примерно 2-5 мкг в сутки. Суточная потребность организма взрослого человека в витамине B12 составляет 3-7 мкг.
Коферменты витамина B12 принимают участие в процессе синтеза ДНК, а также в регуляции функции системы гемопоэза и нервной системы. В крови содержится в большей степени активная форма витамина – метилкобаламин, который участвует в синтезе тетрагидрофолиевой кислоты, необходимой для образования тимидина.
Дефицит витамина B12 приводит к нарушению метаболизма фолатов и синтеза ДНК, в результате чего пролиферирующие кроветворные клетки не способны полностью созревать и нормально делиться. При этом в костном мозге развивается мегалобластический тип кроветворения, что приводит к появлению гигантских клеток миелопоэза и мегакариоцитопоэза. Из-за дефицита витамина B12 или B9 образуется недостаточное количество тетрагидрофолата, что вызывает развитие мегалобластной анемии по причине снижения синтеза нуклеиновых кислот.
Клиническая картина
Классическая картина B12-дефицитной анемии состоит из трех основных синдромов:
- Анемический синдром (см статью «Анемия. Общие положения. Классификация»)
- Желудочно-кишечный
- Неврологический
B12-дефицитная анемия, как правило, манифестирует в возрасте 50-60 лет (при этом такие пациенты часто выглядят старше своего возраста). Этот вид анемии наиболее широко распространен в Скандинавских странах, что обусловлено предрасположенностью к этой патологии голубоглазых блондинов.
B12-дефицитная анемия имеет три степени тяжести:
I степень: Легкая – концентрация гемоглобина в крови > 90 г/л
II степень: Средняя – концентрация гемоглобина в крови 70-90 г/л
III степень: Тяжелая – концентрация гемоглобина в крови < 70 г/л
Как правило больные обращаются к врачу при средней и тяжелой степени анемии. Часто от появления первых симптомов анемии до постановки диагноза проходит более года.
B12-дефицитная анемия обычно дебютирует анемическим синдромом (больного беспокоит слабость, повышенная утомляемость, тахикардия, одышка при незначительной физической нагрузке). По причине относительно медленного развития патологии выраженность анемии по данным лабораторных анализов часто оказывается большей, чем врачи ожидают при анализе клинических данных. Исключением являются больные, у которых неврологическая симптоматика усиливается быстрее, чем анемический синдром. Бывают случаи, когда характерное при глоссите жжение зыка возникает раньше, чем проявления анемии. У больных могут наблюдаться парестезии. При тяжелых случаях развивается фуникулярный миелоз, характеризующийся нарушениями чувствительности и походки. В случае дальнейшего прогрессирования патологии у больного возникают нарушения зрения, расстройства мочеиспускания. Нарушения функций желудочно-кишечного тракта наблюдаются примерно у 40-50% пациентов, страдающих B12-дефицитной анемией.
Объективное обследование пациента с B12-дефицитной анемией позволяет обнаружить характерную бледность кожи (с лимонно-желтым оттенком), субиктеричность кожи и склер. У ряда больных обнаруживаются объективные признаки глоссита (язык приобретает алый цвет с участками воспаления; сосочки языка сглаженные, иногда атрофированные – «лакированный» язык; отметим, что эти симптомы встречаются очень редко, как и глубокая мегалобластная анемия). Незначительное увеличение печени и селезенки при B12-дефицитной анемии наблюдается у 10-20% пациентов. Но у большинства пациентов патология сопровождается только анемическим синдромом, который часто является единственным клиническим признаком даже при тяжелой степени анемии.
Диагностика анемии основана на анамнезе, клинической картине, морфологическом исследовании клеток крови и костного мозга, анализа крови на содержание цианокобаламина и фолиевой кислоты.
Диагностика B12-дефицитной анемии
При B12-дефицитной анемии происходят характерные изменения гемограммы, включающие лейкопению, макроцитарную анемию, тромбоцитопению, а также гиперсегментированные нейтрофилы в мазке крови.
Мегалобластные анемии характеризуются преимущественным снижением уровня эритроцитов и в меньшей степени гемоглобина. Гиперхромия в этом случае проявляется повышением величины гемоглобина > 35 пг или цветового показателя > 1,1. Также увеличивается средний объем эритроцитов (> 100 фл и даже > 120 фл). В случаях, когда B12-дефицитная анемия сочетается с железодефицитной анемией или анемией хронического воспаления, средний объем эритроцитов может оставаться в пределах нормы. Выраженное повышение уровня ретикулоцитов (200-300% и выше) развивается на 5-8 день лечение витамином B12 – это повышение является подтверждением диагноза. Кроме этого, у многих пациентов наблюдается лейкопения (выраженность лейкопении часто коррелирует со степенью тяжести анемии). В некоторых случаях может наблюдаться снижение уровня тромбоцитов.
Большое диагностическое значение среди биохимических анализов крови имеет исследование уровня цианокобаламина. В миелограмме при нормальном или повышенном уровне миелокариоцитов обнаруживается выраженная гиперплазия эритроидного ростка и мегалобластический тип кроветворения (см рис. 1-7).
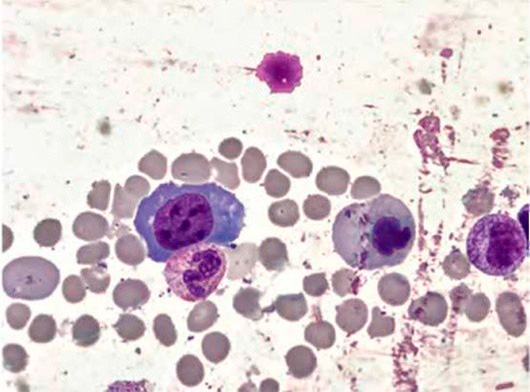
Рисунок 1. B12-дефицитная анемия. Костный мозг. Мегалобласты (окр. по Романовскому-Гимзе; ув. ×100)
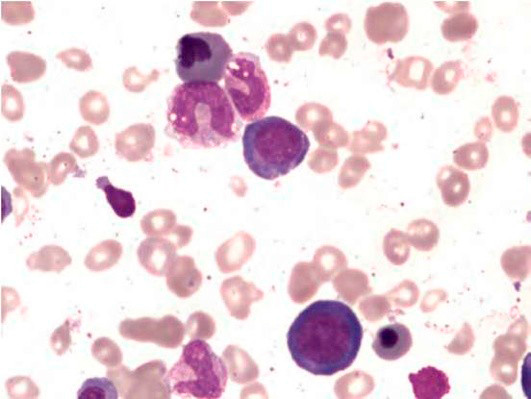
Рисунок 2. B12-дефицитная анемия. Костный мозг. Мегалобласты. Гигантские палочкоядерные нейтрофилы (окр. по Романовскому-Гимзе; ув. ×100)
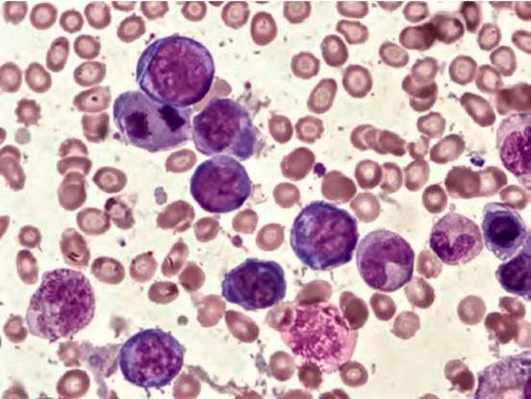
Рисунок 3. B12-дефицитная анемия. Костный мозг. Множественные базофильные мегалобласты – «синий костный мозг» (окр. по Романовскому-Гимзе; ув. ×100)
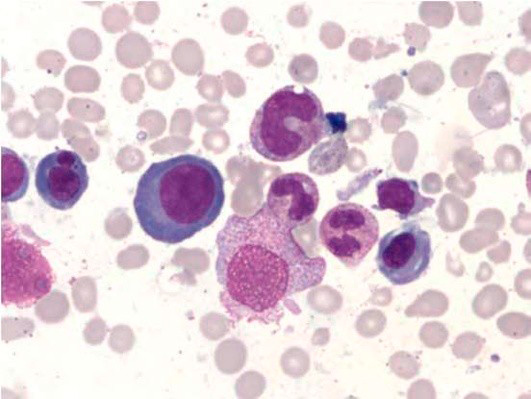
Рисунок 4. B12-дефицитная анемия. Препарат костного мозга. Мегалобластный тип кроветворения (окр. по Романовскому-Гимзе; ув. ×100)
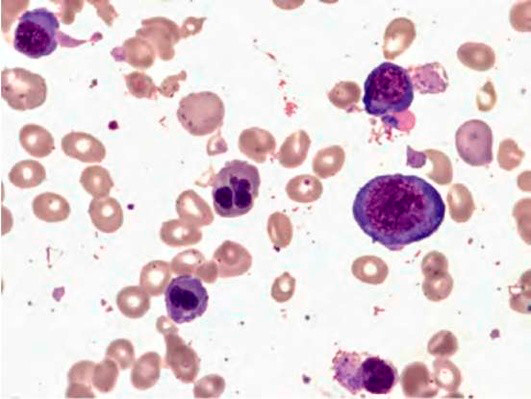
Рисунок 5. B12-дефицитная анемия. Препарат костного мозга. Множественные базофильные мегалобласты – «синий костный мозг» (окр. по Романовскому-Гимзе; ув. ×100)
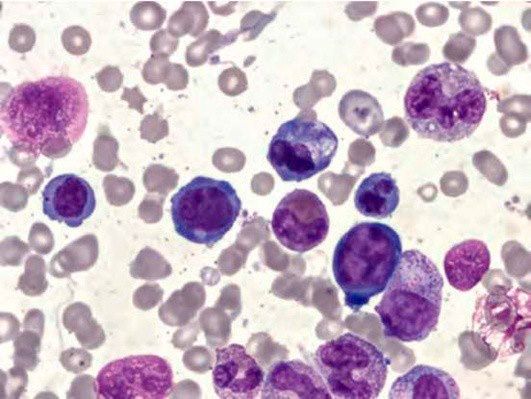
Рисунок 6. B12-дефицитная анемия. Препарат костного мозга. Мегалобласты, гигантские палочкоядерные нейтрофилы (окр. по Романовскому-Гимзе; ув. ×100)
Такие изменения миелограммы можно наблюдать только до начала терапии витамином B12. В аспирате костного мозга, полученного даже после однократной инъекции препарата, мегалобласты исчезают, а мегалобластический тип кроветворения сменяется нормобластическим. Отметим, что очень важным диагностическим критерием является высокий уровень лактатдегидрогеназы в крови.
Основа диагностики B12-дефицитной анемии в гематологии – анализ костного мозга на предмет наличия мегалобластов и миелоцитов с метамиелоцитами (гигантских клеток-предшественников гранулоцитопоэза). Но на практике эти клетки обнаруживаются не во всех случаях (даже если у больного явная форма анемии). Предположительно это происходит из-за того, что какое-то количество цианокобаламина больной все-таки как-то получил, что послужило причиной временного изменения гемопоэза, но не позволило полностью улучшить состояние. Но точные причины такого парадокса неизвестны. Поэтому с целью диагностики типичного случая B12-дефицитной анемии достаточно провести анализ периферической крови, с помощью которого можно определить гиперхромную макроцитарную анемию (при дифференциальной диагностике только патологий из группы миелодиспластических синдромов!). При этом могут обнаруживаться гиперсегментированные нейтрофилы (см рис. 7, 8), иногда метамиелоциты.
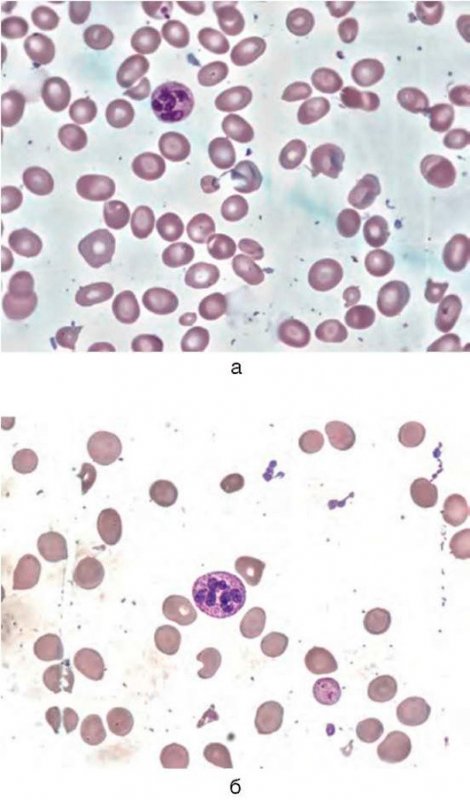 B12-дефицитная анемия
B12-дефицитная анемия
Рисунок 7. B12-дефицитная анемия. Препарат костного мозга. Множественные мегалобласты (окр. по Романовскому-Гимзе; ув. ×100) (а, б)
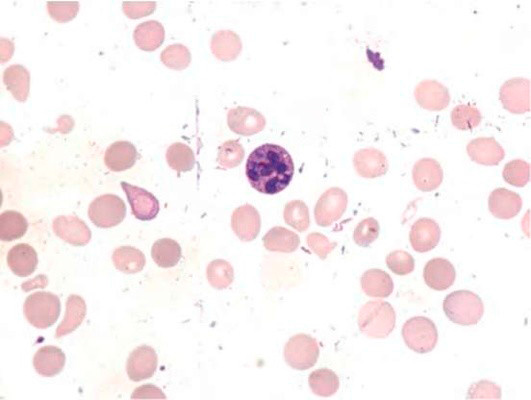
Рисунок 8. B12-дефицитная анемия. Костный мозг. (окр. по Романовскому-Гимзе; ув. ×100)
Если лабораторные исследования демонстрируют умеренную тромбоцитопению, незначительное повышение уровня непрямого билирубина и значительное повышение концентрации лактатдегидрогеназы, диагноз можно считать подтвержденным (в этом случае проведение дополнительных пункций – лишняя процедура).
При диагностике B12-дефицитной анемии важное значение играет фиброгастроскопия, с помощью которой можно подтвердить диагноз «атрофический гастрит» — главная причина дефицита цианокобаламина. Кроме этого, гастроскопия позволяет исключить злокачественную патологию желудка.
После назначения лечения витаминами B9 и B12 наблюдается следующая динамика изменения показателей лабораторных исследований:
— значительное повышение уровня эритроцитов и гемоглобина в течение 14 дней, показатель которых, в зависимости от выраженности дефицита, нормализуется через 8-12 недель с момента начала лечения; отметим, что уровень гемоглобина повышается медленнее, поэтому его показатель в периферической крови возвращается в норму через 1-2 месяца лечения;
— на 2-4-й день терапии начинает увеличиваться уровень ретикулоцитов, достигает максимума на 8-9-й день, и нормализуется к 14-му дню лечения; при этом повышается уровень тромбоцитов и лейкоцитов;
— на 10-14-й день терапии гиперсегментация ядер нейтрофилов сохраняется;
— в течение 24-48 часов после первого введения препарата в костном мозге исчезают мегалобласты; изменения морфологии ядер гранулоцитов сохраняется еще несколько суток;
— биохимический анализ крови показывает повышение уровня мочевой кислоты и холестерина (максимум достигается на пике ретикулоцитоза); концентрация лактатдегидрогеназы, щелочной фосфотазы и билирубина возвращаются в норму; может наблюдаться незначительное снижение концентрации калия в крови.
Лечение
Пока врачи не могли использовать в терапии препараты цианокобаламина, B12-дефицитная анемия считалось фатальным заболеванием. В те времена ремиссию можно было получить с помощью эмпирического подбора рациона питания, трансфузионной терапии или спленэктомии, но после этого следовал очередные рецидивы, которые приводили к смерти пациента (как правило это происходило через 1-3 года с момента диагностирования патологии).
С целью профилактики развития B12-дефицитной анемии рацион питания должен содержать животный белок (печень, сердце, мясо, рыба, молочные продукты и др). Во время манифестации патологии нужно назначать цианокобаламин. Если у больного диагностированы глистные инвазии, дополнительно назначается противогельминтная терапия.
Сегодня для лечения B12-дефицитной анемии широко применяются два препарата: Цианокобаламин и Оксикобаламин. В нашей стране принято назначать Цианокобаламин: подкожно или внутримышечно 200-400 мкг 1 раз в день на протяжении 4-5 недель. В тяжелых случаях и при развитии фуникулярного миелоза суточная дозировка цианокобаламина повышают до 1000 мкг.
При условии назначения адекватного лечения явное улучшение состояния пациента и нормализацию картины костного мозга можно наблюдать уже на 3-4-е сутки лечения. Повышение уровня ретикулоцитов в периферической крови в среднем на 20-30% (ретикулоцитарный криз) развивается через 1-2 недели. Концентрация билирубина в крови возвращается в норму на протяжении 3-4 недель, лактатдегидрогеназы – через 7-14 дней.
При назначении цианокобаламина ремиссия наступает у всех больных B12-дефицитной анемией.
При отсутствии эффекта от терапии на протяжении нескольких недель, следует предполагать неверную трактовку генеза анемии. В этом случае пациенту необходимо провести дополнительную диагностику, чтобы уточнить причину анемического синдрома.
ФОЛИЕВО-ДЕФИЦИТНАЯ АНЕМИЯ
Эта патология относится к группе мегалобластных анемий. Дефицит фолиевой кислоты приводит к нарушению влияния цианокобаламина на процесс синтеза ДНК, что приводит к развитию мегалобластного типа кроветворения.
Дефицит витамина B9 может возникать из-за недостаточного поступления в организм фолиевой кислоты с пищей, патологий желудочно-кишечного тракта (нарушений усвоения фолиевой кислоты), а также при повышенной потребности организма в этом витамине.
Характерные жалобы пациентов с фолиево-дефицитной анемией – общая слабость и головокружения. Глоссит у таких больных, в отличие от больных B12-дефицитной анемией, развивается очень редко. Также при B9-дефицитной анемии не обнаруживаются признаки фуникулярного миелоза.
Как и при дефиците цианокобалавина, при дефиците фолиевой кислоты в периферической крови обнаруживается макроцитоз, повышается среднее содержание гемоглобина в эритроците и средний объем эритроцитов. В костном мозге появляются мегалобласты. Повышается уровень непрямого билирубина в крови, увеличивается активность лактатдегидрогеназы.
Дефицит фолиевой кислоты в организме приводит к повышению уровня гомоцистеина, что является фактором риска для образования венозных тромбов (из-за чрезмерного влияния гомоцистеина на эндотелий кровеносных сосудов). Гетерозиготное носительство мутации метилтетрагидрофолатредуктазы также является причиной высокого уровня гомоцистеина, однако риск образования тромбов при этом ниже.
Лечение фолиево-дефицитной анемии подразумевает применение препаратов фолиевой кислоты.
Источник

