Лекции по пропедевтике анемии
- Авторы
- Файлы
- Литература
Чеснокова Н.П.
1
Невважай Т.А.
1
Моррисон В.В.
1
Бизенкова М.Н.
1
1 ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского Минздрава России»
1. Абдулкадыров К.М. Гематология. – М.: ЭКСМО, СПб.: Сова, 2004. – 928 с.
2. Воробьев А.И. Городецкий В.М., Шулутко Е.М., Васильев С.А. Острая массивная кровопотеря. – М.: ГЭОТАР-МЕД, 2001. – 175 с.
3. Воробьев П.А. Анемический синдром в клинической практике. – М.:«Ньюдиамед», 2001. – 165 с.
4. Гематология /Рукавицын О.А., Павлов А.Д., Моршакова Е.Ф. [и др.] /под ред. О.А.Рукавицына. – СПб.: ООО «ДП», 2007. – 912 с.
5. Литвицкий П.Ф. Патофизиология: учебник. – 4-е изд. – М.:ГЭОТАР- Медиа, 2008. – 496 с.
6. Наглядная гематология / Перевод с англ. Под редакцией проф. В.И. Ершова. – 2-е изд. – М.: ГЭОТАР-Медиа, 2008. – 116 с.: ил.
7. Кардиология. Гематология / под ред. Н.А. Буна, Н.Р. Колледжа и др. – М.: ООО «Рид Элсивер», 2009. – 288 с.
8. Папаян А.В., Жукова Л.Ю. Анемии у детей: руководство для врачей. – СПб.: ПИТЕР. – 2001 год – 384 с.
9. Патофизиология: учебник: в 2 т./под ред. В.В. Новицкого, Е.Д. Гольдберга, О.И. Уразовой. – 4-е изд. – ГЭОТАР-Медиа, 2010. – Т.2. – 848 с.: ил.
10. Патофизиология: учебник, в 3 т.: [А.И. Воложин и др.]; под ред. А.И. Воложина, Г.В. Порядина. – М.: Издательский центр «Академия», 2006.- Т.2 – 256 с.: ил.
11. Патофизиология: курс лекций/ [Порядин Г. В. и др.]; под ред. Г. В. Порядина. – М. : ГЭОТАР-Медиа, 2012. – 592 с.
12. Руководство по гематологии. В 2 т. / Под ред. А.И. Воробьева. – М.: Ньюдиамед, 2002. – 280 с.
13. Руководство по гематологии /Под ред. А.И Воробьева. – М.: Ньюдиамед, 2007. – 1275 с.
14. Садчиков Д.В., Хоженко А.О., Черная А.В. Количественные и качественные изменения клеточных элементов системы крови при тяжелой постгеморрагической анемии (обзор). – Саратовский научнор-медицинский журнал, 2011. – Т.4. – №4. – С.809-813.
15. Третьякова О.С. Постгеморрагические анемии в педиатрической практике. – Здоровье Украины. – 2012. – №8. – С.37-44.
16. Шиффман Ф.Дж. Патофизиология крови. – М.: Изд-во БИНОМ, 2009. – 448 с.
Анемии – состояния, характеризующиеся уменьшением содержания гемоглобина в общем объеме крови, а также как правило, и в единице объема крови.
Анемии следует отличать от гидремии, при которой абсолютное содержание гемоглобина в общем объеме крови не изменяется.
В большинстве случаев патологии анемии характеризуются и эритропенией, в связи с чем анемия может проявляться одновременным уменьшением содержания в единице объема крови и гемоглобина, и эритроцитов.
Анемии в ряде случаев могут быть отнесены к самостоятельным нозологическим формам патологии, в других – являются лишь симптомом какого-то заболевания.
Касаясь механизмов развития и происхождения анемий, следует отметить, что они могут носить наследственный, врожденный характер, однако в большинстве случаев анемии являются вторичными, или приобретенными.
В зависимости от патогенеза выделяют три основные группы анемий:
1. Постгеморрагические (острые и хронические).
2. Гемолитические (врожденные и приобретенные).
3. Дизэритропоэтические, обусловленные нарушением костномозгового кроветворения.
В процессе установления патогенеза и проведения дифференциальной диагностики анемий используют нередко следующие показатели состояния периферической крови:
– цветовой показатель;
– размер и форму эритроцитов;
– наличие регенераторных форм.
В связи с этим принято различать следующие виды анемий:
1. Нормохромные (цветовой показатель 0,85-1,05).
2. Гиперхромные (цветовой показатель больше 1,05).
3. Гипохромные (цветовой показатель меньше 0,85).
Следует отметить, что в ряде случаев цветовой показатель дает возможность дать ориентировочную оценку происхождения анемии. Так, к числу гиперхромных анемий относятся В12-дефицитные, фолиеводефицитные анемии. Железодефицитные анемии, в частности постгеморрагические,- гипохромные. В то же время метапластические, гемолитические анемии могут носить нормохромный характер.
В зависимости от регенераторной активности костного мозга выделяют следующие виды анемий:
1. Гиперрегенераторные.
2. Регенераторные.
3. Гипорегенераторные.
4. Арегенераторные (гипо-, апластические анемии).
Для гиперрегенераторных анемий характерно наличие ретакулоцитарных кризов, когда содержание ретикулоцитов в периферической крови может достигать нескольких процентов. При этом отмечается появление в периферической крови эритрокариоцитов. К категории гиперрегенераторных анемий относят некоторые формы гемолитических анемий, к числу гипорегенераторных – В12-дефицитные, фолиеводефицитные, железодефицитные анемии.
При гипо- и арегенераторных формах анемий количество ретикулоцитов может быть сниженным или вообще не определяться в крови, одновременно возрастает уровень дегенеративных форм эритроцитов.
В зависимости от размеров эритроцитов выделяют следующие формы анемий:
1. Нормоцитарные (7,2-8,3мкм).
2. Микроцитарные (меньше 7,2 мкм).
3. Макроцитарные (9-12 мкм).
4. Мегалоцитарные (12-15 мкм).
Макроцитоз, мегалоцитоз отмечаются при В12-, фолиеводефицитных анемиях; микроцитоз – при врожденных гемолитических анемиях; нормоцитарные анемии могут быть различного происхождения.
В зависимости от характера кроветворения анемии делят на две группы:
1. С нормобластическим типом кроветворения, для которого характерна последовательность дифференцировки элементов эритроцитарного ряда, включающая следующие этапы: эритробласт – пронормоцит – базофильный нормоцит – полихроматофильный нормоцит – оксифильный нормоцит, ретикулоцит – эритроцит;
2. С мегалобластическим типом кроветворения, включающим следующие этапы дифференцировки: промегалобласт – базофильный мегалобласт – полихроматофильный мегалобласт – оксифильный мегалобласт – мегалоцит.
Использование приведенных выше классификаций анемий в клинической практике, безусловно, облегчит правильную постановку диагноза, а также даст возможность объективной оценки тяжести течения заболевания и его прогноза.
Постгеморрагические анемии. Различают острую и хроническую постгеморрагическую анемию.
Причины кровопотерь весьма разнообразны: травмы, оперативные вмешательства, поражение сосудистой стенки при язвенной болезни, опухолевом и туберкулезном процессе, метро- и меноррагии, спонтанные кровотечения или слегка индуцированные при врожденной или приобретенной недостаточности коагуляционного, тромбоцитарного звеньев системы гемостаза и т.д.
У новорожденных причинами кровопотерь могут быть родовая травма., трансплацентарная кровопотеря, кровотечение из сосудов пуповины, наследственные геморрагические диатезы, коагулопатии, тромбоцитопении. У девочек возможны ювенильные кровотечения. Чем младше ребенок, тем чувствительнее он к кровопотере.
Реакция взрослого человека на кровопотерю определяется двумя основными факторами: объемом и скоростью кровопотери.
Одномоментная кровопотеря у взрослого человека в объеме 10-15 % всей массы крови не вызывает обычно развития шокового синдрома и соответственно тяжелых нарушений гемодинамикн. Между тем быстрая потеря крови новорожденным в таком же объеме может привести к развитию шока.
Для оценки степени кровопотери рекомендуют использовать следующую формулу:
П = К+44 1g ШИ,
где П – кровопотеря, в %; К – коэффициент, равный 27 при желудочно-кишечной кровопотере; 33 – при полостных кровотечениях; 24 – при ранениях конечностей; 22 – при поражении грудной клетки; ШИ – шоковый индекс, равный отношению частоты пульса к систолическому давлению.
Касаясь значимости объема кровопотери, необходимо отметить, что выход из сосудистого русла до 20-25 % объема циркулирующей крови мало опасен и хорошо компенсируется за счет включения экстренных механизмов адаптации, при чем в случае потери до 500 мл крови, что составляет в среднем 10 % ОЦК, клинические проявления могут отсутствовать, иногда возникает умеренная тахикардия.
При кровопотере объемом от 500 до 1200 мл (10-20 % ОЦК) возникает прогрессирующая тахикардия, снижается артериальное давление, появляются признаки вазоконстрикции.
Потеря 25-35 % циркулирующей крови (1200-1800 мл) сопровождается выраженными расстройствами центральной, органно-тканевой и микрогемоциркуляцин. При этом отмечаются выраженная тахикардия (пульс свыше 120/мин), нарастающая гипотензия, потливость, бледность кожных покровов, беспокойство, слабость, олигурия.
При потере более 40 % объема циркулирующей крови возникает выраженная гипотензия, артериальное давление падает ниже 70 мм рт. ст., прогрессирующая тахикардия (пульс свыше 150/мин), бледность кожных покровов, холодный пот, беспокойство, слабость, олигурия.
Быстрая потеря 50 % крови от общего объема является, как правило, летальной. Потеря такого же объема крови в течение нескольких дней при маточном, желудочном, кишечном кровотечении, как правило, компенсируется при хорошей корригирующей терапии.
Следует отметить высокую чувствительность детского организма к потере крови. Уменьшение объема циркулирующей крови у ребенка на 15-20 % может привести к развитию шока с потерей сознания. У взрослого же человека уменьшение объема циркулирующей крови на 25 % может протекать в ряде случаев без выраженной гипотензии.
В развитии постгеморрагической анемии следует выделить три стадии: начальную, компенсаторную и терминальную. Причем, характер изменений со стороны периферической крови при постгеморрагической анемии определяется не только тяжестью кровопотери, но и стадией развития постгеморрагической анемии.
Начальная стадия характеризуется уменьшением объема циркулирующей крови – гиповолемией, при этом в единице объема крови не возникает существенных изменений содержания гемоглобина, количества эритроцитов. Однако снижение объема циркулирующей крови сопровождается уменьшением венозного возврата в сердце, снижением ударного и минутного объема крови, что приводит к развитию циркуляторной гипоксии. Таким образом, гемическая гипоксия при кровопотере всегда сочетается и с циркуляторной.
Возникновение гипоксии, гиповолемии, метаболического ацидоза инициирует развитие механизмов срочной адаптации. Одним из мобильных звеньев адаптации является активация симпатоадреналовой системы, что приводит к развитию комплекса защитно-приспособительных реакций. Во-первых, возникает рефлекторный спазм периферических сосудов, или рефлекторно-сосудистая компенсация постгеморрагической анемии, направленная на адаптацию емкости сосудистого русла к объему циркулирующей крови и предотвращение развития шокового синдрома. Однако даже при максимальном спазме сосудов емкость сосудистого русла может уменьшиться лишь на 15-20 %. Активация симпатоадреналовой системы в этот период анемии приводит к рефлекторному учащению сердечных сокращений.
Изучение гематологических показателей в период рефлекторно-сосудистой компенсации может выявить лишь незначительное снижение уровня гемоглобина и эритроцитов, отсутствие выраженных изменений гематокрита.
В условиях гипоксии, гиповолемии активируется ренин-ангиотензиновая система, усиливается освобождение минералокортикоидов, что приводит к усилению реабсорбции натрия в почечных канальцах, повышению осмотического давления в плазме крови, стимуляции выброса антидиуретического гормона и усилению факультативной реабсорбции воды в дистальных почечных канальцах. Жидкость поступает в кровеносные капилляры по градиенту осмотического давления. Развивается так называемая гидремическая компенсация спустя 1-3 суток после кровопотери. для этого периода характерно уменьшение количества эритроцитов и гемоглобина в единице объема крови и во всем объеме крови. Анемия носит нормохромный характер.
Возникновение гипоксии при постгеморрагической анемии стимулирует продукцию эритропоэтина. по физико-химическим свойствам эритропоэтин представляет собой кислый термостабильный гликопротеин. Мономерная форма белка эритропоэтина имеет ММ от 23000 Д до 32000 Д. Однако в натуральном виде гормон представляет собой димер с ММ от 46000 Д до 60000 Д; содержание белка в нем составляет около 65,5 °/о; углеводов – около 30 %. Считают, что эритропоэтин образуется в различных клетках нефрона, а также в печени и селезенке.
Существует точка зрения, что эритропоэтин почечного происхождения неактивен, его именуют эритрогенином. В процессе взаимодействия почечного эритрогенина со специализированными белками плазмы крови α2-глобулиновой фракции, вырабатываемыми в печени, образуется активная форма эритропоэтина.
Под влиянием эритропоэтина эритропоэтинчувствительные клетки дифференцируются в эритробласты и далее – до зрелых эритроцитов, которые выходят в сосудистое русло и компенсируют утраченные при кровопотере клетки. Возникает период костномозговой компенсации, выраженный обычно уже спустя 45 дней после кровопотери. При этом в периферической крови появляются молодые, недонасыщенные гемоглобином формы эритроцитов – ретикулоциты, оксифильные, полихроматофильные, базофильные нормоциты, т. е. клетки, характеризующие регенераторную активность костного мозга. Анемия приобретает гипохромный характер. Одновременно в периферическую кровь из костного мозга поступают и другие клеточные элементы. Признаком достаточно выраженной регенераторной способности костного мозга является возникновение нейтрофильного лейкоцитоза со сдвигом влево.
Стимуляторами костномозговой компенсации после кровопотери являются и такие гормоны адаптации, как катехоламины, глюкокортикоиды. Однако их стимулирующий эффект на кроветворение опосредуется, по-видимому, за счет первичной активации синтеза под влиянием этих гормонов эритропоэтина.
Параллельно с костномозговой компенсацией развертывается белковая компенсация за счет активации синтеза в печени различных плазменных белков, в частности, плазменных белковых факторов свертывания крови. Следует отметить, что активация протеосинтеза наблюдается уже через несколько часов после кровотечения и регистрируется в течение последующих 1,5-3 недель и более в зависимости от объема кровопотери и состояния реактивности организма.
Вышеописанная стадийность развития свойственна острым постгеморрагическим анемиям. Все постгеморрагические анемии – острые и хронические – являются железодефицитными, поэтому характеризуются комплексом метаболических и функциональных расстройств, обусловленных недостаточностью железа.
Библиографическая ссылка
Чеснокова Н.П., Невважай Т.А., Моррисон В.В., Бизенкова М.Н. ЛЕКЦИЯ 2. АНЕМИИ: КЛАССИФИКАЦИЯ, ОБЩАЯ ХАРАКТЕРИСТИКА ГЕМАТОЛОГИЧЕСКИХ СДВИГОВ. ПОСТГЕМОРРАГИЧЕСКИЕ АНЕМИИ // Международный журнал прикладных и фундаментальных исследований. – 2015. – № 6-1. – С. 152-155;
URL: https://applied-research.ru/ru/article/view?id=6864 (дата обращения: 04.05.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Пропедевтика внутренних болезней

Анемия n 1. 1. Определение n 1. 2. Классификация n 1. 3. Основные представители анемий: причины и механизмы развития, клиника, диагностика Ø 1. 3. 1. Железодефицитная анемия Ø 1. 3. 2. Витамин. В 12 дефицитная анемия Ø 1. 3. 3. Гемолитическая анемия

АНЕМИЯ Состояние, характеризующееся снижением уровня гемоглобина и уменьшения количества эритроцитов

Классификация анемий (этиопатогенетическая) I. Анемии вследствие кровопотери (постгеморрагические): nострые nхронические

Классификация анемий (этиопатогенетическая) II. Анемии вследствие нарушения кровообразования: 1. Дефицитные анемии: n Железодефицитные, витаминодефицитные n Апластические n Метапластические

Классификация анемий (этиопатогенетическая) III. Анемии, вследствие повышенного кроворазрушения (гемолитические): n 1. Наследственные: n мембранопатии n ферментопатии n гемоглобинопатии n 2. Приобретенные

Классификация анемий Оценка состояния костномозгового кроветворения n Регенераторные n Гипорегенераторные n Арегенераторные

Классификация анемий Оценка цветового показателя: § Нормохромная § Гиперхромная

Классификация анемий По степени тяжести n 1. Легкая – Нв 109 -90 гл n 2. Средняя – Нв 89 -70 гл n 3. Тяжелая – Нв

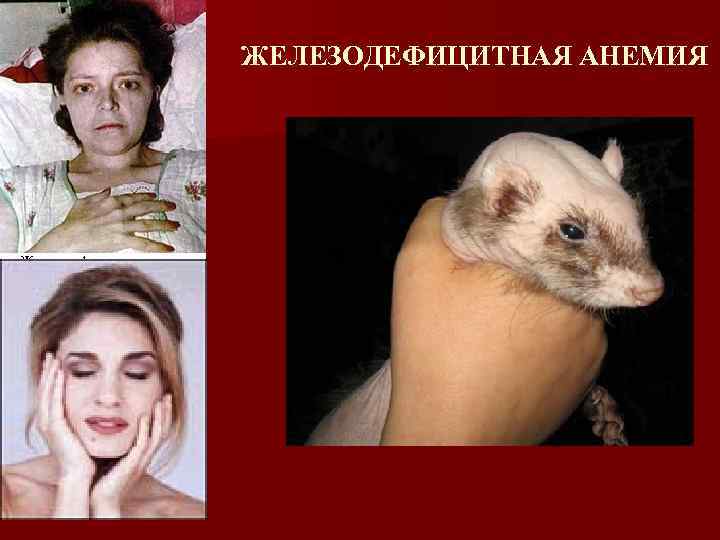
Железодефицитная анемия Заболевание, при котором вследствие дефицита железа в организме, происходит нарушение синтеза гемоглобина и трофические изменения в тканях

Железодефицитная анемия (история вопроса) n 1554 год – первое описание ЖДА Lange n 1660 год – в лечение используется железо

Эпидемиология железодефицитной анемии n 3, 6 млрд. человек — имеет дефицит железа n 1, 6 млрд. человек – железодефицитная анемия — данные ВОЗ (1998 г. ) n В России 480 тыс больных анемией, 432 тыс — ЖДА ( 2001 г) Женщины болеют в 6 раз чаще , чем мужчины, 30% женщин детородного возраста, 50% детей первого года жизни

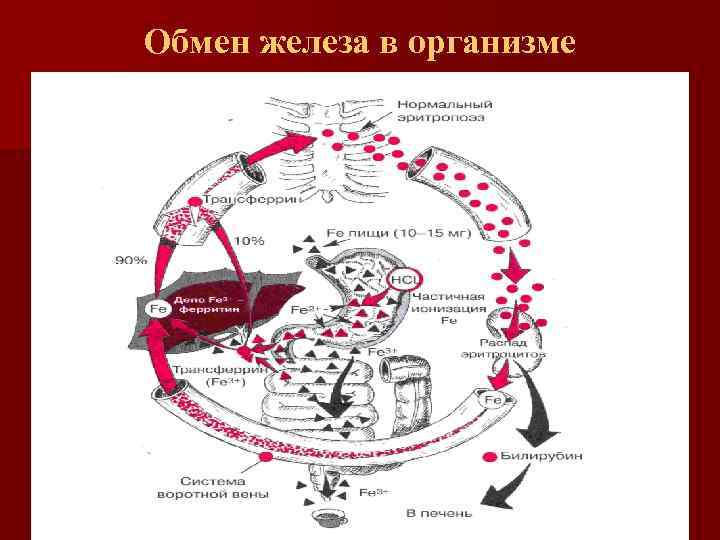
Обмен железа в организме человека n Общее содержание железа в организме взрослого здорового человека 3 -5 г ( у женщин от 2, 5 г, до 3, 5 г – у мужчин) n Суточная потребность в железе у женщин 15 мг, у мужчин 10 мг. n Всасывается 1 -1, 5 мг, выделяется 1 -1, 5 мг с калом, мочой, потом, слущенным эпителием кожи ( потери железа – пассивный процесс).

Железо (фонды) n Железо эритрона — 2000 мг (67%) n Запасное железо – 1000 мг(27%) n Тканевое железо – 220 мг (5, 9%) n Транспортное железо – 4 мг (0, 1%)
Обмен железа в организме

Железо (фонды) n Фонд эритрона – железо циркулирующих эритроцитов и красных клеток костного мозга n Запасной фонд – ферритин, гемосидерин n Транспортный фонд – железо плазмы n Тканевой (клеточный) фонд — железо миоглобина, железосодержащих ферментов, неферментное железо клетки (участвующие в окислительно-восстановительных процессах, тканевом дыхании)

Обмен железа в организме n n n 1. 2. 3. Обмен железа регулируется контролируемой абсорбцией Абсорбция железа происходит в проксимальных отделах тонкой кишки и преимущественно в 12 перстной кишке 3 регулятора абсорбции железа в ЖКТ: Алиментарный регулятор (количество железа, поступающего с пищей, его форма, факторы пищи, влияющие на этот процесс) Депо-регулятор Эритроидный регулятор (реагирует на дисбаланс между скоростью эритропоэза в костном мозге и снабжением этого процеса железом)

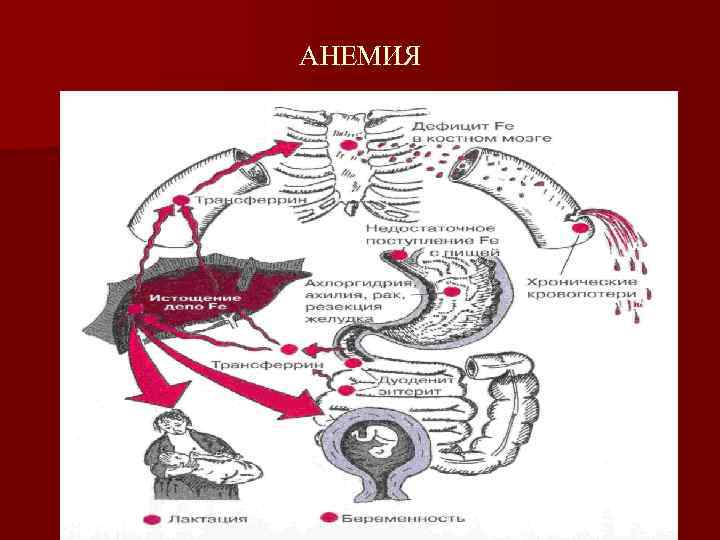
Причины железодефицитных состояний n Особые периоды в жизни и специфические состояния — анемия развивается в результате повышенной потребности в железе вследствие возрастания его утилизации n Различные патологические состояния n Неблагоприятные воздействия
АНЕМИЯ

Различные патологические состояния n Кровопотери n Нарушение всасывания и утилизации железа вследствие заболевания ЖКТ и печени n Тяжелые и длительные заболевания n Гормональные дисфункции

Железодефицитная анемия (причины развития) Хронические кровопотери n Менструальные кровопотери n Патология органов пищеварения n Патология ЛОР- органов, мочевовыводящих путей
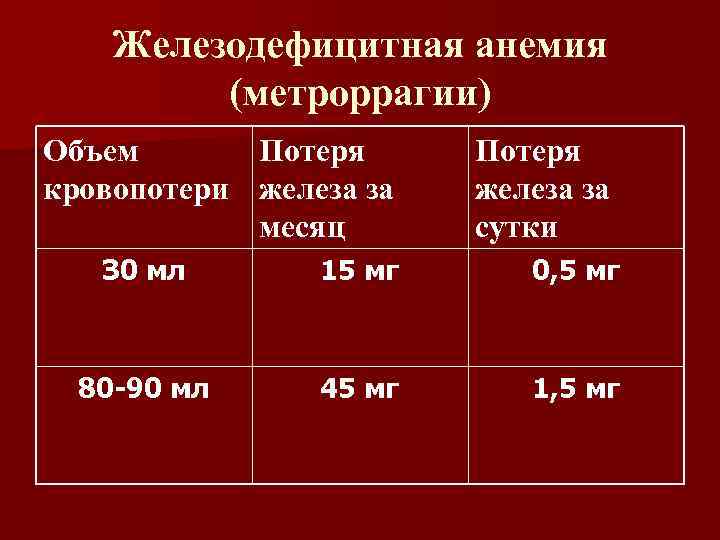
Железодефицитная анемия (метроррагии) Объем Потеря кровопотери железа за месяц Потеря железа за сутки З 0 мл 15 мг 0, 5 мг 80 -90 мл 45 мг 1, 5 мг

Железодефицитная анемия n Гиперполименоррея — Менструации, продолжающиеся более 5 дней, при цикле менее 26 дней, при наличии выделения крови со сгустками более суток Риск развития анемии — при потере 40 -60 мл крови ежемесячно !

Особые периоды жизни и специфические состояния n Интенсивный рост ( 1 год жизни, пубертатный период) n Беременность n Лактация Анемия развивается в результате повышенной потребности в железе вследствие возрастания его утилизации

Железодефицитная анемия (причины развития) n Повышение потребности в железе 1. Беременность, лактация Дополнительные потребности 7001000 мг железа (железо для плаценты, плода, собственные нужды, для увеличивающегося количества эритроцитов) 2. Усиленный рост

Неблагоприятные воздействия n Плохое питание – недостаточное питание иили пища обедненная железом n Хроническая алкогольная интоксикация n Избыточные физические нагрузки

Этапы развития железодефицитной анемии 1 этап — Прелатентный дефицит железа (запасной фонд) n Потери железа превышают его поступление, компенсаторно увеличивается его всасывание в кишечнике, истощение запасов без падения сывороточного железа и гемоглобина

Этапы развития железодефицитной анемии 2 стадия — Латентный дефицит железа n Истощение запасов железа со снижением уровня сывороточного железа без изменения концентрации гемоглобина (транспортный, клеточный фонды)

Этапы развития железодефицитной анемии 3 стадия – Анемия n А. Легкой степени (компенсированная) – без гипохромии и микроцитоза n В. Выраженная ( субкомпенсированная) – с микроцитозом, а позднее и гипохромией n С. Тяжелая (декомпенсированная) с симптомами тканевых нарушений

Железодефицитная анемия (клинические проявления) Общеанемический синдром (гипосические изменения в тканях и органах возникающие в результате снижения количества Нв в организме) n Слабость n Одышка при физических нагрузках n Головные боли, головокружение

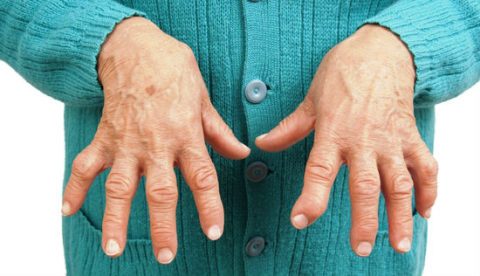
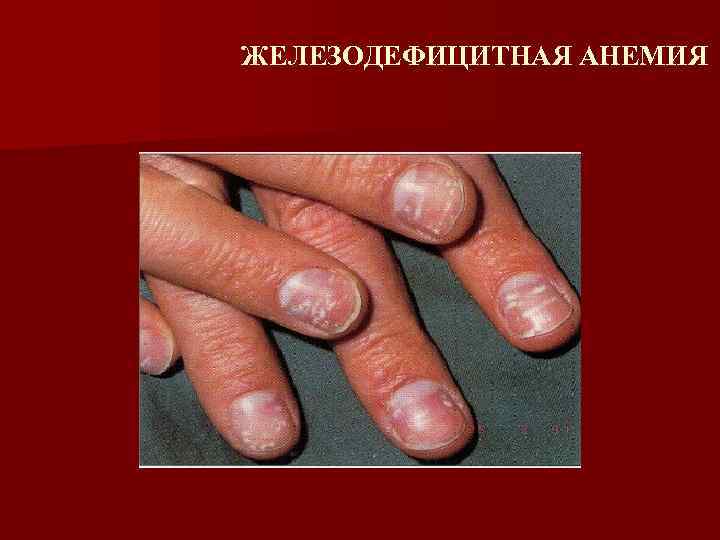
Железодефицитная анемия (клинические проявления) Сидеропенический синдром ( снижение активности железосодержащих ферментов, участвующих в тканевом дыхании клетки) – описан Базенстромом (1930) n n n Изменения кожи, волос, ногтей, зубов, СО ЖКТ и печень : дисфагия, изменения стула, атрофический гастродуоденит, энтерит, нарушение функции печени Поражение мышечной системы (миастения) Нервная система (слабость, утомляемость, сонливость, извращения вкуса и обоняния, анорексия, субфебрилитет) Мочевыделительная система (дизурия) Эндокринная и половая системы (задержка роста, дисменоррея, эректильная дисфункция)

АНЕМИЯ
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ

ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ

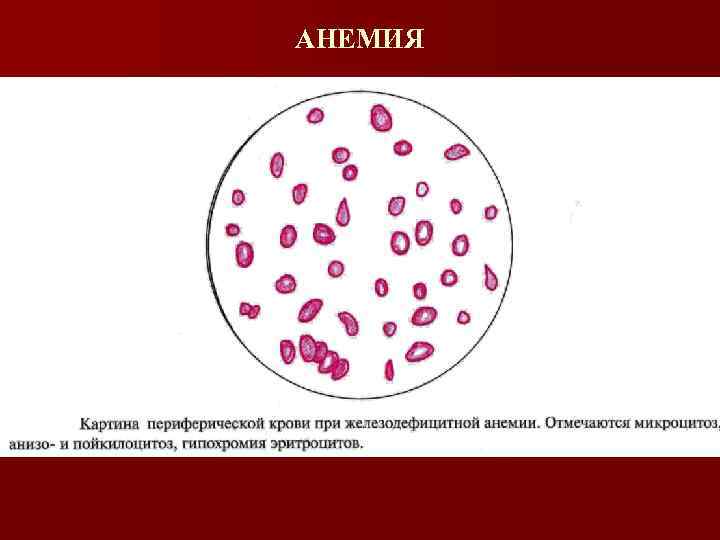
Железодефицитная анемия (диагностика) Общий анализ крови n Снижение гемоглобина n Снижение эритроцитов n Цветовой показатель снижен (0, 6 -0, 7) n Микроцитоз n Анизоцитоз n Пойкилоцитоз n Количество лейкоцитов, тромбоцитов не изменено
АНЕМИЯ

Витамин В 12 -дефицитная анемия История вопроса n n 1849 год – первое описание Адиссоном и 1872 – Бирмером 20 -е годы ХХ века – Виппл – экспериментальные работы с использованием экстрактов различных органов в виде способа лечения анемии 1929 – Кастл – открытие внутреннего фактора 1948 – открытие внешнего фактора
АНЕМИЯ

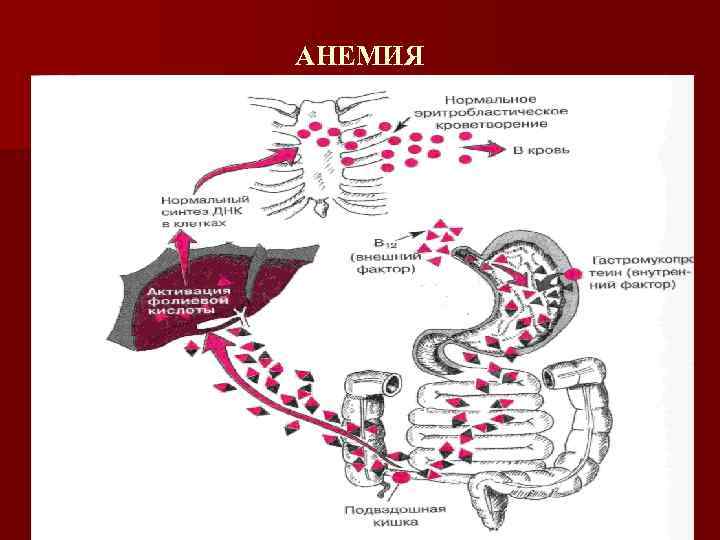
Витамин В 12 -дефицитная анемия Основные причины развития n Нарушение всасывания: поражение желудка, поджелудочной железы, кишечника n Конкурентное поглощение витамина В 12 n Нарушение поступления витамина В 12 с пищей

Витамин В 12 -дефицитная анемия n Метилкобаламин (участвует в синтезе ДНК, катализируя переход фолиевой кислоты в активную форму, которые в свою очередь, способствуют образованию уридинмонофосфата тимидина, участвующего в синтезе ДНК) Нарушение образования ДНК — клетки утрачивают способность к делению, минуют митоз, дифференцируются, созревают, оставаясь крупными (мегалобластный тип кроветворения)

Витамин В 12 -дефицитная анемия n Дезоксиаденозилкобаламин — участвует в синтезе (нарушение образования миелина и повреждение аксонов) и распаде( образование токсичных для нервной системы пропионовой и метилмалоновой кислоты, проводящих к поражению задних и боковых столбов спинного мозга) жирных кислот.
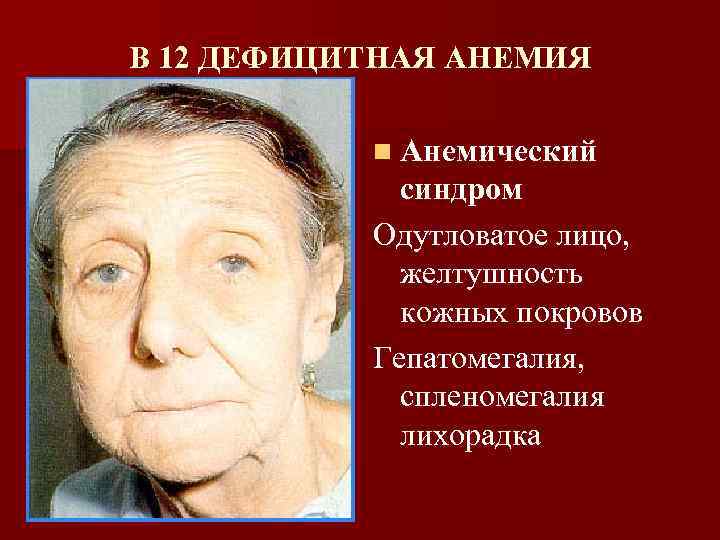
В 12 ДЕФИЦИТНАЯ АНЕМИЯ n Анемический синдром Одутловатое лицо, желтушность кожных покровов Гепатомегалия, спленомегалия лихорадка
В 12 ДЕФИЦИТНАЯ АНЕМИЯ

В 12 ДЕФИЦИТНАЯ АНЕМИЯ

Витамин В 12 -дефицитная анемия (клиническая картина) Анемический синдром Желтуха, одутловатое лицо, гепатомегалия, спленомегалия (внутрикостномозговой гемолиз клеток красного ряда) Поражение желудочно-кишечного тракта n Глоссит n Атрофический гастрит Поражение нервной системы (Фуникулярный миелоз) n Мышечная атрофия, потеря проприоцептивной чувствительности
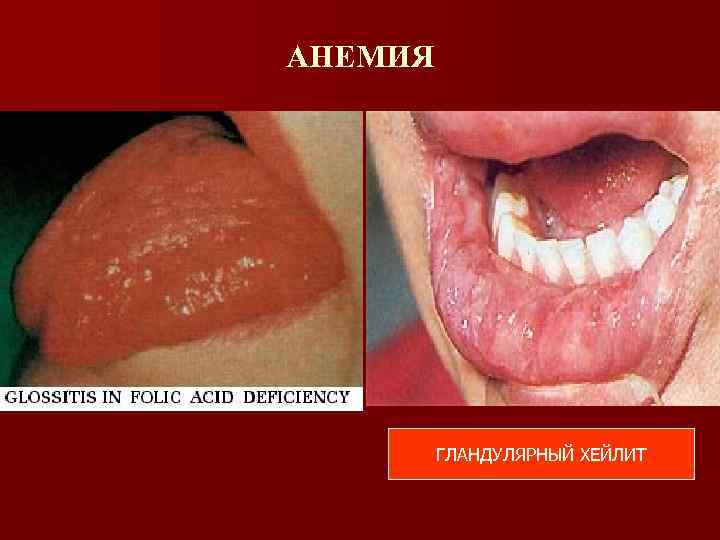
АНЕМИЯ ГЛАНДУЛЯРНЫЙ ХЕЙЛИТ
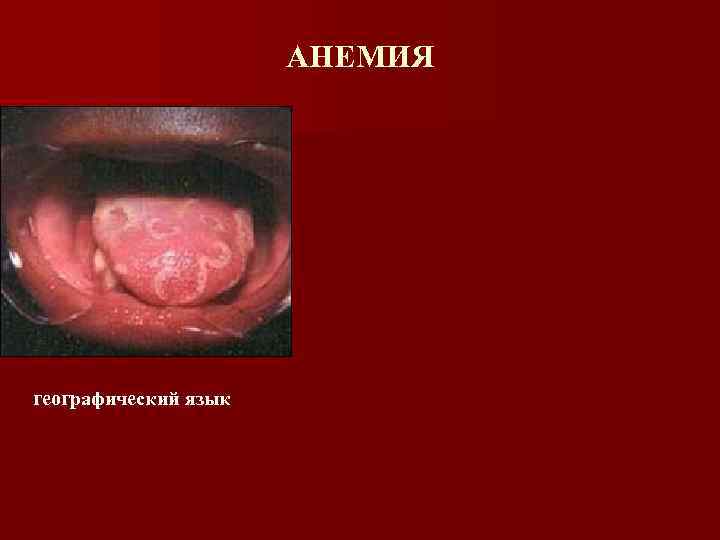
АНЕМИЯ географический язык

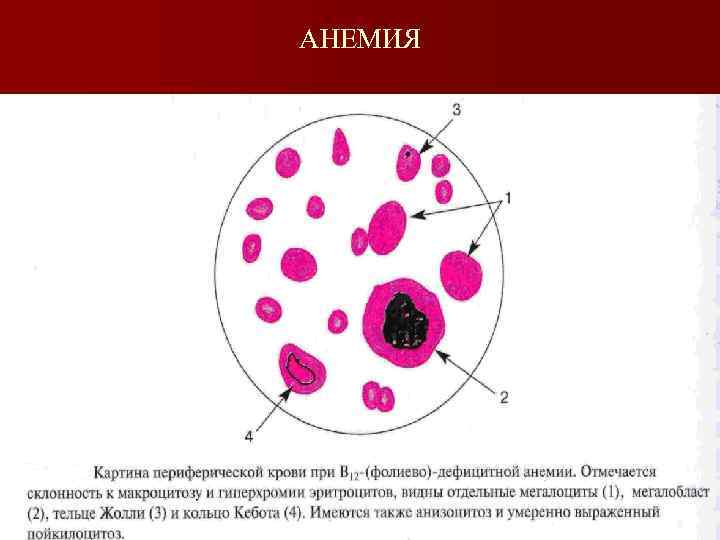
Витамин В 12 -дефицитная анемия Диагностика n Общий анализ крови n Анемия n Тромбоцитопения n Лейкопения n Цветовой показатель больше 1
АНЕМИЯ