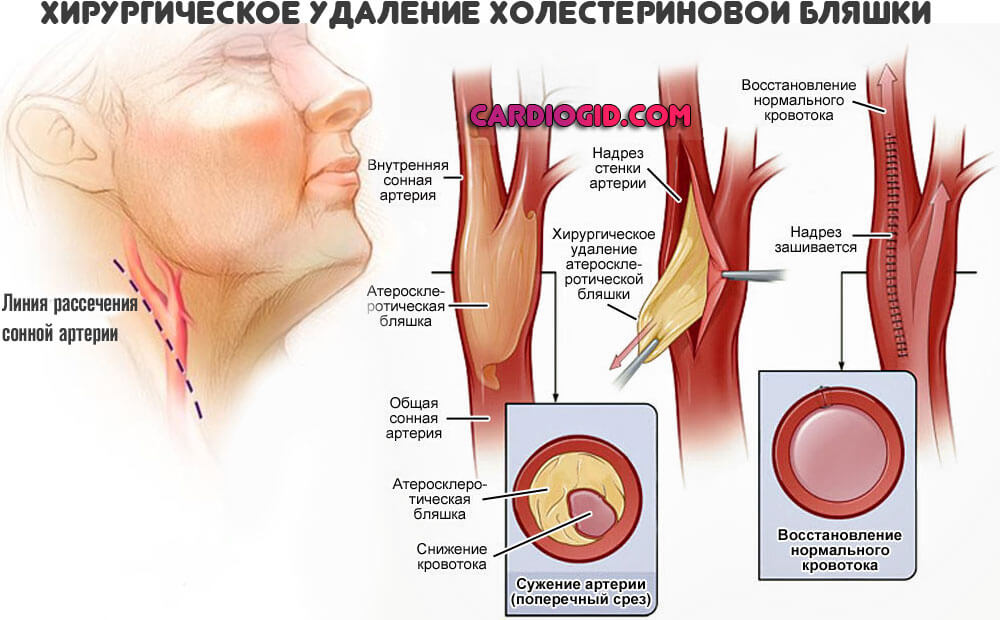
Лабораторная диагностика инфаркта атеросклероза
1.
Общий анализ крови –
без изменений.
2. Биохимический
анализ крови:
увеличение
уровня холестерина, триглицеридов,
холестерина
ЛПНП;
снижение
холестерина ЛПВП;увеличение
коэффициента атерогенности (КА): КА =
общий холестерин – холестерин
ЛПВП/холестерин ЛПВП. Норма 3-3,5.
Инструментальная диагностика атеросклероза
Нарушения кровотока
в артериях, утолщение и неровность
стенок, уменьшение величины просвета
артерий выявляются следующими методами.
1. Рентгенконтрастная
ангиография.
2.
Эхоангиография
— ультразвуковое сканирование применяется
для исследования сонных и вертебральных
артерии.
3. Магнитно-резонансная
ангиография.
Определение
ишемической болезни сердца (ИБС).
Ишемическая
болезнь сердца (ИБС)– острое или
хроническое поражение сердца, вызванное
уменьшением или прекращением доставки
крови к миокарду в связи с атеросклеротическим
процессом в коронарных артериях,что
нарушает равновесие между
коронарным кровотоком и потребностями
миокарда в кислороде.
Причины и
факторы риска развития ИБС.
Причиной
развития ИБС является атеросклероз
коронарных артерий, причем не только
у пожилых людей, но и у лиц более молодого
возраста (до 40 лет). Атеросклеротический
процесс чаще всего поражает переднюю
нисходящую (межжелудочковую) ветвь
левой коронарной артерии, затем огибающую
ветвь левой коронарной артерии и правую
коронарную артерию. К сожалению, по мере
прогрессирования атеросклероз поражает
две и более ветвей коронарных артерий,
причем наиболее характерно повреждение
преимущественно верхних проксимальных
отделов. По данным Strong,
атеросклеротические поражений чаще
всего располагаются на расстоянии
первых 6 см от устья коронарных артерий.
Причиной
клинической картины ИБС (стенокардии)
является стенозирующий коронарный
атеросклероз с сужением просвета
коронарной артерии на 75% и более. Основной
причиной инфаркта миокарда является
атеросклероз
коронарных артерий,
повреждение
атеросклеротической бляшки
с развитием тромбоза
артерий.
В патогенезе
ишемической болезни сердца лежит остро
возникшее или хроническое несоответствие
между потребностями миокарда в кислороде
и возможностями коронарного кровотока
обеспечить эти потребности.
Факторы,
увеличивающие потребность миокарда в
кислороде
и, следовательно, способствующие
клиническому
проявлению ИБС:
физическая нагрузка, курение,
злоупотребление алкоголем, обильный
прием пищи (переедание с употреблением
пищи, богатой жирами и углеводами),
стрессовая ситуация.
Концепция
факторов риска развития ИБС
(атеросклероза), разработанная американским
кардиологическим колледжем в 1996 г.,
содержит 4 категории факторов риска.
1 категория –
факторы, устранение которых достоверно
уменьшает риск развитие ИБС:
— курение;
—
гиперхолестеринемия, гипер-бета-липопротеинемия
(повышение содержания ХС ЛПНП);
— артериальная
гипертензия.
2 категория –
факторы, коррекция которых с большой
вероятностью снижает риск развитие
ИБС:
— сахарный диабет;
—
гипо-альфа-холестеринемия (снижение
содержания ХС ЛПВП), гипертриглицеридемия;
— малоподвижный
образ жизни (гиподинамия);
— избыточная масса
тела (ожирение);
— менопауза и
постменопаузальный период.
3 категория –
факторы, коррекция (модификация) которых
с меньшей вероятностью снижает риск
развитие ИБС:
— употребление
алкоголя;
—
психоэмоциональный стресс, тип личности
А (стресс-коронарный профиль);
—
питание с избыточной калорийностью и
высоким содержанием животных жиров;
— высокое содержание
в крови липопротеина А;
— гипергомоцистеинемия.
4
категория – факторы, которые не могут
быть модифицированы (корригированы:
— пожилой возраст;
— мужской пол;
—
семейный анамнез раннего развития ИБС:
наличие у
кровных родственников мужского пола
инфаркта миокарда в возрасте до 55 лет
и у лиц женского пола в возрасте до
60лет.
Сочетание нескольких
факторов увеличивает вероятность
развития ИБС в значительно большей
степени, чем наличие одного фактора.
Факторы,
способствующие надрыву и разрыву
атеросклеротической бляшки:
— накопление в
бляшке ЛПНП и их окисление;
— значительное
давление тока крови на края бляшки;
— курение;
— выраженное
повышение артериального давления;
— интенсивная
физическая нагрузка.
Поражение
коронарной артерии и развитие ишемии
миокарда может быть обусловлено не
только атеросклеротическим процессом.
Ишемию миокарда могут вызывать следующие
неатеросклеротические поражения
коронарных артерий:
врожденные
аномалии коронарных артерий (отхождение
огибающей артерии от правого
коронарного синуса или правой коронарной
артерии; отхождение правой коронарной
артерии от левого коронарного синуса
или левой коронарной артерии от правого
коронарного синуса);расслаивание
коронарной артерии (спонтанное или
вследствие расслаивания аневризмы
аорты, иногда при баллонной коронарной
ангиопластике);воспалительные
поражения коронарных артерий (при
узелковом панартериите и других
системных васкулитах, реже — при острой
ревматической лихорадке);сифилитический
аортит (воспалительный процесс
распространяется на восходящую аорту,
аортальный клапан и коронарные артерии);синдром
Гурлер (врожденное нарушение обмена
мукополисахаридов, наследуемое по
аутосомно-рецессивному типу; в связи
с недостаточной активностью
лизосомальных ферментов происходит
накопление гликозаминогликанов в
органах и тканях, развитие ранних
ишемических изменений миокарда, а также
застойной сердечной недостаточности
и клапанных пороков — недостаточности
митрального и аортального клапанов);лучевой
фиброз коронарных артерий (развивается
после облучение средостения, например
при лимфогранулематозе, при этом чаще
поражается проксимальный сегмент
передней нисходящей артерии, так как
она находится на передней поверхности
сердца);эластическая
псевдоксантома (наследственное
заболевание, при котором наблюдаются
фрагментация и кальциноз соединительной
ткани, и развивается прогрессирующее
сужение коронарных артерий);эмболия коронарной
артерии (чаще всего при инфекционном
эндокардите, мерцательной аритмии,
реже при ревматических пороках
сердца и коронарной ангиопластике).
Ишемия
миокарда, вызванная вышеуказанными
причинами, не
трактуется как ишемическая болезнь
сердца, а
расценивается лишь как проявление
основного заболевания (не атеросклероза),
приведшего к поражению коронарных
артерий и может быть обозначена, как
синдром коронарной недостаточности.
Классификация
ИБС.
Современная
классификация ИБС (I20-I25):
1.
Внезапная коронарная смерть.
2. Стенокардия:
2.1.
Стенокардия напряжения:
впервые
возникшая (de
novo);стабильная
с указанием функционального класса
(от I
до IV);прогрессирующая
стенокардия напряжения.
2.2.
Спонтанная (вазоспастическая) стенокардия.
3.
Инфаркт миокарда.
3.1.
С зубцом Q
(крупноочаговый, трансмуральный).
3.2.
Без зубца Q
(мелкоочаговый, интрамуральный,
субэндокардиальный).
4.
Кардиосклероз постинфарктный.
5.
Недостаточность кровообращения
(ишемическая кардиопатия).
6.
Нарушения сердечного ритма.
7. Безболевая
(«немая») ишемия
8.
Микроваскулярная (дистальная) ИБС.
9.
Новые ишемические синдромы («оглушение»
миокарда, «гибернация» миокарда,
ишемическое прекондиционирование).
Соседние файлы в папке Занятия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Комплексное исследование для определения риска атеросклероза.
Синонимы русские
Лабораторные и генетические маркеры атеросклероза; анализы крови для оценки риска ИБС.
Синонимы английские
Laboratory and genetic risk factors for atherosclerosis; CAD risk assessment; Atherosclerosis Lab Panel.
Какой биоматериал можно использовать для исследования?
Буккальный (щечный) эпителий, венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Для оценки риска атеросклероза и его клинических проявлений (инфаркта миокарда и других форм ишемической болезни сердца, инсульта, заболеваний периферических сосудов) используют несколько факторов. К так называемым традиционным факторам риска относятся возраст, отягощенный по ранней ИБС семейный анамнез, артериальная гипертензия, курение, сахарный диабет, ожирение, недостаточная физическая активность, стресс и повышение уровня холестерина крови (дислипидемия). В настоящий момент именно традиционные факторы включены в большинство калькуляторов для расчета риска ИБС. С другой стороны, появляются данные о том, что новые факторы могут иметь большее прогностическое значение. К таким новым, нетрадиционным, факторам относятся С-реактивный белок (СРБ), аполипопротеины А1 (апоА1) и B-100 (апоВ) и определенные полиморфизмы генов эндотелиальной синтазы и факторов свертывания крови V и II. Комплексное определение традиционных и новых факторов риска позволяет получить наиболее точную информацию об индивидуальной предрасположенности пациента к заболеваниям сердечно-сосудистой системы.
Развернутая лабораторная диагностика атеросклероза включает в себя:
1. Развернутая липидограмма.
Холестерол общий. Это холестерол всех липопротеинов крови, в том числе липопротеинов низкой, высокой, промежуточной и очень низкой плотности, а также холестерол, входящий в состав липопротеина (а). Это интегральный показатель обмена холестерола липопротеинами крови. Высокий уровень общего холестерола (более 240 мг/дл) – один из самых значимых факторов риска сердечно-сосудистых заболеваний. Концентрация общего холестерола не должна превышать 200 мг/дл.
Холестерол – липопротеины низкой плотности (ЛПНП). Это основные переносчики холестерола в крови. Из всего многообразия атерогенных липидных частиц именно ХС-ЛПНП имеет наибольшее значение в формировании коронарного риска. Оптимальная концентрация ХС-ЛПНП зависит от нескольких факторов, в том числе наличия ИБС, атеросклероза сосудов головного мозга и сахарного диабета, и различается в каждой конкретной ситуации. В общем случае желаемой считается концентрация ХС-ЛПНП менее 100 мг/дл.
Аполипопротеин B (апо B) – это основной белковый компонент атерогенных липопротеинов ЛПНП, ЛППП и ЛПОНП. Апо В необходим для связывания ЛПНП с его рецептором и, таким образом, обеспечивает транспорт холестерола в периферические ткани. Так как каждая их этих липопротеиновых частиц содержит только по одной молекуле апо В, то общая концентрация апо В в плазме крови отражает общее число атерогенных липопротеиновых частиц. Показано, что концентрация апо В может иметь большее прогностическое значение в отношении сердечно-сосудистых заболеваний, чем ХС-ЛПНП. Измерение апо В особенно важно при наличии гипертриглицеридемии (например, при метаболическом синдроме, сахарном диабете, заболеваниях печени и почек). Это связано с тем, что показатель ХС-ЛПНП получается не при прямом исследовании, а при расчете на основании концентрации триглицеридов, ХС-ЛПВП и общего холестерола и поэтому зависит от этих показателей. У пациентов с гипертриглицеридемией расчетный уровень ХС-ЛПНП не соответствует реальным значениям, что затрудняет его применение в качестве прогностического фактора. В отличие от ХС-ЛПНП, уровень апо В не зависит от концентрации триглицеридов.
Холестерол – липопротеины высокой плотности (ЛПВП). Обладают многими функциями, препятствующими развитию атеросклероза, в том числе обеспечивают обратный транспорт холестерола из периферических тканей в печень, препятствуют воспалению, окислению ЛПНП и образованию тромбов в сосудах. Считается, что высокий уровень холестерола ЛПВП снижает риск сердечно-сосудистых заболеваний. Показано, что повышение уровня холестерина ЛПВП на каждые 10 мг/л снижает риск сердечно-сосудистых заболеваний на 2-3 %.
Аполипопротеин А1 (апо А1) – это основной белковый компонент ЛПВП. Он необходим для осуществления обратного транспорта холестерина из периферических тканей. Концентрация апо А1 хорошо соотносится с концентрацией ХС-ЛПВП. Показано, что низкий уровень апоА1 может иметь большее прогностическое значение в отношении сердечно-сосудистых заболеваний, чем низкий уровень ХС-ЛПВП.
Триглицериды – эфиры органического спирта глицерола и жирных кислот, в форме которых энергия пищи запасается в жировой ткани и печени и транспортируется в клетки по мере необходимости. Основными переносчиками триглицеридов в крови являются хиломикроны и ЛПОНП. Повышение концентрации триглицеридов также является фактором риска сердечно-сосудистых заболеваний, однако не таким значительным, как повышение уровня холестерола. Оптимальным считается уровень триглицеридов менее 150 мг/дл.
2. С-реактивный белок.
С-реактивный белок (СРБ) – один из белков острой фазы воспаления, синтезируемый в печени. Концентрация СРБ отражает степень системного воспаления. Так, при острой инфекции или другом остром воспалении уровень СРБ обычно превышает 10 мг/л. Атеросклероз – это тоже воспалительный процесс, интенсивность которого, однако, гораздо меньше. Хроническое, вялотекущее воспаление в сосудистой стенке также приводит к повышению СРБ, но это повышение менее значительное (менее 3 мг/л). С помощью новых, более точных, методик удается определить такую низкую концентрацию СРБ. В недавних исследованиях показано, что повышенный уровень СРБ является фактором риска сердечно-сосудистых заболеваний. Учет этого клинико-лабораторного маркера особенно полезен у пациентов с промежуточным риском, рассчитанным на основании традиционных факторов риска. Показано, что при учете уровня СРБ 11 % мужчин из группы промежуточного риска могут быть переквалифицированы в группу высокого риска, а 12 % — в группу низкого риска.
3. Определение полиморфизма гена эндотелиальной синтазы
Синтаза оксида азота (NO-синтаза) – это фермент, катализирующий образование оксида азота NO из L-аргинина. В сосудистой стенке находится одна из изоформ фермента, называемая эндотелиальной синтазой (eNOS, NOS3). Оксид азота, образующийся благодаря NOS3, оказывает разностороннее воздействие на сосудистую стенку, в том числе обеспечивает расширение сосудов. Снижение нормальной функции NOS3 приводит к нарушению механизма вазодилатации и, возможно, таким образом участвует в патогенезе атеросклероза и сердечно-сосудистых заболеваний.
Снижение нормальной функции NOS3 может быть обусловлено внешними факторами (например, курение сигарет) или иметь генетическую основу. Показано, что определенные полиморфизмы гена NOS3 ассоциированы с повышенным риском сердечно-сосудистых заболеваний. Наибольшее клиническое значение имеют следующие полиморфизмы:
- NOS3G894T. Замена азотистого основания гуанина на тимин в позиции 894 кодирующей области гена приводит к замене остатка глутаминовой кислоты на аспарагиновую в положении 298 белковой последовательности эндотелиальной синтазы. Это сопровождается снижением активности фермента и в итоге снижением уровня оксида азота. Показано, что носительство аллеля T (гомозиготы T/T и гетерозиготы G/T) ассоциировано с повышенным риском артериальной гипертензии, ишемического инсульта, раннего инфаркта миокарда и других форм ИБС.
- NOS3T(-786)C. Замена азотистого основания тимина на цитозин в позиции -786 регуляторной области гена не влияет на белковую последовательность фермента, но значительно снижает уровень экспрессии гена и, как следствие, концентрацию фермента и оксида азота. Носительство аллеля C (гомозиготы С/С и гетерозиготы С/С) ассоциировано с вазоспазмом и повышенным риском ИБС.
Полиморфизмы NOS3 связаны с умеренным повышением риска сердечно-сосудистых заболеваний, которое не превосходит по силе традиционные факторы риска. Например, у гомозигот по аллелю T полиморфизма NOS3 G894T риск повышен в 1,3 раза (для сравнения высокий уровень ХС-ЛПНП ассоциирован с 3-кратным увеличением риска). Поэтому в настоящий момент генетически полиморфизмы рассматриваются в качестве дополнительных факторов риска.
4. Определение полиморфизма генов факторов свертывания крови V и II
Механизм свертывания крови представляет собой сложную систему взаимодействия факторов, обладающих про- и антикоагулянтными свойствами. Врождённые или приобретенные нарушения механизма коагуляции могут приводить к повышенному тромбообразованию.
Среди генетически обусловленных тромбофилий самой частой причиной является мутация в гене фактора VF5, так называемая Лейденовская мутация. Около 5 % населения являются носителями мутантного аллеля гена F5. Лейденовская мутация возникает в результате замены азотистого основания гуанин на аденин в позиции 1691 гена F5, что приводит к замене аргинина на глутамин в белковой последовательности фактора V. Измененный белок оказывается более устойчивым к расщеплению активированным белком C, что нарушает нормальную работу противосвертывающей системы крови и в итоге приводит к гиперкоагуляции. Риск тромбообразования повышен в 2-5 раз у гетерозигот по Лейденовской мутации и в 20-50 раз — у гомозигот.
Вторая по частоте встречаемости причина наследственной тромбофилии – мутация гена фактора 2 (протромбина) F2, представленная заменой азотистого основания гуанин на аденин в положении 20210 регуляторной области гена. Около 3 % населения являются носителями мутантного аллеля гена F2. У гетерозигот по аллелю A уровень протромбина повышен, что приводит к увеличению риска тромбоза в 3 раза. Нередко один и тот же пациент является носителем как Лейденовской мутации, так и мутации в гене протромбина.
Указанные полиморфизмы гена F5 и гена протомбина ассоциированы с повышенным риском венозных, но не артериальных тромбозов. Существуют и другие факторы, связанные с повышенным риском тромбообразования, в том числе повышенный уровень гомоцистеина, наличие антифосфолипидных антител, волчаночного антикоагулянта, дефицит протеина C, S и антитромбина III.
С помощью указанных лабораторных и генетических маркеров можно оценить индивидуальный риск развития сердечно-сосудистых заболеваний. Для оценки эффективности воздействия лечебных мероприятий на модифицируемые факторы риска может быть рекомендован повторный анализ.
Для чего используется исследование?
- Для оценки индивидуального риска сердечно-сосудистых заболеваний;
- для оценки эффективности лечебных мероприятий.
Когда назначается исследование?
- При профилактическом осмотре пациента;
- при обследовании пациента с факторами риска сердечно-сосудистых заболеваний (сахарный диабет, курение табака, гипертоническая болезнь, наличие родственника с преждевременной ишемической болезнью сердца, возраст > 45 лет у мужчин и > 55 лет у женщин);
- при лечении пациента с повышенным риском сердечно-сосудистых заболеваний.
Что означают результаты?
Референсные значения
Для каждого показателя, входящего в состав комплекса:
- [06-008] Аполипопротеин B
- [06-009] Аполипопротеин A 1
- [06-028] Холестерол – Липопротеины высокой плотности (ЛПВП)
- [06-029] Холестерол — Липопротеины низкой плотности (ЛПНП)
- [06-041] Триглицериды
- [06-048] Холестерол общий
- [06-050] С-реактивный белок, количественно (высокочувствительный метод)
- [18-030] Фактор свертываемости крови 5 (F5). Выявление мутации G1691A (Arg506Gln)
- [18-031] Фактор свертываемости крови 2, протромбин (F2). Выявление мутации G20210A (регуляторная область гена)
- [18-032] Эндотелиальная синтаза оксида азота (NOS3). Выявление мутации G894T (Glu298Asp)
- [18-033] Эндотелиальная синтаза оксида азота (NOS3). Выявление мутации T(-786)C (регуляторная область гена)
Важные замечания
- Результат анализа оценивается с учетом анамнестических, дополнительных лабораторных и инструментальных данных.
Также рекомендуется
[03-011] Фибриноген
[06-016] Гомоцистеин
[13-047] Антитела к кардиолипину, IgG и IgM
[03-004] Волчаночный антикоагулянт
Кто назначает исследование?
Кардиолог, терапевт, врач общей практики.