Клинические рекомендации по лечению анемий у новорожденных
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).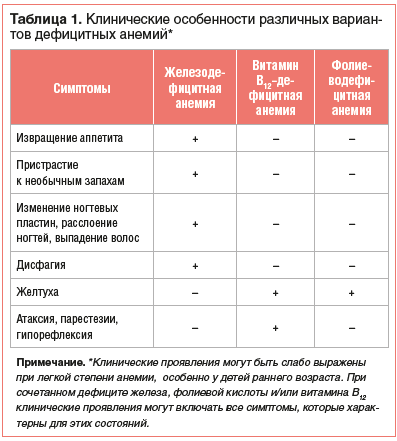
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).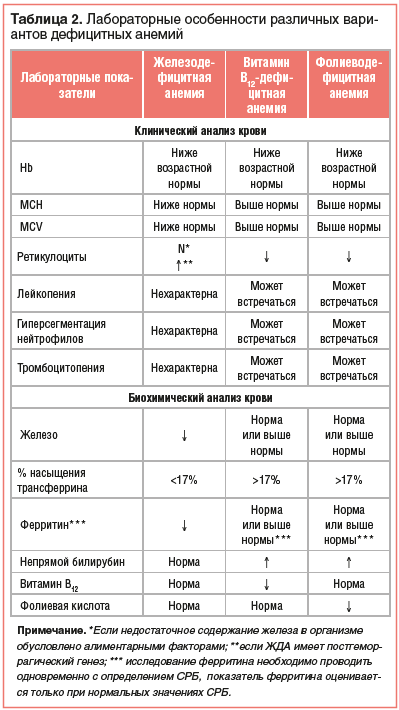
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.
Гемолитическая анемия — это группа расстройств, при которых эритроциты разрушаются быстрее, чем костный мозг успевает их продуцировать. Термин для разрушения эритроцитов — гемолиз.
Анемия — состояние, при котором снижается общее количество гемоглобина в организме. Снижение концентрации гемоглобина в крови является ключевым показателем, поскольку может быть измерено напрямую.
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| D55-59 | Гемолитическая анемия |
Аутоиммунная гемолитическая анемия (АИГА) характеризуется преждевременным разрушением эритроцитов, вызванным аутоантителами, связывающими поверхностную мембрану эритроцитов, с последующим разрушением ретикулоэндотелиальной системой или механизмом, опосредованным комплементом. Это относительно редкое заболевание с предполагаемой частотой 1—3 случая на 100 000 населения в год, и нет никаких доказательств того.
Что вызывает гемолитическую анемию у ребенка?
Гемолитическая анемия может вызываться двумя видами причин:
| Внутренними — когда клетки крови разрушаются изнутри. Этот тип анемии часто наследуется. Он включает серповидноклеточную анемию, талассемию или эритроцитоз. Эти условия производят красные кровяные клетки, которые не живут так долго, как нормальные красные кровяные клетки. | Внешними — когда красные кровяные тельца разрушаются от внешних факторов. Это также называется аутоиммунной гемолитической анемией. |
Внешние причины гемолитической анемии
| Инфекции, бактерии или вирусы |
| Лекарства-антибиотики — пенициллин или сульфаниламиды, лекарства от малярии или ацетаминофен |
| Различные формы рака (лейкемия, лимфома или другие опухоли) |
| Аутоиммунные нарушения — системная красная волчанка (СКВ, или волчанка), ревматоидный артрит, синдром Вискотта — Олдрича или язвенный колитю |
| Гиперспленизм — состояние, при котором селезенка разрушает больше эритроцитов, чем обычно |
Некоторые виды внешней гемолитической анемии являются временными и проходят в течение нескольких месяцев. В других случаях заболевание может стать хроническим с периодами ремиссий и рецидивов.
Симптомы гемолитической анемии у ребенка
Наиболее распространенные симптомы гемолитической анемии у детей следующие:
- бледная кожа;
- желтуха, или пожелтение кожи и глаз;
- моча темного цвета;
- лихорадка;
- слабость;
- головокружение;
- путаница;
- непереносимость физической активности;
- увеличение селезенки и печени;
- быстрое сердцебиение;
- шум в сердце.
Симптомы гемолитической анемии могут выглядеть как другие проблемы со здоровьем. Всегда консультируйтесь с доктором при диагностике состояния здоровья ребенка.
Как диагностируется гемолитическая анемия у ребенка?
Лечащий врач вашего ребенка может заподозрить гемолитическую анемию исходя из данных в истории болезни вашего ребенка и физического осмотра.
В случае появления симптомов анемии у вашего ребенка необходимо пройти следующие тесты:
- Гемоглобин и гематокрит. Этот тест измеряет количество гемоглобина и эритроцитов в крови.
- Полный анализ крови (CBC). Этот тест проверяет эритроциты и лейкоциты, тромбоциты (тромбоциты), а иногда и молодые эритроциты (ретикулоциты). Он включает в себя гемоглобин и гематокрит и более подробную информацию об эритроцитах.
- Периферический мазок. Небольшой образец крови рассматривается под микроскопом. Клетки крови проверяют, выглядят ли они нормально или нет.
- Другие анализы крови. Эти тесты проверят на лактатдегидрогеназу, билирубин и гаптоглобин, которые могут вызывать продолжающийся гемолиз. Некоторые тесты могут найти антитела, которые вызывают гемолиз.
- Анализ мочи. Эти тесты могут проверить на гемоглобин из разрушающихся эритроцитов.
- Аспирацию костного мозга, биопсию или и то и другое. Небольшое количество жидкости костного мозга (аспирация), твердой ткани костного мозга (биопсия ядра), часто из тазобедренных костей, или оба проверяются на количество, размер и зрелость клеток крови. Этот тест может также искать аномальные клетки.
Как лечится гемолитическая анемия у ребенка?
Лечение будет зависеть от симптомов вашего ребенка, его возраста и общего состояния здоровья, а также от того, насколько далеко зашла болезнь. Имеет значение и причина болезни.
Ребенка с гемолитической анемией часто лечит гематолог. Это эксперт по проблемам крови. Некоторые дети не нуждаются в лечении.
Лечение включает в себя:
| Гемотрансфузии |
| Лекарства — кортикостероиды или стероиды |
| Внутривенный иммуноглобулин (ВВИГ) |
| Ритуксимаб — лекарство для контроля иммунной системы |
| Антибиотики для лечения инфекции, если это является основной причиной |
| Другие лекарства в зависимости от типа гемолитической анемии |
Некоторым детям могут быть также назначены:
- Спленэктомия. Это операция по удалению селезенки.
- Иммуносупрессивная терапия. Это использование других лекарств для контроля иммунной системы.
- Плазмаферез. Это удаление антител из крови, которые разрушают эритроциты.
- Трансплантация стволовых клеток. В тяжелых случаях аномальные клетки костного мозга заменяются донорским костным мозгом.
Каковы возможные осложнения гемолитической анемии у ребенка?
Осложнения зависят от причины гемолитической анемии и включают:
| Побочные эффекты лекарств, например повышенный риск заражения кортикостероидами |
| Желчные камни или камни в желчном пузыре |
| Тромбы и сгустки крови в легких (легочная эмболия) |
| Почечную недостаточность |
| Шок |
| Сердечную недостаточность |
Как помочь ребенку жить с гемолитической анемией?
Управление гемолитической анемией зависит от того, насколько серьезны симптомы. У детей с легкими симптомами регулярно берется кровь на анализ.
Лечение детей с более серьезными симптомами происходит гораздо сложнее. У них также часто берется кровь на анализ. У таких детей могут быть проблемы с повседневной деятельностью из-за их симптомов или применяемого метода лечения. Если ваш ребенок принимает лекарство, повышающее риск заражения, он должен держаться подальше от больных людей.
В каких случаях нужно идти к врачу?
Обратитесь к лечащему врачу сразу, как только поведение вашего ребенка начало меняться. Например, ваш ребенок может быть не таким активным, как обычно. Также необходимо немедленно обратиться к врачу, если у вашего ребенка наблюдается изменение цвета мочи и кожи.
Ключевые моменты о гемолитической анемии у детей:
| Гемолитические анемии — это группа состояний, при которых разрушаются эритроциты |
| Гемолитическая анемия может быть наследственным заболеванием или может быть следствием аутоиммунных состояний, инфекций, рака или лекарств |
| Многие дети не нуждаются в лечении. При необходимости лечения назначают переливания крови, стероиды и др. |
Дальнейшие действия
Советы, которые помогут вам получить максимальную отдачу от лечащего врача вашего ребенка:
- Перед визитом запишите вопросы, на которые вы хотите получить ответы.
- При посещении запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите любые новые инструкции, которые перечислит лечащий врач вашего ребенка.
- Узнайте, почему назначается новое лекарство или лечение и как оно поможет вашему ребенку. Также узнайте, каковы побочные эффекты.
- Выясните, можно ли лечить состояние вашего ребенка другими способами.
- Узнайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Выясните, чего ожидать, если ваш ребенок не принимает лекарство, не проходит обследование или процедуру.
- Если необходима следующая встреча с врачом, запишите ее дату, время и цель.
В любом случае при возникновении симптомов анемии у ребенка необходимо в срочном порядке обратиться к лечащему врачу. Он поставит точный диагноз и в скорейшем времени назначит требуемое лечение, если оно будет необходимо.
Анемия Минковского — Шоффара
Данное заболевание (другое его название — микросфероцитоз) с частотой возникновения в 2—3 случая на 10 000 новорожденных является наследственной патологией. Главным проявлением болезни выступает стремительно развивающиеся малокровие (анемия), это вызвано тем, что в селезенке преждевременно разрушается значительное количество дефектных эритроцитов.
Основные причины возникновения и механизм развития
Естественные размеры и форма эритроцитов позволяют им беспрепятственно проходить в капиллярах, которые являются самыми мелкими сосудами в организме и через стенки которых происходит газообмен в тканях.
Заболевание Минковского — Шоффара развивается вследствие наличия генного дефекта, нарушающего синтез стенок эритроцитов вследствие уменьшающегося наличия белка спектрина.
Внутрь эритроцитов начинают интенсивно поступать ионы натрия и воды, что неминуемо приводит к их расширению в размерах. В тот момент, когда эритроцит принимает сферическую форму, он теряет эластичность, из-за этого, проходя по сосудам, деформируется, а в дальнейшем очень быстро разрушается полностью.
Это приводит к дефициту количества эритроцитов, и начинает развиваться гемолитическая анемия. Чаще всего заболевание является наследственным от родителей, от одного из которых и передается дефектный ген. В более редких случаях, когда родители здоровы, болезнь Минковского — Шоффара возникает вследствие первичной мутации в процессе внутриутробного развития.
Факторы, провоцирующие первичные мутации
| Воздействие рентгеновского и радиационного излучения |
| Токсическое воздействие на геном попавших в организм во время беременности химических веществ (медикаменты, алкоголь, никотин, наркотические вещества и прочие) |
| Вирусная инфекция, поразившая организм плода. ДНК вируса встраивается в клеточный геном и провоцирует мутацию |
Все перечисленные факторы могут приводить, помимо микросфероцитоза, и к другим патологиям внутриутробного развития плода, поэтому следует во время беременности стараться избегать их воздействия. В физиологическом отношении своеобразным фильтром для отработанных эритроцитов является селезенка — именно она утилизирует мертвые эритроциты, продолжительность службы которых в среднем составляет 90—120 дней.
Симптомы микросфероцитоза
Чаще всего ярко выраженная симптоматика проявляется у детей в дошкольном и раннем школьном возрасте, а степень выраженности зависит только от количества дефектных эритроцитов. Так как течение заболевания цикличное (волнообразное), то характерны периоды гемолитического криза и межприступного периода.
Гемолитический криз — это одновременное разрушение большого количества эритроцитов. Межприступный период клинически проявляется признаками малокровия, кожа и слизистые глаз становятся бледными с небольшой желтушностью.
Гемолитический криз характеризуется такими клиническими проявлениями:
- желтухой — желтушно-зеленоватым окрашиванием кожи, слизистых вследствие увеличенного количества в крови продуктов распада гемоглобина разрушенных эритроцитов;
- повышением температуры тела до +38 °C, головной болью, головокружением, общей слабостью;
- болями в животе, которые могут иметь спастический характер;
- болью в области печени под правым подреберьем вследствие ее увеличения;
- увеличением в размерах селезенки.
Патология эритроцитов может длительно не проявлять себя абсолютно ничем, выраженность симптомов зависит от количества погибших телец. В таких случаях единственным симптомом, на который следует обратить внимание, выступит чуть заметная желтушность на коже и склерах глаз зеленоватого оттенка.
Осложнения и последствия болезни
В раннем детском возрасте при серьезной форме микросфероцитоза последствием постоянного малокровия может стать отставание ребенка в психическом и соматическом развитии. Очень важно для успешного лечения этого заболевания раннее выявление деструктивных процессов, ведь перечисленные последствия в течение жизни исправить невозможно.
Диагностические мероприятия
Диагностировать микросфероцитоз не составляет особых трудностей. Измененные эритроциты определяются анализом мазка крови при микроскопии по Романовскому — Гимзе.
Нормальные эритроциты имеют форму двояковогнутого диска, деформированные — сферическую. Подсчетом процентного соотношения числа измененных форм и общего количества эритроцитов определяется тяжесть заболевания.
Клинически значимым является течение болезни, при котором сферические эритроциты составляют 10—20 % от общего их числа. Необходимо оценить размеры лимфатических узлов, печени, селезенки, исключить наличие образований в брюшной полости, забрюшинном пространстве, другие признаки злокачественных заболеваний.
Для заблаговременной диагностики заболевания и других отклонений системы крови необходимо проводить профилактический анализ крови ребенку ежегодно.
Лечение микросфероцитоза
Исходя от тяжести процесса назначается лечебная последовательность. При легком течении микросфероцитоза активные лечебные мероприятия не проводятся. Ребенок госпитализируется в стационар только при развитии приступа гемолитической анемии.
В лечебном учреждении проводится дезинтоксикационная терапия для выведения продуктов распада гемоглобина из организма, также для восстановления уровня эритроцитов в крови прописывается прием витаминов и препаратов железа.
Тяжелое течение требует проведения операции спленэктомии (удаление селезенки). При этом количество деформированных эритроцитов не уменьшается, но уже не происходит их разрушение при прохождении через селезенку. Такой исход считается методом радикальной терапии болезни Минковского — Шоффара.
Прогноз при заболевании Минковского — Шоффара весьма благоприятный при условии своевременного выявления отклонения и правильном лечении, особенно это касается предотвращения развития малокровия, которое сказывается на дальнейшем развитии.


