Клинические рекомендации по лечению анемии у взрослых
Железодефицитная анемия – заболевание, распространенное среди всех групп населения, однако тяжелая его форма встречается достаточно редко.
 Железодефицитная анемия – это гематологическое заболевание, возникающее по множеству причин и напрямую связанное с недостатком железа в организме человека вследствие нарушений его поступления, усвоения или повышенных потерь.
Железодефицитная анемия – это гематологическое заболевание, возникающее по множеству причин и напрямую связанное с недостатком железа в организме человека вследствие нарушений его поступления, усвоения или повышенных потерь.
Данная патология характеризуется гипохромной анемией и микроцитозом.
↯
Больше статей в журнале
«Заместитель главного врача»
Активировать доступ
Возникновению железодефицитной анемии, как правило, предшествует период латентного дефицита железа, чаще всего рассматриваемый как приобретенное функциональное расстройство и характеризующийся скрытым недостатком этого микроэлемента, снижением его запасов в организме и недостаточным содержанием его в тканях при отсутствии явной анемии.
Заболевание сочетает в себе сидеропенический и анемический синдромы. Рассмотрим клинические рекомендации по железодефицитной анемии.
Причины и признаки
Эксперты считают основной причиной развития ЖДА неправильное питание. Также причинами заболевания являются кровотечения, приводящие к так называемой хронической постгеморрагической анемии, и заражение глистами, характерное для местностей с низкой санитарной культурой.
Симптомы ЖДА:
- бледная сухая кожа, иногда с голубоватым оттенком;
- истончение, искривление ногтей;
- выпадение, слабость, сухость, ранняя седина волос;
- вкусовые извращение, пристрастие к необычным запахам;
- атрофический глоссит;
- тахикардия, одышка, отеки;
- пониженное артериальное давление;
- снижение работоспособности, концентрации внимания, памяти;
- мышечная слабость;
- у женщин – расстройства менструального цикла.
✔ Дифференциальная диагностика анемий в неонатальном периоде, скачайте таблицу в Системе Консилиум.
Скачать таблицу
Клинические проявления ЖДА неспецифичны, то есть характерны для любой формы анемии, однако они значительно утяжеляют течение болезни, снижая качество жизни больного.
Несмотря на то, что клиническая картина при ЖДА очерчена довольно четко, ее малая распространенность, а также отсутствие тяжелых и средней тяжести форм в популяции приводит к тому, что симптоматика сидеропении и анемии обладает низкой чувствительностью и не всегда позволяет выявить болезнь.
В связи с этим основополагающее значение в диагностике железодефицитной анемии приобретают лабораторные и инструментальные исследования.
В статье вы найдете только несколько готовых образцов и шаблонов.
В Системе «Консилиум» их более 5000.
Успеете скачать всё, что нужно, по демодоступу за 3 дня?
Активировать
Диагностика
Лабораторная диагностика включает в себя:
- ОАК.
- ОАМ.
- Анализ кала на скрытую кровь.
- Исследование мокроты и промывных бронхиальных вод на гемосидерин, атипичные клетки и Mycobacteriumtuberculosis.
Если диагноз ЖДА подтверждается лабораторными исследованиями, больному показан целый ряд инструментальных методов исследования для выявления или исключения возможного источника внутреннего кровотечения.
К ним относятся:
- ФГДС;
- колоноскопия;
- мануальное и ультразвуковое исследование органов малого таза у женщин;
- цистоскопия, УЗИ почек;
- рентген грудной клетки.
Клинические рекомендации по ЖДА
Клинические рекомендации по железодефицитной анемии у детей и взрослых устанавливают стандарт, определяющий объем и критерии качества оказания медпомощи больному при развитии анемического синдрома.
Он предназначен для лечебных организаций и учреждений федерального, регионального и муниципального уровней, систем ОМС и ДМС, другими медорганизациями различных организационно-правовых форм деятельности, направленной на оказание медицинской помощи.
✔ Железодефицитная анемия: стандарт лечения из расчета 21 день, таблица в Системе Консилиум.
Лечение железодефицитной анемии
Согласно клиническим рекомендациям по ЖДА, препараты для ее лечения условно делятся на:
- ионные солевые;
- препараты железа на основе ГПК.
По данным исследований, эффективность и тех, и тех средств одинакова. Однако в процессе терапии солевыми препаратами возможны проблемы:
- передозировка или отравление из-за неконтролируемого всасывания действующего вещества организмом;
- взаимодействие с другими медикаментами и с некоторыми продуктами питания;
- неприятный металлический привкус;
- стойкое окрашивание зубов и десен в темный цвет;
- низкая комплаентность (частый отказ больных от лечения).
Клинические рекомендации по ЖДА у детей отмечают, что при приеме солевых препаратов могут наблюдаться боли в животе, тошнота, рвота, запор, диарея.
Этих проблем можно избежать, назначая пациентам современные препараты железа на основе ГКП (гидроксида полимальтозата).
Данная группа средств отличается большей безопасностью и имеет ряд преимуществ:
- отсутствие риска передозировки и интоксикации;
- отсутствие окрашивающих зубы и десны свойств;
- приятный вкус;
- хорошая переносимость;
- отсутствие взаимодействия с пищей и другими лекарствами;
- антиоксидантные свойства;
- высокая комплаентность лечения.
Основные пероральные препараты железа, применяемые в лечении железодефицитной анемии, а также содержание в них элементарного железа приведены в таблице ниже.
Лечение детей: клинические рекомендации
Согласно клиническим рекомендациям по железодефицитной анемии, лечение данного заболевания у детей имеет свои нюансы, которые необходимо учитывать при оказании медицинской помощи.
Например, применение у детей до 3 лет солевых препаратов железа в дозе 5—8 мг/кг массы тела в сутки вызывает интоксикацию у больных, поэтому не имеет смысла и крайне нежелательно с терапевтической точки зрения.
В практике отечественных врачей-педиатров долгие годы был принят так называемый трапециевидный терапевтический план лечения железодефицитной анемии у детей. Он предполагает, в первые 3—5 дней лечения дозировка солевых препаратов железа возрастает постепенно, чтобы избежать негативного влияния на слизистую оболочку ЖКТ.
Полную дозу солевого препарата железа применяли в течение 1,5—3 месяцев исходя из степени тяжести заболевания с последующим постепенным ее снижением до 50% к моменту окончания лечения.
Главный недостаток этой схемы в том, что она, как и множество других, была разработана эмпирически, а ее клиническая эффективность никогда не была доказана исследованиями.
Разработка препаратов железа на основе ГПК дало основание для пересмотра плана лечения железодефицитной анемии у детей и взрослых.
В Федеральном научно-клиническом центре детской гематологии, онкологии и иммунологии (ФНКЦ ДГОИ) им. Дмитрия Рогачева Минздрава России (г. Москва) было проведено исследование, направленное на сравнению клинической эффективности двух планов лечения ЖДА различной степени тяжести у детей и подростков: традиционного трапециевидного, описанного чуть выше, и нового, предполагающего прием полной дозы препарата железа на основе ГПК на протяжении всего периода терапии.
В ходе исследования были оценены:
- переносимость препарата железа на основе ГПК;
- эффективность терапии в ранние и поздние сроки.
Была доказана высокая эффективность лечения детей и подростков с железодефицитной анемией средством на основе ГПК. После завершения курса лечения были достигнуты следующие показатели:
- нормализация концентрации НЬ — у 96,9% больных;
- нормализация СЖ — у 73,4% больных;
- нормализация СФ — у 60,9% больных.
Незначительное количество нежелательных явлений (запор в течение первого месяца лечения) и 100%-ная приверженность пациентов к лечению позволили сделать вывод, что препарат железа на основе ГПК — оптимальный вариант терапии железодефицитной анемии у детей и подростков.
Также было обнаружено преимущество использования полной дозы препарата на основе ГПК в течение всего курса лечения:
- нормализация концентрации СЖ — у 90,6% больных;
- нормализация СФ — у 75%.
При применении традиционного трапециевидного плана лечения аналогичные показатели составили 56,3% и 46,9% соответственно.
Использование парентеральных препаратов железа показано в том случае, если есть какие-либо противопоказания для перорального приема медикаментов, либо они не оказывают должного эффекта.
Внутривенное или внутримышечное введение препаратов железа применяется в следующих случаях:
- тяжелая форма железодефицитной анемии;
- непереносимость препаратов железа для приема внутрь;
- устойчивость к лечению пероральными препаратами железа;
- язва желудка или двенадцатиперстной кишки;
- состояние после операций на ЖКТ;
- операции на ЖКТ в анамнезе;
- анемии, связанные с хроническими болезнями кишечника (НЯК, болезнь Крона);
- хроническая почечная недостаточность, преддиализный и диализный периоды;
- наличие противопоказаний к переливанию эритроцитарной массы, в т.ч. и из религиозных соображений;
- необходимость срочного насыщения организма железом.

ЖДА у взрослых
Лечение железодефицитной анемии направлено на ликвидацию причин заболевания (пересмотр рациона питания, обнаружение и устранение источника кровопотери), а также на пополнение запасов этого микроэлемента в организме.
Основные принципы лечения ЖДА:
- назначение лекарственных средств, содержащих железо, так как возместить его недостаток в организме невозможно никаким другим способом:
- в приоритете – назначение средств для перорального приема;
- расчёт дозы препарата выполняется индивидуально для каждого больного исходя из его веса и терапевтического плана;
- длительность лечения – 3 месяца при легкой форме анемии, 4,5 месяца – при средней, 6 месяцев – при тяжелой;
- устранение дефицита железа в тканях организма, пополнение его запасов в депо (определяется по нормализации уровня СФ);
- контроль эффективности лечения препаратами железа.
Клинический случай: Гемотрансфузия и кровоизлияние в сетчатку, рассмотрим в Системе Консилиум.
Профилактика
Если распространенность железодефицитной анемии в регионе превышает отметку в 40%, власти принимают решение провести фортификацию, то есть обогащение железом продуктов питания, наиболее часто употребляемых населением. Однако нужно, чтобы их употребляли не менее 65% людей. Чаще всего речь идет о хлебе и макаронах.
Стоит отметить, что методика фортификации достаточно сложна, так как не существует идеального пищевого продукта, а также нет и соединения железа, хорошо всасывающегося и без проблем переносимого всеми группами населения. Поэтому эффективность фортификации не превышает 50% среди охваченного населения.
Гораздо лучшие результаты приносит профилактика железодефицитной анемии у лиц, входящих в группу риска развития анемии. Речь идет о так называемой саплиментации – добавке микроэлементов (железа, йода, магния и др.) извне.
Наглядный пример данной методики – назначение препаратов железа беременным женщинам для профилактики развития железодефицитных состояний. Клинические рекомендации по железодефицитной анемии у взрослых в нашей стране предполагают, что препарат железа в дозе 60 мг в сутки назначается во II и III триместрах беременности, а также в течение 3 месяцев кормления грудью.
В то же время национальные рекомендации США предписывают беременным женщинам прием препаратов железа в дозе 30 мг в сутки в течение всего периода гестации.
Между тем, нужно отметить, что даже при охвате саплиментацией 50-95% беременных женщин необходимую дозу железа получают лишь 67% женщин.
Доказано, что в первую очередь недостаток железа в организме вызван неправильным питанием. Это означает, что первичная профилактика железодефицитной анемии заключена в рациональном, сбалансированном и здоровом рационе человека любого возраста.
Материал проверен экспертами Актион Медицина
Источник
 26.07.2019
26.07.2019
Практические рекомендации по лечению анемии при злокачественных новообразованиях
Анемия при злокачественных новообразованиях (АЗН) определяется как снижение концентрации Hb ниже нормального значения (обычно 120 г/л) и может быть обусловлена как наличием самой опухоли, так и её лечением.
Анемия при злокачественных новообразованиях (АЗН) определяется как снижение концентрации Hb ниже нормального значения (обычно 120 г/л) и может быть обусловлена как наличием самой опухоли, так и её лечением.
Слабая степень анемии представляет собой снижение концентрации Hb в диапазоне от 100 до 119 г/л, анемия средней степени — концентрация Hb от 80 до 99 г/л, тяжёлая анемия — концентрация Hb ниже 80 г/л.
Клиническая значимость анемии определяется:
• отрицательным влиянием на качество жизни онкологических больных с развитием слабости;
• отрицательным влиянием на продолжительность жизни при большинстве типов опухолей;
• снижением эффективности противоопухолевого лечения (отдельных цитотоксических препаратов и ЛТ).
1. ДИАГНОСТИКА
1.1. Анамнез
При сборе анамнеза у больных с анемией необходимо оценить:
• возможность наследственной анемии или гемоглобинопатии;
• характер и длительность предшествующей противоопухолевой терапии (вид лекарственной терапии, количество курсов, миелотоксичность, включение препаратов платины);
• наличие острого или хронического кровотечения;
• хронические воспалительные заболевания почек;
• наличие аутоиммунных заболеваний.
1.2. Лабораторные показатели
• общий анализ крови с определением концентрации Hb, количества эритроцитов и ретикулоцитов, гематокрита (Hct), среднего объёма эритроцита (MCV), среднего содержания Hb в эритроците (MCH), средней концентрации Hb в эритроците (MCHC), среднего содержания Hb в ретикулоците;
• исследование костного мозга — по показаниям;
• оценка показателей обмена железа: содержание сывороточного ферритина с поправкой на содержание С-реактивного белка (повышение ферритина как белка острой фазы при воспалении), насыщение сывороточного трансферрина железом, содержание в крови фолатов и витамина В12;
• оценка возможности скрытого кровотечения из ЖКТ(пробы на скрытую кровь в кале, эндоскопическое исследование), почечной недостаточности (клиренс креатинина <60мл/мин.) с нарушением продукции эндогенного эритропоэтина;
• проба Кумбса (при хроническом лимфолейкозе, неходжкинских лимфомах, аутоиммунных заболеваниях в анамнезе);
• определение концентрация эндогенного эритропоэтина (при подозрении на миелодиспластический синдром);
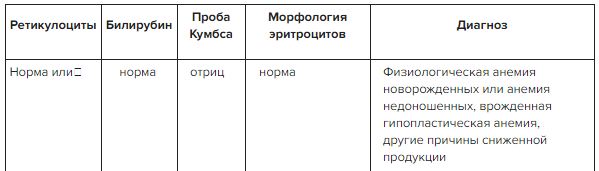
Диагностику анемии и выявление причин необходимо проводить до проведения заместительных трансфузий эритроцитов (если нет экстренных показаний) или назначения эритропоэз-стимулирующих препаратов (ЭСП) и препаратов железа. Алгоритм диагностики анемии у онкологического больного представлен на рис. 1.
2. ЛЕЧЕНИЕ
2.1. Гемотрансфузии
Традиционным методом коррекции сниженного Hb и жизнеугрожающих ситуаций, связанных с острой кровопотерей (обширные операции), являются заместительные трансфузии эритромассы. Однако, для лечения анемии, связанной с опухолевым процессом (распад опухоли, интоксикация) и противоопухолевым лечением, гемотрансфузии не являются безопасным и эффективным методом.
Переливания эритромассы могут сопровождаться гемолитическими реакциями, в том числе фатальными (частота — 1:1 000), трансфузионными поражениями лёгких (частота — 1:5000), бактериальной контаминацией, в том числе фатальным сепсисом (частота — 1:10 000), передачей вирусов гепатита В (частота — 1:30 000), гепатита С и вируса иммунодефицита человека (частота — 1:1 000 000).
Кроме того, многие потенциально опасные вирусные инфекции в настоящее время у доноров не тестируются.
Наряду с вышесказанным, иммунодепрессия, вызванная переливанием эритроцитов, приводит к повышению риска тромбозов, инфекционных осложнений и снижением безрецидивной и общей выживаемости при ряде опухолевых заболеваний (колоректальный рак, рак мочевого пузыря).
Повышение концентрации Hb после гемотрансфузий является кратковременным, и для поддержания его нормального значения их необходимо повторять.
В связи с этим ВОЗ рекомендует максимально регламентировать заместительные гемотрансфузии у онкологических больных и использовать альтернативные методики коррекции Hb. Согласно приказу Министерства Здравоохранения Российской Федерации № 363 от 25.11.2002 г., гемотрансфузии при снижении концентрации Hb <70-80 г/л показаны только в случае острых постгеморрагических анемий при одномоментном снижении гематокрита до <25%.
При хронических анемиях главной задачей является устранение причины, вызвавшей анемию, и гемотрансфузии назначаются только для коррекции клинически значимых симптомов, обусловленных гипоксией вследствие снижения Hb и не поддающихся патогенетической терапии.
2.2. Лекарственная терапия
2.2.1. Эритропоэз-стимулирующие препараты
2.2.1.1. Показания
Альтернативным методом коррекции АЗН является назначение ЭСП в монотерапии или в комбинации с препаратами железа. Использование ЭСП позволяет повысить продукцию эритроцитов костным мозгом и увеличить содержание Hb без переливания донорских эритроцитов.
Результаты контролируемых исследований показали, что применение ЭСП при АЗН, а также при анемии, вызванной ХТ, повышает концентрацию Hb в 60-70% случаев и сопровождается существенным снижением потребности в заместительных гемотрансфузиях (относительный риск 0,64; 95% ДИ 0,6-0,68).
У больных с солидными опухолями и больных, получающих платиносодержащую ХТ, применение ЭСП более эффективно, чем при других типах опухолей и других видах ХТ.
В ряде исследований продемонстрировано улучшение качества жизни при применении ЭСП. Однако в других исследованиях различия в показателях качества жизни признаны незначимыми.
Применение ЭСП повышает вероятность тромботических осложнений, относительный риск которых увеличивается на 67% по сравнению с плацебо (ОР 1,67; 95% ДИ: 1,35-2,06). Влияние ЭСП на выживаемость онкологических больных изучается, однако результаты исследований неоднозначны.
Данные трёх мета-анализов показали негативное влияние ЭСП на общую выживаемость, а результаты двух других мета-анализов подобного влияния не выявили.
Однако во всех мета-анализах не было выявлено значимого негативного влияния ЭСП у больных, получающих ХТ. В связи с этим большинство экспертов считает нецелесообразным применение ЭСП у больных, не получающих ХТ, за исключением пациентов с миелодиспластическим синдромом.
2.2.1.2. Противопоказания
• известная гиперчувствительность к ЭСП или их компонентам;
• неконтролируемая АГ;
• высокий риск тромбоэмболических осложнений (тромбоз в анамнезе, обширное хирургическое вмешательство, длительная иммобилизация или ограничение активности, лечение талидомидом или леналидомидом в комбинации с доксорубицином и ГКС);
данные о роли профилактического использования антикоагулянтов или аспирина отсутствуют;
• хроническая почечная недостаточность (возможны случаи истинной эритроцитарной аплазии, вызванной нейтрализующими антиэритропоэтиновыми антителами;
случаев истинной эритроцитарной аплазии среди онкологических больных не описано).
2.2.1.3. Осложнения
• редкие аллергические реакции, включая удушье, кожную сыпь и крапивницу;
• артралгии;
• периферические отёки;
• незначительная и преходящая боль в месте инъекции.
Рекомендуемые дозы ЭСП и принципы их коррекции у взрослых онкологических больных, получающих ХТ, представлены в табл. 1.
2.2.2. Препараты железа
У части больных на фоне терапии ЭСП быстро развивается абсолютный или функциональный дефицит железа, в связи с чем необходимо исходное и пе- риодическое измерение насыщения железом сывороточного трансферрина, содержания сывороточного ферритина и С-реактивного белка.
Показателями нарушения обмена железа являются содержание сывороточного ферритина <100 нг/мл и насыщения железом сывороточного трансферрина <20%.
Содержание сывороточного ферритина <100 нг/мл у онкологического больногосвидетельствует об абсолютном дефиците железа и необходимости терапии препаратами железа; предпочтительны в/в лекарственные формы, т.к. при приёме внутрь железо плохо всасывается. Более высокое содержание сывороточного ферритина (100-800 нг/мл) и насыщение железом сывороточного трансферрина <20% свидетельствует о функциональном дефиците железа.
У больных с анемией и дефицитом железа парентеральное введение препаратов железа приводит к значительно большему повышению концентрации Hb, чем без применения железосодержащих препаратов или при назначении препаратов железа внутрь. Поддержка препаратами железа уменьшает также число больных, нуждающихся в трансфузиях эритроцитов.
В связи с возможным взаимодействием железа и некоторых цитостатиков(антрациклины, препараты платины) необходимо воздерживаться от введения препаратов железа в дни введения противоопухолевых препаратов.
Рекомендуемые дозы и режим введения препаратов железа представлены в табл. 2.
В табл. 3 представлена сводная информация о лекарственных препаратах, рекомендуемых для лечения анемии у онкологических больных.
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ АНЕМИИ
• общий анализ крови с определением концентрации Hb, гематокрита (Hct), количества эритроцитов и ретикулоцитов, среднего объема эритроцитов (MCV), среднего содержания Hb вэритроците (MCH) и средней концентрации Hb в эритроците (MCHC); кровотечение (кал на скрытую кровь, эндоскопическое обследование);
• гемолиз (проба Кумбса, ДВС-панель, гаптаглобин, непрямой билирубин, ЛДГ);
• алиментарная анемия (сывороточное железо, ОЖСС, ферритин, витамин В12, фолиевая кислота);
• наследственность (семейный анамнез);
• почечная дисфункция (клубочковая фильтрация);
• миелосупрессия, вызванная противоопухолевой терапией (ЛТ, ХТ);
• метастатическое поражение костного мозга
ЛЕЧЕНИЕ АНЕМИИ В ЗАВИСИМОСТИ ОТ ДОМИНИРУЮЩЕЙ ПРИЧИНЫ
Рисунок 1. Рекомендуемый алгоритм обследования онкологического больного с анемией.
Функциональный дефицит железа
Дефицит железа?
Оценить:
• уровень ферритина;
• уровень насыщения трансферрина железом.
Дополнительно:
• доля гипохромных эритроцитов, уровень Hb в ретикулоцитах
Абсолютный дефицит железа:
• уровень ферритина <100 нг/мл;
• насыщение трансферрина железом <20%;
• процент гипохромных эритроцитов > 5%;
• содержание Hb в ретикулоцитах < 26 пг.
Функциональный дефицит железа:
• • уровень ферритина >100 нг/мл;
• • насыщение трансферрина железом <20%;
• • доля гипохромных эритроцитов >5%;
• • содержание Hb в ретикулоцитах < 26 пг.
Рисунок 2. Рекомендуемый алгоритм лечения анемии
Коллектив авторов: Орлова Р. В., Гладков О. А., Жуков Н. В., Копп М. В., Королева И. А., Ларионова В. Б., Моисеенко В. М., Поддубная И. В., Птушкин В. В
Теги: анемия
Начало активности (дата): 26.07.2019 13:50:00
Кем создан (ID): 989
Ключевые слова:
поддерживающая терапия, анемия, эритропоэтин, железодефицитная анемия, анемия онкологических больных
Источник