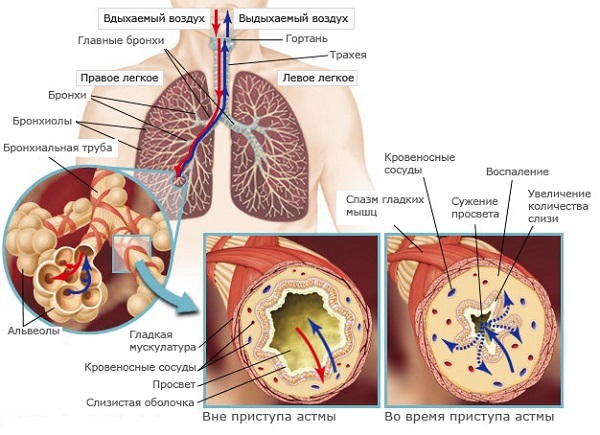
Экспериментальная модель бронхиальной астмы
1. Воробьев П.А. Клинико-экономический анализ. Изд. 3-е. М.: Ньюдиамед, 2008, 778 с. С. 175-178.
2. Глобальная стратегия лечения и профилактики бронхиальной астмы (GI-NA). Пересмотр 2006 г. Перевод с англ. под ред. Чучалина А.Г. М.: Издательский дом «Атмосфера», 2007, 104 е., ил.
3. Гущин И.С. Аллергическое воспаление и его фармакологический контроль. М.: Фармарус Принт, 1998.
4. Дрожжев М.Е., Лев Н.С., Костюченко М.В. и соавт. Современные показатели распространенности бронхиальной астмы среди детей. Пульмонология, 2002; (1): 42-46.
5. Кисели Д. Практическая микротехника и гистохимия. Будапешт: Изд-во АН Венгрии, 1962, с. 399.
6. Крючков Н.А., Бабахин А.А., Хаитов М.Р. Моделирование бронхиальной астмы у лабораторных мышей: общие принципы и значение. Физиология и патология иммунной системы, 2008; (2):3-7.
7. Княжеская Н.П. Тяжелая бронхиальная астма. Consilium medicum, 2002; 4(4): 189-197.
8. Литвин Л.С., Бабахин А.А., Стеценко О.Н. и др. Оценка различных способов иммунизации при моделировании экспериментального аллергического ответа. Российский аллергологический журнал. 2005; (1): 35-42.
9. Литвин Л.С., Бабахин А.А., Хаитов М.Р. и др. Модели экспериментальной атопической бронхиальной астмы. Патофизиология и экспериментальная терапия, 2006; (3): 26-27.
10. Литвин Л.С., Хаитов М.Р., Бабахин А.А. и др. Характеристика экспериментальной модели бронхиальной астмы, полученной без использования адъюванта. Аллергология и иммунология, 2007, т.8, №1, с.40.
11. Никитин В.М. Атлас клеток крови сельскохозяйственных и лабораторных животных. М.: Гос. изд-во сельскохозяйственной литературы, 1949.
12. Паттерсон Р., Грэммер Л.К., Гринбергер П.А. Аллергические болезни: диагностика и лечение. Пер. с англ. Под. ред. А.Г.Чучалина, И.С. Гущина, Э.Г. Улумбекова, Р.С. Фассахова. М.: ГЭОТАР МЕДИЦИНА, 2000, 768 с.
13. Пыцкий В.И. Обоснование классификации форм бронхиальной астмы и анализ их патогенеза. Астма, 2000; 1(1): 14-26.
14. Чучалин А.Г. Бронхиальная астма. М.: ИД «Русский врач», 2001.
15. Чучалин А.Г. Черняк Б.А., Тяренкова С.Н., Буйнова С.В. Распространенность и клинико-аллергологическая характеристика бронхиальной астмы в Восточной Сибири. Пульмонология, 1999; 1: 42-49.
16. Ahn J.H., Kim С.Н., Kim Y.H. et al. Inflammatory and remodeling.events in asthma with chronic exposure to house dust mites: a murine model. J. Korean Med. Sci., 2007; 22: 1026-33.
17. Ait-Khaled N., Enarson D.A. Management of asthma. A Guide to the essentials of good clinical practice. Second ed. International union against tuberculosis and lung disease, 2005.
18. Ait-Khaled N., Enarson D.A., Bousquet J. Chronic respiratory diseases in developing countries :the burden and strategies for prevention and management. Bull. World Health Organ., 2001; 79: 971-979.
19. Almqvist C., Wickman M., Perfetti L. et al. Worsening of asthma in children allergic to cats, after indirect exposure to cat at school. Am. J. Respir. Crit. Care Med., 2001; 163(3 pt 1): 694-8.
20. Araujo M.I., Hoppe B.S., Medeiros M. Jr, Carvalhol E.M. Schistosoma man-soni infection modulates the immune response against allergic and autoimmune diseases. Mem. Inst. Oswaldo Cruz, Rio de Janeiro, 2004; 99(suppl. I): 27-32.
21. Ashcroft T., Simpson J.M., Timbrell V. Simple method of estimating severity of pulmonary fibrosis on a numerical scale. J. Clin. Pathol., 1988; 41: 467-470.
22. Azzawi M., Bradley B., Jeffery P.K. et al. Identification of activated T lymphocytes and eosinophils in bronchial biopsies in stable atopic asthma. Am. Rev. Respir. Dis., 1990; 142: 1407-1413.
23. Bartra J., Mullol J., del Cuvillo A. et al. Air pollution and allergens. J. Investig. Allergol. Clin. Immunol., 2007; 17(Suppl. 2): 3-8.
24. Bates J., Irvin C., Brusasco V. et al. The use and misuse of Penh in animal models of lung disease. Am. J. Respir. Cell Mol. Biol., 2004; 31: 373-374.
25. Baumans V. Use of animals in experimental research: an ethical dilemma? Gene Therapy, 2004; 11: S64-S66.
26. Beasley R. The Global Burden of Asthma Report, Global Initiative for Asthma (GINA), 2004. Available from: www.ginasthma.org.
27. Bischof R.J., Snibson K., Shaw R., Meeusen E.N.T. Induction of allergic inflammation in the lungs of sensitized sheep after local challenge with house dust mite. Clin. Exp. Allergy, 2003; 33:367-75.
28. Bleecker E., Postma D., Meyers D. Evidence for multiple genetic susceptibility loci for asthma. Am. J. Respir. Crit. Care Med., 1997; 156(Suppl. 4): 113-116.
29. Bockamp E., Maringer M., Spangenberg C. et al. Of mice and models: improved animal models for biomedical research. Physiol. Genomics, 2002, 11: 115-132.
30. Bollinger M.E., Eggleston P.A., Flanagan E., Wood R.A. Cat antigen in homes with and without cats may induce allergic symptoms. J. Allergy Clin. Immunol., 1996; 97: 907-14.
31. Bousquet J., Chanez P., Lacoste J.Y. et al. Eosinophilic inflammation in asthma. N. Engl. J. Med., 1990; 323: 1033-1039.
32. Braun M.C., He J., Wu C.Y., Kelsall B.L. Cholera toxin suppresses interleukin (IL)-12 production and IL-12 receptor betal and beta2 chain expression. J. Exp. Med., 1999; 189: 541-552.
33. Carpenter D.O., Arcaro K., Spink D.C. Understanding the human health effects of chemical mixtures. Environ. Health. Perspect., 2002; 110(suppl 1): 25-42.
34. Cho Y., Miller M., Baek K., et al. Inhibition of airway remodeling in IL-5-deficient mice. J. Clin. Invest., 2004; 113: 551-560.
35. Chung S.K., Lee A.Y.W., Chung S.S.M. Mouse models for human diseases. Hong Kong Med. J., 1997; 3: 201-209.
36. Conejero L., Higaki Y., Baeza M.L. Pollen-induced airway inflammation, hyper-responsiveness and apoptosis in a murine model of allergy. Clin. Exp. Allergy, 2007; 37(3): 331-8.
37. Corry D.B., Folkesson H.G., Warnock M.L. et al. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J. Exp. Med., 1996; 183: 109-117.
38. Craig W. Relevance of animal models for clinical treatment. Eur. J. Clin. Microbiol. Infect. Dis., 1993; 12 (suppl. 1): S55-S57.
39. Creticos P.S., Reed C.E., Norman P.S. et al. Ragweed immunotherapy in adult asthma. N. Engl. J. Med., 1996; 334: 501-506.
40. Custovic A., Green R., Taggard S.C. et al. Domestic allergens in public places. II. Clin. Exp. Allergy, 1996; 26(11): 1246-1252.
41. Custovic A., Wijk R.D. The effectiveness of measures to change the indoor environment in the treatment of allergic rhinitis and asthma: ARIA update (in collaboration with GA(2)LEN). Allergy, 2005; 60(9): 1112-1115.
42. D’Amato G., Liccardi G., D’Amato M., Cazzola M. Outdoor air pollution, climatic changes and allergic bronchial asthma. Eur. Respir. J., 2002; 20: 763776.
43. Daniel C., Repa A., Wild C. et al. Modulation of allergic immune responses by mucosal application of recombinant lactic acid bacteria producing the major birch pollen allergen Bet v 1. Allergy, 2006; 61(7): 812-819.
44. Dixon A.K., Fisch H.U. Animal models and ethological strategies for early drug-testing in humans. Neurosci. Biobehav. Rev., 1998; 23(2): 345-358.
45. Eisenbarth S.C., Piggott D.A., Huleatt J.W. et al. Lipopolysaccharide-enhanced, toll-like receptor 4-dependent T helper cell type 2 responses to inhaled antigen. J. Exp. Med., 2002; 196: 1645-1651.
46. Elias J.A., Lee C.G., Zheng T. et al. New insights into the pathogenesis of asthma. J. Clin. Invest., 2003; 111:291-297.
47. Ennis D.P., Cassidy J.P., Mahon B.P. Acellular pertussis vaccine protects against exacerbation of allergic asthma due to Bordetella pertussis in a murine model. Clin. Diagnostic. Lab. Immun., 2005; (3): 409-417.
48. Epstein M.M. Are mouse models of allergic asthma useful for testing novel therapeutics? Exp. Toxicol. Pathology, 2006; 57(S2): 41-44.
49. Erwin E.A., Wickens K., Custis N.J. et al. Cat and dust mite sensitivity and tolerance in relation to wheezing among children raised with high exposure to both allergens. J. Allergy Clin. Immunol., 2005; 115: 74-9.
50. Faul J.L., Tormey V.J., Leonard C. et al. Lung immunopathology in cases of sudden asthma death. Eur. Respir. J., 1997; 10: 301-307.
51. Feinberg A.P. Epigenetics at the epicenter of modern medicine. JAMA, 2008; 299(11): 1345-1350.
52. Finegold I. Allergen immunotherapy: present and future. Allergy Asthma Proc., 2007; 28(1): 44-49.
53. Finkelstein S.E., Heimann D.M., Klebanoff C.A. et al. Bedside to bench and back again: how animal models are guiding the development of new immunotherapies for cancer. J. Leukoc. Biol., 2004; 76: 333-337.
54. Foster P.S., Hogan S.P., Ramsay AJ. et al. Interleukin 5 deficiency abolishes eosinophilia, airways hyperreactivity, and lung damage in a mouse asthma model. J. Exp. Med., 1996; 183: 195-201.
55. Fox D.A., Choilazzi N., Katz D.H. Hapten-specific IgE antibody responses in mice. V. Differential resistance of IgE and IgG B-lymphocytes to X-radiation. J. Immunol., 1976; 117: 1622-1628.
56. Georas S.N., Guo J., De Fanis U., Casolaro V. T-helper cell type-2 regulation in allergic disease. Eur. Respir. J., 2005; 26: 1119-1137.
57. Gern J.E., Busse W.W. Relationship of viral infections to wheezing illnesses and asthma. Nat. Rev. Immunol., 2002; 2(2): 132-138.
58. Glaab T., Taube C., Braun A., Mitzner W. Invasive and noninvasive methods for studying pulmonary function in mice. Respiratory Research, 2007; 8: 63.
59. Gounni A.S. The high-affinity IgE receptor (FceRI): a critical regulator of airway smooth muscle cells? Am. J. Physiol. Lung Cell Mol. Physiol., 2006; 291: L312-321.
60. Grogan J.L., Mohrs M, Harmon B, et al. Early transcription and silencing of cytokine genes underlie polarization of T helper cell subsets. Immunity, 2001; 14: 205-215.
61. Halonen M., Stern D.A., Wright A.L. et al. Alternaria as a major allergen for asthma in children raised in a desert environment. Am. J. Respir. Crit. Care Med., 1997; 155: 1356-1361.
62. Hamid Q., Song Y., Kotsimbos T.C. et al. Inflammation in small airways in asthma. J. Allergy Clin. Immunol., 1997; 100: 44-51.
63. Havaux X., Zeine A., Dits A., Denis O. A new mouse model of lung allergy induced by the spores of Alternaria alternate and Cladosporium herbarum molds. Clin. Exp. Immun, 2004; 139: 179-188.
64. Herz U., Braun A., Ruckert R., Renz H. Various immunological phenotypes are associated with increased airway responsiveness. Clin. Exp. Allergy, 1998; 28: 625-634.
65. Holgate, S.T., Davies D.E., Lackie P.M. et al. Epithelial-mesenchymal interactions in the pathogenesis of asthma. J. Allergy Clin. Immunol., 2000; 105: 193-204.
66. Hoymann H.-G. New developments in lung function measurements in rodents. Exp. Toxicol. Pathol., 2006; 57(S2): 5-11.
67. Humbert M., Menz G., Ying S. et al. The immunopathology of extrinsic (atopic) and intrinsic (non-atopic) asthma: more similarities than differences. Immunol. Today, 1999; 20: 528-533.
68. Joachim R.A., Quarcoo D., Arck P.S. et al. Stress enhances airway reactivity and airway inflammation in an animal model of allergic bronchial asthma. Psychosomatic Medicine, 2003; 65: 811-815.
69. Johnson J.R., Wiley R.E., Fattouh R. et al. Continuous exposure to house dust mite elicits chronic airway inflammation and structural remodeling. Am. J. Respir. Crit. Care Med., 2004; 169: 378-385.
70. Karol M.H. Animal models of occupational asthma. Eur. Respir. J, 1994; 7: 555-568.
71. Kay A.B. Allergy and allergic diseases. First of two parts. N. Engl. J. Med., 2001; 344: 30-37.
72. Kim J., Merry A.C., Nemzek J.A. et al. Eotaxin represents the principal eosinophil chemoattractant in an novel murine asthma model induced by house dust containing cockroach allergens. The Journal of Immunology, 2001; 167: 2808-2815.
73. Kips J.P., Anderson G.P., Fredberg J.J. et al. Murine models of asthma. Eur. Respir. J., 2003; 22: 374-382.
74. Kruzel M.L., Bacsi A., Choudhury B. et al. Lactoferrin decreases pollen antigen-induced allergic airway inflammation in a murine model of asthma. Immunology, 2006; 119: 159-166.
75. Kryuchkov N.A., Babakhin A.A., Khaitov M.R., Martinov A.I. Adjuvant-free mouse model of bronchial asthma on causally relevant G6 allergen. II International congress IMD, Moscow, 2007.
76. Kryuchkov N.A., Bashkatova Yu.N., Khaitov M.R., Litvin L.S. IgE Immune response in vivo to timothy grass allergen. XXVII Congress of the European Academy of Allergology and Clinical Immunology, Barcelona, 2008.
77. Kuipers H., Lambrecht B.N. The interplay of dendritic cells, Th2 cells and regulatory T cells in asthma. Curr. Opin. Immunol., 2004; 16: 702-708.
78. Kumar R.K., Foster P.S. Modeling allergic asthma in mice: pitfalls and opportunities. Am. J. Respir. Cell Mol. Biol., 2002; 27: 267-272.
79. Kung T.T., Jones H., Adamas G.K. et al. Characterization of a murine model of allergic pulmonary inflammation. Int. Arch. Allergy Immun., 1994; 105(1): 8390.
80. Lärche M., Robinson D.S., Kay A.B. The role of T-lymphocytes in the pathogenesis of asthma. J. Allergy Clin. Immunol., 2003; 111: 450^463.
81. Leigh R., Ellis R., Wattie J.N. et al. Type 2 cytokines in the pathogenesis of sustained airway disfunction and airway remodeling in mice. Am. J. Respir. Crit. Care Med., 2004; 169: 860-867.
82. Leonardi-Bee J., Pritchard D., Britton J. and the Parasites in Asthma Collaboration. Asthma and current intestinal parasite infection. Systematic review and meta-analysis. Am. J. Respir. Crit. Care Med., 2006; 174(6): 514-523.
83. Lieberman D., Lieberman D., Printz S. et al. Atypical pathogen infection in adults with acute exacerbation of bronchial asthma. Am. J. Respir. Crit. Care Med., 2003; 167(11): 406-410.
84. London S.J. Gene-air pollution interactions in asthma. Proc. Am. Thorac. Soc., 2007; 4:217-220.
85. Mackay I.R., Rosen F.S. Asthma. N. Eng. J. Med., 2001; 344 (5): 350-362.
86. Mayr S.I., Zubery R.I., Liu F.-T. Role of immunoglobulin E and mast cells in murine models of asthma. Brazilian J. of Medical and Biological Research, 2003; 36: 821-827.
87. Mayuzumi H., Ohki Y., Tokuyama K. et al. Age-related difference in the persistency of allergic airway inflammation and bronchial hyperresponsiveness in a murine model of asthma. Int. Arch. Allergy Immunol., 2007; 143(4): 255262.
88. McKinley L., Kim J., Bolgos G.L. et al. Reproducibility of a novel model of murine asthma-like pulmonary inflammation. Clin. Exp. Immunol., 2004; 136: 224-231.
89. McKinley L., Kim J., Bolgos G.L. et al. Allergens induce enhanced broncho-constriction and leukotriene production in C5 deficient mice. Respir. Res., 2006; 7(1): 129.
90. Mizue Y., Ghani S., Leng L. et al. Role for macrophage migration inhibitory factor in asthma. PNAS, 2005; 102(40): 14410-14415.
91. Morgan W.J., Crain E.F., Gruchalla R.S. et al. Results of a home-based environmental intervention among urban children with asthma. N. Eng. J. Med., 2004; 351(11): 1068-1080.
92. Mutius E. Asthma and allergies in rural areas of Europe. Proc. Am. Thorac. Soc., 2007; 4:212-216.
93. Nacak M., Aynacioglu A.S., Filiz A. Association between the N-acetylation genetic polymorphism and bronchial asthma. Br. J. Clin. Pharmacol., 2002; 54: 671-674.
94. Nathanielsz P.W. Animal models that elucidate basic principles of the developmental origins of adult diseases. Neurosci. Biobehav. Rev., 1998; 23(2):345-358.
95. National Research Council. Biomedical Models and Resources: Current Needs and’Future Opportunities. Washington, D.C.: National Academy Press, 1998.
96. National Surveillance for Asthma — United States, 1980—2004. CDC MMWR, 2007: 56(SS08): 1-14; 18-54. Available from: https://www.cdc.gov/mmwr/preview/mmwrhtml/ss5608al.htm.
97. Olman M.A. Epithelial cell modulation of airway fibrosis in asthma. Am. J. Respir. Cell Mol. Biol., 2003; 28: 125-128.
98. Ordonez C.L., Khashayar R., Wong H.H. et al. Mild and moderate asthma is associated with airway goblet cell hyperplasia and abnormalities of mucin gene expression. Am. J. Respir. Crit. Care Med., 2001; 163: 517-523.
99. Ovary Z., Watanabe N. Antigen and antibody detection by in-vivo methods. A revaluation of passive cutaneus anaphylactic reactions. J. Immun. Methods, 1977; 14: 381-390.
100. Paraskakis E., Sourvinos G., Passam F. Microsatellite DNA instability and loss of heterozygosity in bronchial asthma. Eur. Respir. J., 2003; 22: 951-955.
101. Pastorino A.C., Kuschnir F.C., Arruda L.K. et al. Sensitisation to aeroaller-gens in Brazilian adolescents living at the periphery of large subtropical urban centres. Allergol. Immunopathol. (Madr.), 2008; 36(1): 9-16.
102. Pearson T.A., Teri A., Manolio T.A. How to interpret a genome-wide association study. JAMA, 2008; 299(11): 1335-1344.
103. Perzanowski M.S., Ronmark E., Platts-Mills T.A., Lundback B. Effect of cat and dog ownership on sensitization and development of asthma among pre-teenage children. Am. J. Respir. Crit. Care Med., 2002; 166: 696-702.
104. Platts-Mills T., Leung D.Y.M., Schatz M. The role of allergens in asthma. Am. Fam. Physician., 2007; 76: 675-80.
105. Platts-Mills T.A., Vervloet D., Thomas W.R. et al. Indoor allergens and asthma: report of the Third International Workshop. J. Allergy Clin. Immunol., 1997; 100(6 ptl): S2-24.
106. Porrello A., Cardelli P., Spugnini E.P. Pet models in cancer research: general principles. J. Exp. Clin. Cancer. Res., 2004, 23(2): 181-193.
107. Reid L.M. Needs for animal models of human diseases of the respiratory system. Am. J. Pathol., 1980; 101(suppl. 3): S89-101.
108. Reinhardt A.K., Bottoms S.E. Quantitative assessment of subepithelial collagen deposition in the airways of mice following ovalbumin sensitization and intratracheal challenge. Chest, 2003; 123: 428S.
109. Revised Global Burden of Disease (GBD) 2002 Estimates. WHO, 2004. Available from:https://www.who.int/healthinfo/bodgbd2002revised/en/print.html.
110. Richter A., Puddicombe S.M., Lordan J.L et al. The contribution of inter-leukin (IL)-4 and IL-13 to the epithelial-mesenchymal trophic unit in asthma. Am. J. Respir. Crit. Care Med., 2001. 25: 385-391.
111. Roche W.R. Inflammatory and structural changes in the small airways in bronchial asthma. Am. J. Respir. Crit. Care Med., 1998; 157: S191-S194.
112. Rosenstreich D.L., Eggleston P., Kattan M. et al. The role of cockroach allergy and exposure to cockroach allergen in causing morbidity among innercity children with asthma. N. Engl. J. Med., 1997; 336: 1356-1363.
113. Sakai K., Yokoyama A., Kohno N., Hiwada K. Effect of different sensitizing doses of antigen in a murine model of atopic asthma. Clin. Exp. Allergy, 1999; 118: 9-15.
114. Salvato G. Quantitative and morphological analysis of the vascular bed in bronchial biopsy specimens from asthmatic and non-asthmatic subjects. Thorax, 2001; 56: 902-906.
115. Sandford A., Pare P. The genetics of asthma. Am. J. Respir. Crit. Care Med., 2000; 161(Suppl. 3): 202-206.
116. Schuppli C.A., Fraser D., McDonald M. Expanding the three Rs to-meet new challenges in humane animal experimentation. Altern. Lab. Anim., 2004; 32(5): 525-532.
117. Selgrade M.K., Lemanske R.F., Gilmour M. et al. Induction of asthma and the environment: what we know and need to know. Environ. Health Perspect., 2006; 114: 615-619.
118. Seminario M.-C., Guo J., Bochner B. et al. Human eosinophils constitutively express NFATp andNFATc. J. All. Clin. Immunol., 2001; 107: 143-152.
119. Shapiro S.D. Animal Models of Asthma. Pro: Allergic Avoidance of Animal (Models.) Is Not an Option. Am. J. Respir. Crit. Care Med., 2006; 174: 1171— 1178.
120. Shinagawa K., Kojima M. Mouse Model of Airway Remodeling. Strain Differences. Am. J. Respir. Crit. Care Med., 2003; 168: 959-967.
121. Sigurs N., Bjarnason R., Sigurbergsson F., Kjellman B. Respiratory syncytial virus bronchiolitis in infancy is an important risk factor for asthma and allergy at age 7. Am. J. Respir. Crit. Care Med., 2000; 161(5): 1501-1507.
122. Slauson D.O., Hahn F.F. Criteria for development of animal models of diseases of the respiratory system. Am. J. Pathol., 1980; 101(suppl. 3): S103-122.
123. Stankiewicz W., Dabrowski M.P., Chcialowski A., Plusa T. Cellular and cytokine immunoregulation in patients with chronic obstructive pulmonary disease and bronchial asthma. Mediators of Inflammation, 2002; (11): 307-312.
124. Sporik R., Holgate S.T., Platts-Mills T.A., Cogswell J.J. Exposure to house-dust mite allergen (Der p I) and the development of asthma in childhood. A prospective study. N. Engl. J. Med., 1990; 323: 501-507.
125. Sugita M., Kuribayashi K., Nakagomi T. et al. Allergic bronchial asthma: airway inflammation and hyperresponsiveness. Internal medicine, 2003; 42(8): 636-643.
126. Sur S., Lam J., Bouchard P. et al. Immunomodulatory effects of IL-12 on allergic lung inflammation depend on timing of doses. J. Immun., 1996; 157: 4173-4180.
127. Sur S., Wild J.S., Choundhary B.A. et al. Long term prevention of allergic lung inflammation in a mouse model of asthma by CpG oligodeoxynucleotides. J. Immun., 1999, 162: 6284-6293.
128. Swanson K.S., Mazur M.J., Washisht K. et al. Genomics and clinical medicine: rationale for creating and effectively evaluating animal models. Exp. Biol. Med., 2004, 229: 866-875.
129. Swirski F.K., Sajic D., Robbins C.S. et al. Chronic exposure to innocuous antigen in sensitized mice leads to suppressed airway eosinophilia that is reversed by GMC-SF. J. Immunol., 2002; 169: 3499-3506.
130. Synek M., Beasley R., Frew A.J. et al. Cellular infiltration of the airways in asthma of varying severity. Am. J. Respir. Crit. Care Med., 1996; 154: 224230.
131. Taube C., Dakhama A., Takeda K. et al. Allergen-specific early neutrophil infiltration after allergen challenge in a murine model. Chest, 2003; 123: 410S-411S.
132. Taube C., Wei X., Swasey C.H. Mast cells, FcRI, and IL-13 are required for development of airway hyperresponsiveness after aerosolized allergen exposure in the absence of adjuvant. J. of Immunology, 2004; 172: 6398-6406.
133. Taylor P.E., Jacobson K.W., House J.M., Glovsky M.M. Links between pollen, atopy and the asthma epidemic. Int. Arch. Allergy Immunol., 2007; 144(2): 162-70.
134. Torres R., Pocado C., Mora F. Use of the mouse to unravel allergic asthma: a review of the pathogenesis of allergic asthma in mouse models and its similarity to the condition in humans. Arch. Bronconeumol., 2005; 41(3): 141-152.
135. Van Scott M.R., Hooker J.L., Ehrmann D. et al. Dust mite-induced asthma in cynomolgus monkeys. J. Appl. Physiol., 2004; 96: 1433-1444.
136. Vierboom M.P.M., Jonker M., Bontrop R.E., Hart B. Modeling human arthritic diseases in nonhuman primates. Arthritis Res. Ther., 2005, 7: 145-154.
137. Wahl W., Chen W. Transforming growth factor-p-induced regulatory T cells referee inflammatory and autoimmune diseases. Arthritis Res. Ther., 2005; 7: 62-68.
138. Walker C., Kaegi M.K., Braun P., Blaser K. Activated T cells and eosino-philia in bronchoalveolar lavages from subjects with asthma correlated with disease severity. J. Allergy Clin. Immunol., 1991; 88: 935-942.
139. Wild J.S., Sigounas A., Sur N. et al. IFN-g-inducing factor (IL-18) increases allergic sensitization serum IgE, Th2 cytokines, and airway eosinophilia in a mouse model of allergic asthma. J. Immunol., 2000,164: 2701-2710.
140. Yamamoto K., Takanashi S., Hasegawa Y. et al. Eotaxin level in induced sputum is increased in patients with bronchial asthma and in smokers. Respiration, 2003; 70: 600-605.
141. Ying S., O’Connor B., Ratoff J., et al. Thymic stromal lymphopoietin (TSLP) expression is increased in asthmatic airways correlates with expression of Th2-attracting chemokines and disease severity. J. Immunol., 2005; 174: 8183-8190.
142. Ying S., Zhang G., Gu S., Zhao J. How much do we now about atopic asthma: where are we now? Cell. Molec. Immunology, 2006; 3(5): 321-332.
143. Zhang Y., Lamm W.J., Albert R.K. et al. Influence of the route of allergen administration and genetic background on the murine allergic pulmonary response. Am. J. Respir. Crit. Care Med., 1997; 155: 661-669.
144. Zhu Z., Enborning G., Zheng T. et al. Interleukin-13 induces surfactant function abnormality in the murine lung. Chest, 2003; 123; 375-376.
145. Zosky G.R., Sly P.D. Animal models of asthma. Clin. Exp. Allergy, 2007; 37(7): 973-988.
Клинико-морфологическое обоснование периодической гипобарической гипоксической стимуляции в терапии атопической бронхиальной астмы у детей
Создание экспериментальной модели бронхиальной астмы и реализация лечебной коррекции в эксперименте проводилось на 50 половозрелых особей мышей-самцов линии BALB/c весом 18-20 г. При выполнении исследования соблюдались правила биоэтики, утвержденные приказом МЗ СССР №755 от 12.05.1977, а также принципы гуманности, изложенные в директивах Европейского сообщества (86/609/EEC) и Хельсинской декларации по защите позвоночных животных, используемых для лабораторных и иных целей.
Подопытные животные были разделены на две группы: 1-ая группа – 20 мышей с экспериментальной моделью бронхиальной астмы, не получающие лечение методом ПГГС; 2-ая группа – 20 мышей с экспериментальной моделью бронхиальной астмы, получающие лечение методом ПГГС. В качестве контроля использовались 10 интактных животных, находящихся в условиях вивария.
Животные экспериментальных групп сенсибилизировались интраперитонеально двукратным введением 10 мкг овальбумина (Sigma), разведенного в 0,1 мл физиологического раствора, содержащего 2мг Al(OH)3, на 0 и 14 день эксперимента. С 22 по 45 день эксперимента животные через день подвергались ингаляционному введению аэрозоля 1% раствора овальбумина по 30 минут в день с помощью компрессорного небулайзера (Omron C-28). Для осуществления ингаляций аэрозоля аллергена лабораторные животные помещались в камеру объемом 5 литров. С 22 дня эксперимента животные получали лечение методом периодической гипобарической гипоксической стимуляции в условиях экспериментальной барокамеры.
Каждый сеанс гипобаротерапии состоял из подъема, пребывания на «высоте» и спуска. При первом сеансе постепенно снижали барометрическое давление в камере соответственно подъему на высоту 1000 м над уровнем моря, при последующих сеансах прибавлялось по 500 м, доходя до конечной «высоты» 3500 м. На конечной высоте 3500 м над уровнем моря парциальное давление кислорода составляет 460 мм.рт.ст. Скорость подъема составляла 3-5 метров в секунду, спуск осуществлялся со скоростью 1-2 метр в секунду. Курс лечения состоял из 24 сеансов (22-45 дни эксперимента). Все сеансы проводились ежедневно в одно и то же утреннее время суток.
На 14, 21, 45 сутки после начала эксперимента по 5 животных из каждой группы выводились из опыта путем декапитации под нембуталовым наркозом. Для исследования проводился забор фрагментов гипоталамуса, аденогипофиза и нейрогипофиза, надпочечников, тимуса, трахеи, бронхов и легочных структур. Данный материал от экспериментальных и контрольных животных был подвергнут стандартной однотипной гистологической обработке.
Морфофункциональные методы исследования
Для идентификации клеток с признаками апоптоза применяли иммуноцитохимические реакции с моноклональными антителами: на определение экспрессии проапоптического белка р53 и каспазы 3. Кусочки тканей фиксировали в 10% нейтральном формалине, обезвоживали и заливали в парафин. Исследование проводили на серийных парафиновых срезах толщиной 5-6 мкм. Срезы инкубировали с моноклональными антителами к р53 (фирма «Дако», Дания) в рабочем разведении 1:50, каспазы-3 (фирма BioGеnеx, США) в рабочем разведении 1:50. Для выявления иммунного окрашивания использовали стрептавидин-биотиновый пероксидазный метод («Дако», LSAB-kit, Дания), затем осуществляли докрашивание ядер водным гематоксилином Майера.
Материалом для исследования состояния апоптоза у детей послужила периферическая кровь (мазки крови на специальных предметных стеклах для иммуноцитохимических исследований). Для идентификации клеток крови (эозинофилы) с признаками апоптоза применяли определение уровня экспрессии проапоптотического протеина р53 и выявление интрануклеосомной фрагментации ДНК методом TUNEL. Определение белка р53 производилось с помощью моноклональных антител (фирма «Дако», Дания). Для визуализации позитивного (р53) иммунного окрашивания клеток применяли стрептавидин-биотиновый пероксидазный метод с последующим докрашиванием ядер гематоксилином Майера. Для идентификации внутриядерной фрагментации ДНК использовали набор реактивов «Apoptag plus peroxidase in situ apoptosis detection kit» (фирма INTEGREN, Канада) с докрашиванием ядер 0,5% раствором метиленового зеленого. Во всех случаях подсчитывали процент окрашенных клеток на 1000 клеток в случайно выбранных полях зрения.
Для светооптических исследований материал фиксировали в 10% водном растворе нейтрального формалина, спирт-формоле, жидкости Буэна, обезвоживали в спиртах возрастающей концентрации и заливали целлоидин-парафином. Приготовление серийных срезов толщиной 5-6 мкм осуществляли на ротационном микротоме МПС-2. Депарафинированные срезы окрашивали гематоксилином Майэра и эозином. Идентифицировали гликозаминогликаны – толуидиновым синим при значении pH 2,7-3,0, рибонуклеопротеиды – метиленовым зеленым и пиронином «G» по Браше. Гликоген и нейтральные мукополисахариды (гликопротеиды) определяли с помощью перйодат-Шифф реакции по Мак-Манусу. Гистохимические реакции сопровождались соответствующими ферментативными контролями (Пирс Э., 1962).
Для электронномикроскопических исследований материал фиксировали при +4 0 С в 2,5%-м растворе глютарового альдегида на S-коллединовом буфере (pH 7,2-7,4). Постфиксацию проводили в четырехокиси осмия по прописи G.Millonig (1961). Материал обезвоживали при комнатной температуре в ацетоне возрастающей концентрации и помещали в смолу ЭПОН-812. Полимеризацию объектов проводили при +60 0 С в течении 2 суток. С каждого блока на ультратоме LKB-5 (Sweden-Bromma) получали полутонкие (1мкм) и ультратонкие (40-60 нм) срезы. Полутонкие срезы окрашивали метиленовым синим и основным фуксином по прописи M.Sato et E.Shamoto (1973). Полутонкие срезы использовали при подготовке блоков к заточке перед изготовлением ультратонких срезов, а также для анализа тканей и клеточной организации на световом уровне.
Ультратонкие срезы подвергали двойному контрастированию насыщенным спиртовым раствором уранилацетата при температуре +37 0 С в течение 20 минут и цитрате свинца по Reynolds (1963). Срезы изучали на электронном микроскопе ЭМВ 100АК, фотографирование структур проводили при увеличении от х5400 до х40000.
Морфометрическое исследование выполняли на препаратах с использованием стандартной окулярной сетки Автандилова Г.Г. (1990), а также винтового окуляр-микрометра МОВ-1-15хУ4,2. Вычисление площади поверхности ультраструктур осуществляли наложением на электронограмму точечной или квадратной сетки (Стропус Р.А. с соавт., 1976; Якубов А.С., Кац В.А., 1984). Снятие морфометрических параметров проводили путем подсчета точек, попавших на структурные профили.
Полученные результаты статистически оценивали по двустороннему критерию Фишера, t-критерию Стьюдента. Вычисления производились с помощью программного пакета «Statistica 6.0». Данные представлены в виде среднего арифметического по результатам каждого раздела исследования, +/- ошибки средних величин (m). Достоверными считались отличия при р
Использованные источники: 100-bal.ru
научная статья по теме РАЗРАБОТКА БЕЗАДЪЮВАНТНОЙ МОДЕЛИ ХРОНИЧЕСКОЙ БРОНХИАЛЬНОЙ АСТМЫ У МЫШЕЙ Биология
Цена:
Авторы работы:
Научный журнал:
Год выхода:
Текст научной статьи на тему «РАЗРАБОТКА БЕЗАДЪЮВАНТНОЙ МОДЕЛИ ХРОНИЧЕСКОЙ БРОНХИАЛЬНОЙ АСТМЫ У МЫШЕЙ»
IMMUNOPATHOGENETIC MECHANISMS OF INFLAMMATORY
Pirogov Russian National Research Medical University, Moscow, Russia
Today it is critical to study the immunologic mechanisms of autoimmune neuropathies and new opportunities for their early detection and clinical course forecasting, to develop best algorithms of pathogenetic and after-care treatment. The aim of our study is investigation of clinical presentation, neurophysiological tests data, and immunological parameters of CIDP in childhood. Levels of IgG and IgM autoantibodies against gangliosides (asialo- GM1, GM1, GM2, GD1a, GD1b, and GQ1b); interleukins (IL-2, IL-4, IL-10, TNF-a); specific IgG and IgE against myelin basic protein (MBP) and total serum IgE of children with chronic inflammatory demyelinating polyneuropathies (CIDP), multiple sclerosis (MS) with polyneuropathy and hereditary motor and sensory neuropathy (HMSN) Type I were measured for comparative analysis.
Key words: antiganglioside autoantibodies, chronic inflammatory demyelinating polyneuropathy, multiple sclerosis
РАЗРАБОТКА БЕЗАДЪЮВАНТНОЙ МОДЕЛИ ХРОНИЧЕСКОЙ БРОНХИАЛЬНОЙ АСТМЫ У МЫШЕЙ
Шиловский И. П., Бабахин А. А., Прозорова М. С., Гайсина А. Р., Камышников О. Ю., Хаитов М. Р.
Федеральное государственное бюджетное учреждение «
Использованные источники: naukarus.com
Разработка модели экспериментальной IgE-зависимой бронхиальной астмы для изучения новых подходов к аллерген-специфической иммунотерапии Литвин Лолиана Стефановна
Диссертация — 480 руб., доставка 10 минут , круглосуточно, без выходных и праздников
Автореферат — бесплатно , доставка 10 минут , круглосуточно, без выходных и праздников
Литвин Лолиана Стефановна. Разработка модели экспериментальной IgE-зависимой бронхиальной астмы для изучения новых подходов к аллерген-специфической иммунотерапии : диссертация . кандидата медицинских наук : 14.00.36 / Литвин Лолиана Стефановна; [Место защиты: ГП «ГНЦ «Институт иммунологии»»].- Москва, 2007.- 138 с.: ил.
Содержание к диссертации
Глава 1 Обзор литературы 10
Экспериментальные модели бронхиальной астмы (БА) у животных 10
Моделирование бронхиальной астмы у мышей 17
Краткосрочные модели БА 22
Долгосрочные модели БА 24
1.3 Практическое применение моделей БА на мышах 29
Изучение патогенеза БА 29
Использование моделей БА на мышах для доклинических исследований фармакологических препаратов 33
Изучение механизмов аллерген-специфической иммунотерапии (АСИТ) и исследование новых форм лечебных аллергенов 35
Глава 2 Материалы и методы 40
Лабораторные животные 40
Аллергены и основные реагенты, использованные в работе 40
Способы и схемы иммунизации животных 41
Определение аллерген-специфического IgE методом пассивной кожной анафилаксии 47
Твердофазный непрямой иммуноферментный анализ (ИФА) 47
Оценка системной анафилаксии у мышей с экспериментальной IgE-зависимой бронхиальной астмой (ЭБА) и после экспериментальной АСИТ (ЭАСИТ) 48
Гистологическое исследование легких, клеточного состава бронхо-альвеолярного лаважа (БАЛ) и периферической крови у мышей при моделировании ЭБА 49
Исследование клеточного состава периферической крови 49
Методика забора и оценки клеточного состава БАЛ у мышей 49
Гистологическое исследование легких 50
2.8 Методика оценки дыхательной функции мышей на введение
неспецифического и специфического раздражителей 51
Установка для регистрации пневмограмм у мышей 51
Регистрация пневмограмм 55
Анализ пневмограмм 55
2.9 Методы статистической обработки 56
Глава 3 Результаты собственных исследований 58
Оценка различных схем иммунизации ОА при моделировании аллергического воспаления в дыхательных путях мышей 58
Сравнение иммунологических и морфологических показателей при моделировании аллергического ответа в дыхательных путях мышей линии BALB/c и гибридов (СВА х C57BL/6)F1 60
Характеристика разработанной модели ЭБА у мышей 61
Динамика образования аллерген-специфических IgE антител 61
Оценка уровней суммарных аллерген-специфических IgG антител 63
Оценка реакции системной анафилаксии у мышей 64
Оценка клеточного состава периферической крови 66
Оценка клеточного состава БАЛ 68
Гистологическое исследование легких 73
Оценка неспецифической и специфической реактивности бронхов 82
3.4 Оценка ЭАСИТ модельным аллергеном овальбумином (ОА), химически
модифицированным сукцинилированием (сОА) и сОА в комплексе с
иммуномодулятором полиоксидонием (ПО) 90
Сравнительная оценка уровней аллерген-специфических IgE- и IgG-антител до, в течение и после ЭАСИТ 90
Сравнительная оценка клеточного состава периферической крови и БАЛ у мышей после ЭАСИТ 95
Сравнительная оценка морфологической картины легких у мышей после ЭАСИТ 100
Анализ пневмограмм мышей различных групп после ЭАСИТ 106
Сравнительная оценка выраженности системной анафилаксии у мышей после ЭАСИТ . ПО
Глава 4 Обсуждение полученных результатов 112
Глава 5 Выводы 121
Список литературы 123
Перечень условных сокращений:
АСИТ — аллерген-специфическая иммунотерапия
БА — бронхиальная астма
БАЛ — бронхо-альвеолярный лаваж
БСА — бычий сывороточный альбумин
ГР — гиперреактивность бронхов
ГІДА — гомоцитотропные антитела
ИНФ-у — интерферон гамма
ИФА — иммуноферментный анализ
ОП — оптическая плотность
ПКА — пассивная кожная анафилаксия
сОА — сукцинилированный овальбумин
ТФР-р — трансформирующий фактор роста (3
ФСБ — фосфатно-солевой буфер
ЧД — частота дыхания
ЭАСИТ — экспериментальная аллерген-специфическая иммунотерапия
ЭБА — экспериментальная IgE-зависимая бронхиальная астма
Введение к работе
Бронхиальная астма (БА) является наиболее распространенным во всем мире хроническим заболеванием, представляющим значительную социальную проблему, как для детей, так и для взрослых. Очевидно, что за последние 20 лет распространенность этого заболевания заметно возросла, особенно среди детей [49]. По данным эпидемиологического исследования, проведенного в России, общее число больных БА приближается к 7 млн. человек [7]. В номенклатуре, представленной Европейской Академией Аллергологии и Клинической иммунологии, выделяют аллергическую (IgE-зависимая и не IgE-зависимая) и не аллергическую Б А [71]. В большинстве случаев, особенно у детей и молодых людей, развитие БА связано с IgE-опосредованными (атопическнми) механизмами [30]. Участие атопических механизмов доказано у 40% больных БА [114]. Представление о БА как о хроническом воспалительном заболевании дыхательных путей стало важным достижением и определило направление поиска терапевтических подходов для профилактики и контроля воспалительного процесса при БА. Несмотря на широкое применение различных противоастматических и противоаллергических фармакологических препаратов, отмечается повсеместный рост числа больных страдающих этим заболеванием, а также отмечается устойчивая тенденция к увеличению числа больных с тяжелыми формами БА [7].
На современном этапе медицинской науки значительная часть знаний о механизмах лежащих в основе того или иного заболевания получены с использованием экспериментальных моделей, адекватных различным заболеваниям человека. Исследования in vivo, также являются начальным и основополагающим этапом в изучении безопасности и эффективности новых лечебных препаратов. К настоящему времени, по данным зарубежной литературы, уже описаны протоколы индукции моделей бронхиальной астмы у животных, в частности у линейных мышей [17,42]. Большинство протоколов индукции IgE-зависимой бронхиальной астмы предполагает использование
адъювантов. Преимущественное использование мышей для моделирования бронхиальной астмы связано с большим разнообразием реагентов для изучения генетических и иммунных механизмов развития заболевания. Мыши могут быть сенсибилизированы к различным видам аллергенов и развивать аллерген-индуцированное воспаление в дыхательных путях, а также бронхиальную гиперреактивность. Существуют определенные сходства между параметрами моделей аллергической бронхиальной астмы мышей и характеристиками бронхиальной астмы человека, заключающиеся в морфологических изменениях дыхательных путей и ткани легких, в характере антительного ответа, а также участвующих в развитии и поддержании аллергического воспаления эффекторных клеток и молекул [25]. Анализ отечественной научно-практической литературы привел к заключению об отсутствии данных о разработке и использовании для доклинических исследований адекватной модели аллергической (IgE-зависимой) бронхиальной астмы у мышей. Поэтому, разработка экспериментальной модели бронхиальной астмы является актуальной и перспективной в нашей стране.
Разработка модели БА на мышах позволит в дальнейшем изучать механизмы, приводящие к развитию заболевания, оценивать безопасность и эффективность новых лечебных препаратов перспективных для лечения и профилактики БА.
Единственным к настоящему времени методом терапии аллергических
заболеваний атопической природы, воздействующего на все патогенетически
значимые звенья аллергического процесса и обладающего длительным
противоаллергическим эффектом, является аллерген-специфическая
иммунотерапия (АСИТ) [92]. В настоящее время разрабатываются и внедряются не только новые способы ее проведения, но и новые формы лечебных аллергенов. Такие аллергены должны обладать сниженной аллергенной и сохраненной иммуногенной активностью [4]. Это может быть достигнуто модификацией аллергенов, в том числе химической, а также использованием разнообразных природных и синтетических носителей — адъювантов [2,10,64].
Очевидно, что для доклинического изучения свойств гипоаллергенных вакцин и их терапевтической эффективности целесообразно использовать модель IgE-зависимой бронхиальной астмы у мышей. Проведение доклинических исследований новых форм аллергенов на модели ЭБА с использованием принципа АСИТ может всесторонне охарактеризовать влияние аллерговакцины на манифестацию и течение IgE-зависимой БА.
Цель работы: разработать и охарактеризовать краткосрочную модель IgE-зависимой бронхиальной астмы у мышей и оценить возможность ее применения для доклинических исследований новых подходов к АСИТ.
Разработать схему моделирования IgE-зависимой БА у мышей путем введения модельного аллергена овальбумина (ОА) без использования адъюванта;
Изучить динамику накопления аллерген-специфических IgE- и IgG-антител в ходе моделирования ЭБА;
Провести оценку клеточного состава бронхо-альвеолярного лаважа (БАЛ) и периферической крови у мышей с ЭБА;
Провести гистологическое исследование легких у мышей с ЭБА;
Оценить бронхиальную реактивность у мышей с ЭБА;
Провести сравнительную оценку выраженности системной анафилаксии у мышей с ЭБА;
Провести сравнительную ЭАСИТ ^модифицированным, модифицированным (сукцинилированием) аллергеном и комплексом модифицированного аллергена с полиоксидонием на модели ЭБА;
Изучить динамику накопления аллерген-специфических IgE- и IgG-антител в ходе и позавершении ЭАСИТ;
Провести оценку клеточного состава БАЛ и периферической крови у мышей после ЭАСИТ;
10. Провести гистологическое исследование легких у мышей после ЭАСИТ;
11.Оценить бронхиальную реактивность у мышей после ЭАСИТ;
12.Провести сравнительную оценку выраженности системной анафилаксии у
мышей после ЭАСИТ. Научная новизна работы:
Впервые в России разработана и охарактеризована краткосрочная модель IgE-зависимой бронхиальной астмы у мышей без использования адъюванта.
Впервые в России проведено исследование дыхательной функции мышей в ответ на введение неспецифического раздражителя метахолина.
Впервые на модели IgE-зависимой бронхиальной астмы у мышей проведена экспериментальная аллерген-специфическая иммунотерапия химически модифицированным аллергеном.
Показано преимущество ЭАСИТ комплексом модифицированного аллергена и иммуномодулятора полиоксидония по сравнению с ЭАСИТ только модифицированным или немодифицированным аллергеном. Практическая значимость:
Разработанная краткосрочная модель IgE-зависимой бронхиальной астмы у мышей позволит оценивать безопасность и эффективность новых форм лечебных аллергенов и фармакологических препаратов, перспективных для профилактики и лечения IgE-зависимых заболеваний, в частности атопической бронхиальной астмы.
Экспериментальная модель IgE-зависимой бронхиальной астмы также может быть использована для изучения патогенетических механизмов лежащих в основе развития этого заболевания.
Использованные источники: www.dslib.net
загрузка…