Хроническая постгеморрагическая анемия рекомендации по лечению
Анемию или малокровие провоцируют разные явления и нездоровые состояния. Снижение количество гемоглобина и эритроцитов в крови можно считать симптомом и последствием какого-либо недуга. Так постгеморрагическая анемия возникает после острой кровопотери, кровоизлияния или как реакция на хронические патологические состояния.
Что значит постгеморрагическая анемия?
Под термином анемия понимают синдром, при котором концентрация гемоглобина в крови по каким-то причинам снижена.При этом понижено и количество эритроцитов (не всегда).Анемия, возникающая после кровотечения, называетсяпостгеморрагическая. Она возникает при кровопотере – геморрагии – на любых участках организма. Уменьшение объема циркулирующей крови приводит к компенсаторным реакциям: рефлекторному спазму сосудов, возбуждению нервной системы, снижению АД. Симптомы и течение патологического состояния различаются в зависимости от причин.
Постгеморрагическая анемия – причины
Чтобы возникла анемия, должна произойти значительная потеря циркулирующей крови в полость тела или во внешнюю среду. Это приводит к сдвигам кислотно-основного состояния, гипоксии, дисбалансу ионов в клетках. Этиология: травмы, легочное кровотечение или геморрагия из-за заболеваний. Патология различается по скорости кровопотери.Виды постгеморрагической анемии: острая и хроническая.
Острая постгеморрагическая анемия
После обильных и внезапно возникающих кровотечений развивается острая постгеморрагическая анемия, причиныее называют разные:
- травмы, вызвавшие нарушение целостности сосудов;
- внутренние кровотечения при поражении легких, ЖКТ, матки, сердца, селезенки;
- разрывы аорты, инфаркты;
- осложнения родов или операций;
- язвы желудка.
Острую анемию легче обнаружить, так как после проведения хирургического вмешательства и серьезных травм за состоянием пациента пристально наблюдают. Клиническая картина патологии зависит от объема потерянной крови. Постгеморрагическая острая анемия опасна для жизни, когда потеря крови составляет больше 30% от ее общего объема.
Хроническая постгеморрагическая анемия
Необильные длительные кровотечения приводят к развитию хронического малокровия. Провоцируют их различные патологии и состояния, приводящие к разрыву стенок сосудов. Сюда относят:
- геморрой;
- почечные и маточные кровотечения;
- венозный застой крови;
- язвенная болезнь в желудке, кишечнике;
- рак;
- геморрагический диатез;
- возникает анемия после кровотечения менструального, при нарушении цикла.
Симптомы постгеморрагической анемии

Обильная и быстрая кровопотеря заметно сказывается на состоянии человека. Кожные покровы бледнеют, ощущается слабость, головокружение, сухость во рту, появляются «мушки» перед глазами. Давление падает, снижается температура тела, холодеют руки и ноги. Патологические изменения заметны на этапе диагностики.
Если развилась острая постгеморрагическая анемия, картина крови следующая:
- цветовой показатель низкий, от 0,6 до 0,4;
- эритроциты изменены (полихромазия, анизоцитоз и пр.), образуются их дегенеративные формы (шизоциты, микроциты);
- уровень железа в плазме понижен.
Имеет постгеморрагическая анемия степени тяжести. У каждой – отличительные признаки, и чем серьезнее недуг, тем ярче выражены симптомы. Для хронической анемии легкой степени характерны такие симптомы:
- одышка;
- потускнение волос;
- ломкость ногтей;
- повышенное потоотделение;
- кариес, язвы во рту;
- раны на теле долго заживают;
- сухость и бледность кожи.
Стадии постгеморрагической анемии
Уровень гемоглобина при малокровии резко падает, и недуг (острый или хронический) проходит несколько стадий.
Постгеморрагическая анемия классифицируется по степени тяжести:
- Легкая, когда уровень гемоглобина ниже нормальных 130-160 г/л, но выше 90 г/л.
- Средняя степень с гемоглобиномв пределах 90—70 г/л.
- Тяжелая, значение Hb менее 70 г/л.
Кроме того, выделяют три стадии в развитии острой постгеморрагической анемии по периодам:
- рефлекторно-сосудистая;
- гидремическая;
- костномозговая.
Компенсаторные реакции при постгеморрагической анемии

На каждом из трех периодов развития острой анемии (представленных выше) патология проходит одну из компенсаторных стадий, характеризующихся особыми симптомами. Организм пытается справиться с обильной или резкой кровопотерей и включает защитные реакции.
Признаки постгеморрагической анемии острого характера:
- В первые 24 часа, на рефлекторной стадии, кровь перераспределяется по органам. Симпатико-адреналовая система (СНС) находится в повышенном возбуждении, происходит спазм сосудов, и кровь приливает к головному мозгу и сердцу. Симптоматика: бледность, снижение АД, тахикардия.
- На гидремической стадии, которая наступает на вторые сутки после кровотечения, больной может находиться несколько дней. В этот период организм создает базу для поступления в сосуды кровотока межтканевой жидкости. Печень усиленно производит белки.
- На костномозговой стадии (4-5 сутки после кровопотери) повышаться уровень эритропоэтина, вырабатываемого почками. В красном костном мозге активно вырабатываются молодые тельца эритроцитов и лейкоцитов, но уровень железа в крови резко падает. Если кровопотерю не остановить, у человека разовьется шоковое состояние.
Осложнения постгеморрагической анемии
Анемия, возникшая после кровотечения – прогрессирующая патология. Тяжелая стадия недуга может привести к смерти, а острая форма – стать причиной коллапса и шока. Признаки его
:
- судороги;
- снижение АД;
- нитевидный пульс;
- поверхностное дыхание;
- рвота;
- обморок.
Последствия развития хронической патологии для человека:
- Снижение иммунитета.
- Патологии органов ЖКТ, дыхательной системы.
- У детей – остановка в развитии, росте.
- Если имеет местопостгеморрагическая анемия, инфекционные осложнения могут привести к подавлению эритропоэза и развитию гипопластической анемии.
Лечение постгеморрагической анемии
Адекватная терапия заболевания начинается с правильной постановки диагноза, анализа клинических данных, инструментальных исследований: проверки крови и урины, УЗИ, пункции костного мозга. К лабораторным признакам постгеморрагической анемии относят лейкопению с небольшим лимфоцитозом, понижение уровня железа. Проводя исследования, врач должен выяснить, что стало причиной малокровия, чтобы назначенная терапия избавила и от этой патологии.
Схема лечения анемии следующая:
- Остановить кровопотерю, выявив и устранив провокатора.
- Восполнитьобъем и уровень плазмы.
- Провести медикаментозное лечение, чтобы восполнить уровень железа.
- Поддерживать правильный режим питания. Употреблять продукты с высоким содержанием железа, фолиевой кислоты, витаминов В12, С.
Постгеморрагическая анемия – клинические рекомендации
Постгеморрагическая анемия легкой степениимеет хороший прогноз. Реабилитация быстрая, и после того, как провоцирующее кровотечение устранено, пациенту прописывают железосодержащие препараты, витамины и диетотерапию. Острая анемия лечится в условиях стационара сразу после оказания срочной помощи. При сильном падении давленияструйным введениемпереливают заменитель крови. С диагнозом постгеморрагическая анемия анализ крови покажет, каких компонентов не хватаетв плазме.
Чтобы восполнить кровяной объем проводится инфузионно-трансфузионная терапия:
- Пациенту в зависимости от кровопотери переливаются компоненты крови и растворы.
- В дальнейшем прописан прием железосодержащих препаратов.
- Желательно употреблять лекарства вместе с аскорбиновой кислотой для лучшей усвояемости железа.
Постгеморрагическая анемия – лечение, препараты
Лечение медикаментами анемии после кровотечения возможно в комплексе только после устранения причины патологии. Хроническая постгеморрагическая анемия средней степени тяжести и острые стадии в ремиссии (после операции) разрешает терапию следующими препаратами:
- железосодержащие таблетки или инъекции – Ферроплекс, Конферон, Ферамид;
- кристаллоиды – Трисоль, Дисоль;
- коллоиды – Альбумин;
- гормональные средства для купирования шока – Дексаметазон, Преднизалон;
- минеральные комплексы, витамины – аскорбиновая кислота, Нейробион;
- при необходимости – иммунодепрессанты Азатиоприн, Циклоспорин.
Пациенты, у которых развилась постгеморрагическая анемиявследствие хронического заболевания или острой кровопотере, должны находиться под контролем специалистов. Диагноз легко поставить, когда кровотечение внешнее. В случае когда провоцирует анемию патология (разрыв, повреждение) внутренних органов, важно провести своевременную диагностику, пока поражение не достигло максимальных значений. Дефицит объема циркулирующей крови 50% и более ставит неблагоприятные прогнозы, но рациональная терапия позволяет устранить патологию в короткие сроки.
Источник
Железодефицитная анемия (ЖДА) представляет собой клинико–гематологический синдром, возникающий при развитии дефицита железа вследствие различных патологических (физиологических) процессов и характеризующийся снижением уровня гемоглобина (в меньшей степени эритроцитов) наряду с клиническими признаками анемии и сидеропении.
Клинические рекомендации ведения больных ЖДА включают: – выявление причины ЖДА и при необходимости – ее коррекция; – обучение больных ЖДА; – принятие решения о назначении лекарственных препаратов железа (ПЖ); – выбор лекарственного ПЖ; – путь введения ПЖ (внутрь или парентерально); – длительность лечения и необходимость поддерживающей терапии; – контроль переносимости ПЖ и коррекция при плохой переносимости; – оценку эффективности и выявление причин отсутствия или недостаточного эффекта; – коррекцию выявленных причин неэффективности.
Выявление причины ЖДА и возможности ее коррекции
После верификации железодефицитного характера анемии, т.е. синдрома ЖДА, необходимо выявление причины, лежащей в основе данного варианта анемического синдрома (нозологическая диагностика). Для клинициста этот этап является не менее важным и вместе с тем наиболее трудным и ответственным, поскольку в основе имеющейся ЖДА могут лежать потенциально курабельные заболевания. Наличие в МКБ–10 рубрики «Железодефицитная анемия неуточненная» оставляет для врача «лазейку» в случаях отсутствия явной причины анемии, «освобождая» его от тщательности и углубления диагностического поиска на этапе нозологической диагностики. Следует особо подчеркнуть роль врача–интерниста на этапах синдромной и нозологической диагностики, поскольку подавляющее большинство больных ЖДА (независимо от конкретной причины) обращаются прежде всего, как и многие другие пациенты, к терапевту, а не к гематологу или другому специалисту. При выявлении причины ЖДА лечение должно быть направлено на устранение этой причины (по возможности) или коррекцию имеющихся нарушений – лечение эрозивно–язвенных процессов в желудке, оперативные лечения при опухолях ЖКТ, миоме матки, лечение энтеритов, коррекция алиментарной недостаточностии т.д.
Обучение больных
Существенным компонентом ведения больных ЖДА является повышение их образовательного уровня в отношении данной патологии, создание мотивации к лечению, вовлечение пациентов в контроль за своим состоянием и лабораторными показателями. Необходимо разъяснение сущности ЖДА, причин ее возникновения, реальных возможностей коррекции дефицита железа и нормализации уровня гемоглобина. Особое значение имеют обучающие программы у беременных женщин с наличием ЖДА и пациенток, страдающих меноррагиями. У беременных должна создаваться мотивация необходимости коррекции дефицита железа с целью предотвращения недостатка железа у плода. Больные должны быть осведомлены о возможных побочных эффектах при лечении лекарственными препаратами железа, необходимости соблюдения врачебных назначений, в том числе и регулярности приема ПЖ. Следует обязательно указать на недопустимость попыток коррекции дефицита железа с помощью различных пищевых продуктов, а также на строгие показания к назначению инъекционных форм ПЖ.
Принятие решения о назначении лекарственных препаратов железа
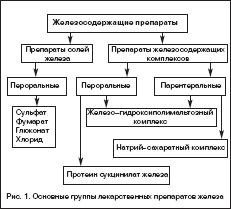
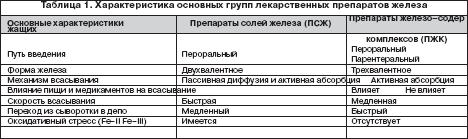
Всем больным ЖДА показана патогенетическая терапия препаратами железа. Следует подчеркнуть ошибочность мнения о возможности коррекции дефицита железа с помощью пищевых продуктов с высоким содержанием железа, что является одним из мифов в представлениях о ведении больных ЖДА. Об этом должны быть осведомлены больные, что следует считать важным образовательным компонентом ведения данной категории пациентов. Разумеется, пища должна быть богата продуктами, содержащими железо. Однако следует иметь в виду неодинаковую степень всасываемости железа из различных продуктов. Так например, железо, содержащееся в мясе в виде гема, всасывается на 40–50%, в то время как из растительных продуктов, овощей, фруктов всасывается всего 3–5% содержащегося в них железа. Поэтому средством выбора для коррекции дефицита железа и уровня гемоглобина у больных ЖДА являются лекарственные препараты железа. На фармацевтическом рынке России в настоящее время имеется большой арсенал ПЖ в различных лекарственных формах, с неодинаковым содержанием в них железа, наличием дополнительных компонентов, влияющих на биодоступность железа, различной стоимостью (рис. 1). Из ПСЖ железо всасывается в двухвалентной форме, в последующем превращается в трехвалетное, которое связывается с трансферрином и используется для построения молекулы гемоглобина. В ПЖК железо находится в трехвалентной форме и всасывается как бы в готовом виде. В ПЖК, в частности, в гидрооксиполимальтозном комплексе, связано как в физиологическом состоянии в молекуле ферритина. Существуют различия в механизмах всасывания железа из ПСЖ и ПЖК. Всасывание железа из ПСЖ происходит главным образом в виде пассивной диффузии согласно градиенту концентрации и в меньшей степени активно, в то время как абсорбция железа из ПЖК является активным процессом в виде конкурентного обмена. Это ведет к различному уровню железа в сыворотке, объему распределения, константам элиминации после абсорбции. Всасывание железа из ПЖК и нарастание его концентрации в сыворотке происходит медленно, но оно быстро поступает в запасы. При применении ПСЖ могут возникать нарушения окислительных процессов (оксидативные повреждения) вследствие превращения ионов двухвалентного железа в трехвалентное, которое соединяется с трансферрином и включается в молекулу гемоглобина. При окислении образуются свободные радикалы, которые вызывают клеточные повреждения, такие как перекисное окисление липидов, нарушение структуры мембранных и клеточных белков, повреждение клеточной ДНК и РНК. ПЖК в отличие от ПСЖ не вызывают «оксидативного стресса», поскольку ионы железа не меняют свою валентность в процессе всасывания (табл. 1). Для лучшей абсорбции ПСЖ рекомендуется принимать за час до еды т.е. на пустой желудок, что может вызывать нарушения со стороны желудка, кишечника и другие побочные эффекты. Современные технологии производства препаратов железа позволяют производить ПСЖ с замедленным высвобождением железа в тонком кишечнике, что уменьшает токсическое воздействие ионов железа на слизистую желудка. Частота побочных эффектов при лечении ПЖК меньше по сравнении с ПСЖ, что обеспечивает лучший комплайенс больных ЖДА. ПСЖ взаимодействуют с некоторыми пищевыми продуктами (танин, фитаты, соли кальция) и медикаментами (пленкообразующие препараты, тетрациклины, препараты кальция), снижающими биодоступность железа. В связи с этим ПСЖ не следует принимать одновременно с указанными пищевыми продуктами и лекарственными препаратами. В то же время пища и медикаменты не оказывают влияния на всасывание железа из ПЖК. Темпы прироста показателей гемоглобина при применении ПСЖ и ПЖК примерно одинаковые.
Путь введения препаратов железа
В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь. Путь введения ПЖ у больных ЖДА определяется конкретной клинической ситуацией, в частности, состоянием кишечного всасывания и переносимостью пероральных ПЖ.
Основными показаниями для парентерального введения ПЖ являются: – патологии кишечника с нарушением всасывания (различные энтериты, синдром недостаточности всасывания); – резекция тонкой кишки; – резекция желудка по Бильрот II с формированием «слепой петли»; – эрозивно–язвенные процессы в желудке (обострение язвенной болезни и др.); – непереносимость ПЖ для приема внутрь. Многие врачи обосновывают назначение парентеральных ПЖ выраженностью анемического синдрома в расчете на якобы больший их эффект, что также не имеет достаточных оснований и не подтверждается клинической практикой. Темпы прироста уровня гемоглобина при назначении ПЖ внутрь и парентерально оказались приблизительно одинаковыми, в связи с чем предпочтение ПЖ в инъекционных формах при необходимости более быстрой нормализации содержания гемоглобина (например, при подготовке к оперативному вмешательству) следует считать неоправданным. ПЖ для парентерального введения могут назначаться при плохой переносимости пероральных ПЖ, однако большинство современных ПСЖ и ПЖК переносятся сравнительно удовлетворительно. В связи с этим принятие решения о назначении парентерального ПЖ должно осуществляться только после ряда «врачебных маневров» (снижение дозы ПЖ, прием вместе с пищей, смена ПЖ для приема внутрь и т.д.).
Выбор лекарственного препарата железа
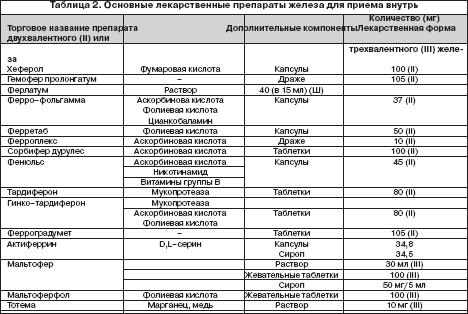
Выбор ПЖ и оптимального режима его дозирования должен определяться количеством и биодоступностью содержащегося в нем железа, переносимостью, стоимостью. При этом необходимо иметь в виду, что адекватный прирост показателей гемоглобина у больных ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг элементарного железа . Учитывая, что при развитии ЖДА всасывание железа увеличивается по сравнению с нормой и составляет 25–30% (при нормальных запасах железа – всего 3–7%), необходимо назначать от 100 до 300 мг элементарного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. С учетом этого при выборе ПЖ следует ориентироваться не на содержание в нем общего количества соединения железа, а на количество элементарного железа. Например, при назначении препаратов сульфата железа с низким содержанием элементарного железа (менее 100 мг) количество принимаемых таблеток должно быть от 3 и выше (в зависимости от содержания железа в каждой таблетке), в то время как препараты сульфата, фумарата или гидроксиполимальтозного комплекса железа с содержанием 100 мг элементарного железа можно принимать в количестве 1–2 таблеток в сутки. Основные ПСЖ представлены сульфатом железа, глюконатом, хлоридом, фумаратом, глицин сульфатом. Наибольшей степенью абсорбции обладают препараты сульфата железа, а наименьшей – глицин сульфата. Многие из ПСЖ содержат вещества, например, аскорбиновую кислоту, усиливающие всасывание железа и улучшающие биодоступность препарата, а также витамины (фолиевую кислоту, цианкобаламин). Среди ПЖК на отечественно рынке имеются гидроксиполимальтозный комплекс, железо–сорбитоловый комплекс, протеин сукцинилат железа, железо–сахарозный комплекс. К новым высокоэффективным и безопасным препаратам железа относятся препараты, представляющие собой неионные соединения железа на основе гидроксиполимальтозного комплекса (ГПК) трехвалентного железа. Структура комплекса состоит из многоядерных центров гидроксида Fe (III), окруженных нековалентно связанными молекулами полимальтозы. Комплекс имеет большой молекулярный вес, что затрудняет его диффузию через мембрану слизистой кишечника. Химическая структура комплекса максимально приближена к структуре естественных соединений железа с ферритином. Абсорбция железа в виде ГПК имеет принципиально иную схему по сравнению с его ионными соединениями и обеспечивается поступлением Fe (III) из кишечника в кровь путем активного всасывания. Неионная структура комплекса обеспечивает его стабильность и перенос железа с помощью транспортного белка, что предотвращает в организме свободную диффузию ионов железа, т.е. прооксидантные реакции. Данные по безопасности, полученные во время клинических исследований препарата железа на основе гидроксида Fe (III) с полимальтозой, свидетельствуют о более низкой частоте побочных эффектов по сравнению с солевыми препаратами железа. Для лучшей переносимости ПСЖ следует принимать во время еды, хотя следует иметь в виду, что всасывание железа лучше при приеме лекарственных препаратов перед едой. Всасываниежелеза может уменьшаться под влиянием содержащихся в некоторых пищевых продуктах веществ – фитинов (рис, соя), фосфатов (рыба, морепродукты), танина (чай, кофе). Многие больные склонны запивать лекарства чаем, что в случаях приема ПЖ в виде солей недопустимо, поскольку образуются плохо растворимые комплексы с низкой их абсорбцией в кишечнике. Кроме того, всасывание железа из ПЖ в виде солей ухудшается при одновременном приеме ряда медикаментов (тетрациклины, антациды, соли магния). С учетом этого следует рекомендовать прием препаратов солей железа в различное время с другими вышеуказанными медикаментами. Препараты ПЖК, в частности, гидроксиполимальтозный комплекс лишены подобных недостатков, поскольку пищевые продукты и медикаменты не оказывают влияние на всасываемость железа (в виде трехвалентной формы) из железосодержащих комплексов. В таблице 2 представлены основные зарегистрированные в России лекарственные ПСЖ и ПЖК для приема внутрь.
Оценка эффективности лечения
В случаях назначения ПЖ в достаточной дозе на 7–10–й день от начала лечения наблюдается повышение количества ретикулоцитов. Достоверное повышение уровня гемоглобина отмечается через 3–4 нед. от начала лечения. Нормализация показателей гемоглобина обычно происходит в сроки 4–9 нед. Иногда наблюдается резкое скачкообразное повышение гемоглобина. Эти индивидуальные колебания могут быть обусловлены, с одной стороны, выраженностью ЖДА, степенью истощения запасов железа, а с другой – эффективностью назначенного ПЖ (количество содержащегося железа, биодоступность и др.). Имеет также значение некомплаентность больных (нерегулярность приема ПЖ, побочные эффекты).
Длительность лечения и поддерживающая терапия
Оптимальная тактика ведения больных ЖДА предполагает насыщающую и поддерживающую терапию ПЖ. Длительность насыщающей терапии зависит от темпов прироста и сроков нормализации показателей гемоглобина, составляя в среднем 4–6 недель. Поддерживающая терапия показана в тех ситуациях, когда причина дефицита железа сохраняется (меноррагии, беременность) или в силу различных ситуаций является трудноустранимой (патология кишечника, носовые и другие кровотечения при геморрагических диатезах). Женщинам, страдающим ЖДА на фоне меноррагий, после нормализации показателей гемоглобина рекомендуется поддерживающая терапия ПЖ в течение 5–7 дней после очередной менструации. Больным надо разъяснять необходимость поддерживающего лечения в связи с продолжающимися избыточными потерями железа. Беременные с ЖДА должны получать ПЖ до конца беременности в целях обеспечения адекватной потребности плода в железе.
Переносимость препаратов железа
Среди побочных эффектов на фоне применения ПЖ внутрь наиболее часто возникают тошнота, анорексия, металлический вкус во рту, запоры, реже – поносы. Развитие запоров обусловлено, по всей вероятности, связыванием в кишечнике сероводорода, являющегося одним из стимулов кишечной перистальтики. В большинстве случаев современные ПЖ вызывают незначительные побочные явления, не требующие их отмены и перехода на парентеральный путь введения. Диспептические расстройства могут уменьшаться при приеме препаратов после еды или уменьшения суточной дозы препарата. Чаще побочные эффекты регистрируютсяпри приеме ПСЖ, в то время как препараты ПЖК (гидроксиполимальтозный комплекс) переносятся лучше и имеют в связи с этим определенные преимущества. В случаях сохраняющейся плохой переносимости пероральных ПЖ показано назначение ПЖ парентерально (внутримышечно или внутривенно). На фоне лечения парентеральными ПЖ, особенно для внутривенного введения, могут возникать аллергические реакции в виде крапивницы, лихорадка, флебиты, анафилактический шок. Кроме того, при внутримышечном введении ПЖ возможно потемнение кожи в местах инъекций, инфильтраты, абсцессы. Если ПЖ для парентерального введения назначают больным гипохромной анемией, не связанной с дефицитом железа, имеется повышенный риск возникновения тяжелых нарушений из–за «перегрузки» железом различных органов и тканей (печень, поджелудочная железа и др.) с развитием гемосидероза.
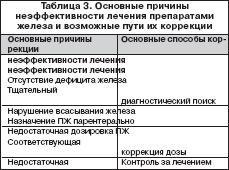
Причины неэффективности лечения препаратами железа
В случае отсутствия или недостаточного эффекта от лечения ПЖ следует выяснить причину с целью возможности ее коррекции. Возможные причины неэффективности лечения ПЖ и способы их коррекции представлены в таблице 3. Необходима убежденность в правильной трактовке всех клинико–лабораторных признаков и в достоверности синдрома ЖДА. Причиной отсутствия или недостаточной эффективности ПЖ может быть недостаточная суточная доза железа, что обычно связано с назначением ПЖ с низким содержанием в нем железа и малым количеством принимаемых таблеток. Так, например, при лечении препаратом, в котором содержится всего лишь 10 мг двухвалентного железа, число принимаемых таблеток должно быть не менее 10 в сутки. Такой режим дозирования неудобен для больных, чем и объясняется, вероятнее всего, невыполнение ими врачебного назначения. С учетом вышесказанного для обеспечения комплаентности следует назначать ПЖ с высоким содержанием железа (не менее 100 мг). Препараты с низким содержанием железа целесообразно использовать в педиатрической практике. Одной из причин неэффективности ПЖ при назначении внутрь может быть нарушение всасывания железа, в частности, у больных с невыявленной или недооцененной кишечной патологией. В этих случаях показано назначение парентеральных ПЖ. В ряде случаев вследствие улучшения самочувствия больные начинают нерегулярно принимать ПЖ или вообще прекращают лечение. В результате показатели гемоглобина не достигают нормальных значений и ЖДА при этом остается фактически недолеченной. С учетом этого длительность насыщающей терапии ПЖ должна определяться сроками достижения нормального уровня гемоглобина, что требует постоянного лабораторного мониторинга. Ряд больных не всегда выполняют назначение врача (регулярность приема ПЖ, достаточная продолжительность и т.д.). В некоторых случаях это может быть обусловлено развитиемпобочных эффектов от ПЖ и самостоятельным прекращением лечения. Поэтому необходим контроль за лечением, эффективностью, переносимостью ПЖ со стороны врача, среднего медперсонала, родственников больных. Отсутствие эффекта от ПЖ может быть связано с неустраненными причинами ЖДА, среди которых клинически наиболее значимыми являются скрытые кровопотери из желудочно–кишечного тракта, чаще из кишечника (невыявленная опухоль!). С учетом этого в подобных ситуациях при исключении других возможных причин неэффективности ПЖ необходимо тщательное эндоскопическое исследование кишечника (в ряде случаев – повторное). Таким образом, у больных ЖДА наряду с устранением причины обязательна патогенетическая терапия ПЖ (ПСЖ и ПЖК), которые должны назначаться преимущественно внутрь. Тактика лечения ПЖ предусматривает выбор пути введения ПЖ с учетом клинической ситуации, оптимального ПЖ с достаточным содержанием в нем железа, оценку эффективности и переносимости препарата, длительность насыщающей и обоснованность поддерживающей терапии. Своевременная верификация синдрома ЖДА и выявление ее причины, адекватная патогенетическая терапия с назначением ПЖ с оптимальными фармакокинетическими свойствами, клинической эффективностью, переносимостью позволяет корригировать анемический синдром и обеспечивать достаточный уровень качества жизни у данной категории пациентов.
Источник