Глюкозо 6 фосфат анемия
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 октября 2013;
проверки требуют 7 правок.
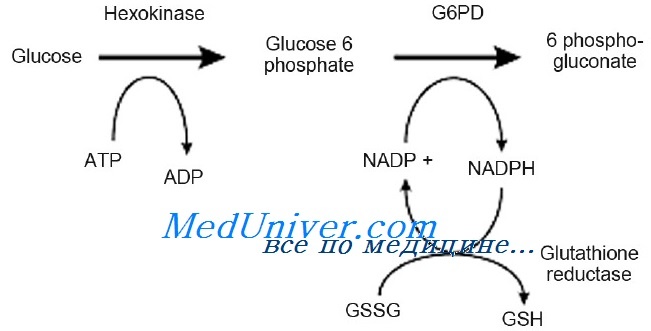
Глюкозо-6-фосфат дегидрогеназа (Г6ФД; G6PD) — цитозольный фермент, входящий в пентозофосфатный путь, метаболический путь, обеспечивающий образование клеточного НАДФ-H из НАДФ+. НАДФ-H необходим для поддержания уровня восстановленного глутатиона в клетке, синтеза жирных кислот и изопреноидов. У человека наследственное нарушение активности Г6ФД, или недостаточность глюкозо-6-фосфатдегидрогеназы, приводит к гемолитической несфероцитарной анемии.
Реакция[править | править код]
Основная катализируемая реакция:
D-глюкозо-6-фосфат + NADP+ ↔ D-глюконо-1,5-лактон-6-фосфат + NADPH
Глюкозо-6-фосфатдегидрогеназа — первый фермент пентозофосфатного гликолиза. Основная функция фермента заключается в восстановлении НАДФ до НАДФН, необходимого для перехода окисленного глутатиона (GSSG) в восстановленную форму. Восстановленный глутатион (GSH) требуется для связывания активных форм кислорода (перекисей). Пентозофосфатный гликолиз обеспечивает клетку энергией.
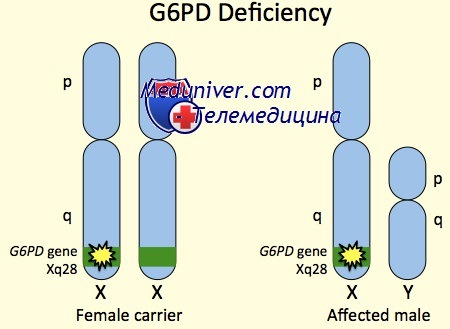
Недостаточность активности фермента снижает энергетические запасы клетки и приводит к развитию гемолиза, тяжесть которого зависит от количества и варианта глюкозо-6-фосфатдегидрогеназы. В зависимости от тяжести дефицита выделяют 3 класса вариантов Г-6-ФД. Дефицит глюкозо-6-фосфатдегидрогеназы сцеплен с Х-хромосомой, наследуется рецессивно. Больные мужского пола всегда гетерозиготны, женского — гомозиготны.
Наиболее важная функция пентозного цикла состоит в обеспечении достаточного образования восстановленного никотинамидадениндинуклеотидфосфата (НАДФ) для превращения окисленной формы глутатиона в восстановленную. Этот процесс необходим для физиологической дезактивации соединений окислителей, таких как перекись водорода, накапливающихся в эритроците. При снижении уровня восстановленного глутатиона или активности глюкозо-6-фосфатдегидрогеназы, необходимого для поддержания его в восстановленной форме, под влиянием перекиси водорода происходит окислительное денатурирование гемоглобина и белков мембраны. Денатурированный и преципитированный гемоглобин находится в эритроците в виде включений — телец Гейнца-Эрлиха. Эритроцит с включениями быстро удаляется из циркулирующей крови либо путём внутрисосудистого гемолиза, либо тельца Гейнца с частью мембраны и гемоглобина фагоцитируются клетками ретикулоэндотелиальной системы и эритроцит приобретает вид «надкусанного» (дегмацит).
Структура[править | править код]
Фермент состоит из 515 аминокислот (молекулярная масса 59,3 кДа). Находится в димерной или тетрамерной форме.
Изоформы[править | править код]
Существует 2 изоформы фермента: короткая и длинная. Короткая считается канонической как наиболее распространённая. Длинная версия отличается вставкой на месте аргинина-257: R → RGPGRQGGSGSESCSLSLGSLVWGPHALEPGEQGGELRRALASSVPR, что приводит к удлинению молекулы с 515 аминокислот до 561 и увеличению молекулярной массы до 63,8 кДа.
Потенциально опасные субстанции[править | править код]
Существует много субстанций, потенциально опасных для людей с дефицитом фермента G6PD, различные варианты ответа организма на введение этих субстанций затрудняет предсказание конкретного ответа у конкретного человека. Среди противомалярийных препаратов, которые могут вызвать острый гемолиз у людей с дефицитом фермента G6PD: primaquine, pamaquine и chloroquine. Имеются данные о том, что другие противомалярийные препараты также могут усугубить недостаточность G6PD, но в значительно более высоких дозах. Сульфаниламиды (sulfanilamide, sulfamethoxazole и mafenide), thiazolesulfone, метиленовый синий и нафталин также не должны использоваться у людей с недостаточностью G6PD, также как и некоторые анальгетики: аспирин, phenazopyridine и acetanilide, а также некоторые не-сульфонные антибиотики (nalidixic acid, nitrofurantoin и фуразолидон). Есть данные о том, что она вызывает гемолитический криз у новорожденных с недостаточностью G6PD.
Ссылки[править | править код]
- Глюкозо-6-фосфатдегидрогеназа (Г6ФД; G6PD).
- Гемолитическая несфероцитарная анемия (недостаточность глюкозо-6-фосфат дегидрогеназы: генетика.
Источник
Недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД): причины, диагностика, лечениеЭтиология и встречаемость недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД). Недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД) (MIM №305900), наследственная склонность к гемолизу, — Х-сцепленное заболевание антиоксидантного гомеостаза, вызванное мутациями в гене G6PD. В областях, эндемичных по малярии, недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД) имеет распространенность от 5-25%; в неэндемичных областях распространенность менее 0,5%. Подобно серповидноклеточной анемии, недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД) имеет высокую частоту на некоторых территориях, поскольку вызывает у гетерозиготных носителей повышенную сопротивляемость к малярии, и таким образом дает им селективное преимущество. Патогенез недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД)Глюкозо-6-фосфат дегидрогеназы (Г6ФД) — первый фермент в гексозомонофосфатном шунте, метаболическом пути, критически важном для синтеза НАДФ. НАДФ необходим для восстановления окисленного глутатиона. В эритроцитах восстановленный глутатион используется для детоксикации оксидантов, образующихся при взаимодействии гемоглобина и кислорода с внешними факторами, такими как лекарства, инфекции или метаболический ацидоз. Чаще всего недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД) возникает вследствие мутаций в Х-сцепленном гене G6PD, снижающих либо каталитическую активность, либо устойчивость фермента, либо и то и другое. Когда активность глюкозо-6-фосфат дегидрогеназы (Г6ФД) достаточно низкая, дефицит НАДФ приводит к недостаточному восстановлению окисленного глутатиона во времени окислительного стресса. Это вызывает окисление и накопление внутриклеточных белков (телец Хайнца) и образование ригидных эритроцитов, легко подвергающихся гемолизу. Наиболее частые аллели G6PD, приводящие к неустойчивости белка, вызывают преждевременное старение эритроцитов. Поскольку эритроциты не имеют ядра, новая мРНК глюкозо-6-фосфат дегидрогеназа (Г6ФД) не синтезируется; поэтому эритроциты не в состоянии заменять глюкозо-6-фосфат дегидрогеназу (Г6ФД) по мере его деградации. Следовательно, при действии окислительных агентов гемолиз начинается с более старых эритроцитов и постепенно захватывает все более молодые эритроциты, в зависимости от степени окислительного стресса.
Фенотип и развитие недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД)Так как заболевание Х-сцепленное, недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД) преимущественно и наиболее сильно поражает мужчин. Редкие женщины с клинической симптоматикой имеют смещение инактивации Х-хромосомы, у которых в предшественниках эритроцитов активна Х-хромосома, несущая аллель болезни недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД). Кроме пола, тяжесть недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД) зависит от конкретной мутации гена G6PD. В общих чертах мутации, часто встречающиеся в Средиземноморском бассейне (Г6ФД В или средиземноморские), приводят к более тяжелым формам, чем африканские (Г6ФД А- варианты). В эритроцитах пациентов со средиземноморскими вариантами активность глюкозо-6-фосфат дегидрогеназы (Г6ФД) падает до недостаточного уровня за 5-10 дней после их появления в кровотоке, тогда как в эритроцитах пациентов с глюкозо-6-фосфат дегидрогеназы (Г6ФД) А- вариантами активность ГбФд снижается до недостаточного уровня только через 50-60 дней. Следовательно, у пациентов с тяжелыми формами недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД) средиземноморского типа гемолизу подвержены большинство эритроцитов, а у пациентов с вариантами глюкозо-6-фосфат дегидрогеназы (Г6ФД) А- — только 20-30%. Чаще всего недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД) обнаруживается или как неонатальная желтуха, или как острая гемолитическая анемия. Максимальная встречаемость неонаталь-ной желтухи происходит в течение 2-3-го дня жизни. Тяжесть желтухи колеблется от преклинической до ядерной желтухи; связанная анемия редко бывает тяжелой. Эпизоды острой гемолитической анемии обычно начинаются во время окислительного стресса и заканчиваются после гемолиза эритроцитов с недостаточностью глюкозо-6-фосфат дегидрогеназы (Г6ФД); следовательно, тяжесть анемии, связанной с острыми гемолитическими кризами, прямо пропорциональна степени недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД) и выраженности окислительного стресса. Наиболее частые пусковые механизмы — вирусные и бактериальные инфекции, но также к гемолизу могут приводить множество лекарственных средств и токсинов. Название заболевания — «фавизм» происходит от гемолиза, вызванного употреблением конских бобов Vicia fava пациентами с тяжелыми формами недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД), например, средиземноморскими; бобы содержат b-гликозиды, оксиданты естественного происхождения. Помимо неонатальной желтухи и острой гемолитической анемии, недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД) иногда вызывает врожденную или хроническую несфероцитарную гемолитическую анемию. Пациенты с хронической не-сфероцитарной гемолитической анемией обычно имеют выраженную недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД), вызывающую хроническую анемию и повышенную предрасположенность к инфекциям. Предрасположенность к инфекциям возникает в связи с тем, что поступления НАДФ в гранулоциты недостаточно, чтобы поддерживать окислительную реакцию, необходимую для разрушения фагоцитированных бактерий. Особенности фенотипических проявлений недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД):
Лечение недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД)Недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД) следует заподозрить у пациентов африканского, средиземноморского или азиатского происхождения, имеющих острый гемолитический эпизод или неонатальную желтуху. Недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД) диагностируют измерением активности глюкозо-6-фосфат дегидрогеназы (Г6ФД) в эритроцитах; эта активность должна быть измерена только в том случае, если пациент не имел переливаний крови или острого гемолиза (поскольку недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД) первоначально развивается в более старых эритроцитах, измерение активности глюкозо-6-фосфат дегидрогеназы (Г6ФД) преимущественно в молодых эритроцитах во время или немедленно после гемолитического эпизода, часто дает ложноотрицательный результат). Ключ к оказанию помощи при недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД) — предотвращение гемолиза быстрым лечением инфекций и исключением лекарств с оксидантным эффектом (например, сульфаниламидов, сульфонов, нитрофуранов) и токсинов (например, нафталина). Хотя большинство пациентов во время гемолитического эпизода не нуждаются в медицинском вмешательстве, в случае выраженной анемии и гемолиза может потребоваться переливание эритроцитарной массы и интенсивное наблюдение. Пациенты с неонатальной желтухой хорошо отвечают на такую же терапию, как и при неонатальной желтухе другого генеза (регидратацию, светотерапию и обменные переливания крови). Риски наследования недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД)Все мальчики у матери, несущей мутацию в гене G6PD, имеют 50% шансы быть больными, а все дочери — 50% шансов оказаться носительницами. Все дочери больного отца будут носительницами, но сыновья будут здоровы, поскольку больной отец не передает X хромосому сыновьям. Риск того, что девочки-носительницы будут иметь клинически значимые симптомы, низкий, так как достаточное смещение инактивации Х-хромосомы встречается сравнительно редко. Пример недостаточности глюкозо-6-фосфат дегидрогеназы (Г6ФД). Л.М., ранее здоровый 5-летний мальчик, поступил в неотложное отделение с лихорадкой, бледностью, тахикардией, одышкой, заторможенностью; в остальном результаты его клинического осмотра оказались без особенностей. Утром перед поступлением он был здоров, но в течение дня появились боли в животе, головная боль, поднялась температура тела; вечером начались одышка и заторможенность. Он не принимал никаких лекAPCтвенных средств или известных токсинов, результаты токсикологического анализа мочи оказались отрицательными. Результаты других лабораторных тестов показали огромный внутрисосудистый гемолиз и гемоглобинурию. После реанимации ребенок переведен в отделение; гемолиз разрешился без дальнейшего вмешательства. Пациент по этнической принадлежности — грек; его родители были не осведомлены о случаях гемолиза в семье, хотя мать имела несколько дальних родственников в Европе с «проблемами крови». Дальнейший опрос выяснил, что утром перед заболеванием ребенок поел конские бобы в саду, пока мать работала во дворе. Врач объяснил родителям, что ребенок, вероятно, имеет недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД), из-за чего и заболел после употребления конских бобов. Последующее измерение активности глюкозо-6-фосфат дегидрогеназы (Г6ФД) в эритроцитах подтвердило недостаточность фермента. Родителям даны рекомендации относительно риска острого гемолиза у ребенка после применения определенных лекарств и токсинов, дан список веществ, которых необходимо избегать. — Также рекомендуем «Наследственный гемохроматоз: причины, диагностика, лечение» Оглавление темы «Генетические болезни»:
|
Источник