Фолиеводефицитная анемия клиника лечение
Фолиеводефицитная анемия — мегалобластическая анемия, обусловленная нарушением костномозгового кроветворения вследствие дефицита фолиевой кислоты (витамина B9). При фолиеводефицитной анемии развиваются все признаки анемического синдрома (бледность, слабость, тахикардия, снижение АД), незначительная желтуха, увеличение селезенки, анорексия, неустойчивый стул. С целью подтверждения диагноза проводится исследование гемограммы, костного мозга, определение уровня фолиевой кислоты в эритроцитах и сыворотке крови. Лечение B9-дефицитной анемии требует проведения заместительной терапии фолиевой кислотой.
Общие сведения
Фолиеводефицитная анемия — комплекс клинико-гематологических проявлений, вызванных недостаточностью фолиевой кислоты вследствие ее ограниченного поступления, снижения абсорбции или повышенного расходования. Фолиеводефицитная анемия встречается реже, чем В12-дефицитная, однако часто сочетается с последней, а также нередко сопутствует железодефицитной анемии. Особую опасность фолиеводефицитная анемия представляет для беременных, поскольку может приводить к формированию пороков развития нервной системы плода, повышать риск отслойки плаценты, преждевременных родов и рождения недоношенного ребенка. Это обусловливает актуальность проблемы не только в рамках гематологии, но также педиатрии, акушерства и гинекологии.
Фолиеводефицитная анемия
Причины фолиеводефицитной анемии
Фолиевая кислота (витамин Вс, В9) поступает в организм в составе соединений — фолатов, присутствующих в овощах (бобовых, брокколи, шпинате, салате, спарже), печени, мясе, шоколаде, дрожжах и др. Запасы фолатов в организме составляют 5-10 мг, а минимальная ежесуточная потребность в них — 50 мкг (в период беременности в 2-3 раза выше). После прекращения поступления фолиевой кислоты извне, истощение ее эндогенных запасов наступает через 3-5 месяцев. Клинические проявления фолиеводефицитной анемии развиваются при снижении уровня витамина В9 в сыворотке крови менее 4 нг/мл.
Этиология фолиеводефицитной анемии может быть связана с недостаточным экзогенным поступлением витамина В9, нарушением его всасывания в кишечнике или повышенным выведением из организма. Чаще всего дефицит фолиевой кислоты носит алиментарный характер; он может быть обусловлен несбалансированным или недостаточным питанием, длительной термической обработкой пищи, вскармливанием детей козьим молоком и т. п.
Повышенную потребность в фолиевой кислоте испытывают беременные и кормящие женщины, недоношенные дети, подростки, онкобольные, пациенты с гемолитической анемией, гемобластозами, эксфолиативным дерматитом, псориазом. Эти категории лиц находятся в группе риска по развитию фолиеводефицитной анемии.
Нарушение абсорбции фолиевой кислоты в ЖКТ наблюдается при хроническом алкоголизме, состоянии после обширной резекции тонкого кишечника, целиакии, лимфоме кишечника, болезни Крона, спру, недостатке витамина В12, приеме антагонистов фолатов (противосудорожных препаратов, барбитуратов, оральных контрацептивов и др.). Чрезмерному выведению фолиевой кислоты из организма могут способствовать цирроз печени, гемодиализ, сердечная недостаточность.
Всасывание фолиевой кислоты происходит в двенадцатиперстной и начальном отделе тощей кишки. После поступления в кровоток она связывается с белками плазмы и транспортируется в печень, где значительная часть фолиевой кислоты откладывается в депо, остальная часть выводится с мочой.
В организме фолиевая кислота присутствует в виде коферментной формы — тетрагидрофолиевой кислоты, активно участвующей в синтезе глутаминовой кислоты, пиримидиновых и пуриновых оснований, а также тимидинмонофосфата – компонента ДНК. При фолиеводефицитной анемии, в первую очередь, нарушается синтез нуклеиновых кислот активно делящихся кроветворных клеток, в результате чего нормобластическое кроветворение сменяется на мегалобластическое. Следствием неэффективного гемопоэза служит развитие анемии, сочетающейся с лейкопенией и тромбоцитопенией.
Симптомы фолиеводефицитной анемии
Фолиеводефицитная анемия чаще развивается у молодых пациентов и беременных женщин. Среди клинических проявлений преобладают признаки анемического синдрома: бледность кожи с оттенком субиктеричности, слабость, тахикардия, артериальная гипотония, головокружения.
В отличие от пернициозной анемии, при дефиците фолиевой кислоты не развиваются неврологические нарушения (фуникулярный миелоз), а расстройства функции желудочно-кишечного тракта выражены незначительно. В числе последних иногда отмечается анорексия, неустойчивость стула, атрофический гастрит, глоссит, незначительная спленомегалия. При углубленном обследовании может выявляться миокардиодистрофия.
У пациентов с эпилепсией, шизофренией, психическими нарушениями фолиеводефицитная анемия усугубляет течение основного заболевания. Дефицит фолиевой кислоты в период беременности является фактором риска формирования дефектов нервной трубки (анэнцефалии, гидроцефалии, менингоцеле), врожденных пороков сердца, расщепления губы и нёба («заячьей губы» и «волчьей пасти»), гипотрофии плода. Кроме этого, у беременной повышается вероятность выкидыша, кровотечения, преждевременного родоразрешения.
После родов женщины с фолиеводефицитной анемией в большей степени подвержены развитию послеродовой депрессии, а дети раннего возраста — задержке психомоторного развития, нарушению работы кишечника, снижению иммунитета.
Диагностика фолиеводефицитной анемии
В общем анализе крови при фолиеводефицитной анемии отмечается гиперхромия, макроцитоз, лейкопения, тромбоцитопения, снижение количества ретикулоцитов. Подтверждению диагноза способствует определение снижения фолиевой кислоты в сыворотке крови (норма 6-20 нг/мл) и эритроцитах (норма – 100-450 нг/л). При исследовании миелограммы выявляется гиперплазия красного ростка, мегалобластный тип кроветворения.
При фолиеводефицитной анемии проба с гистидином, принятым внутрь, оказывается положительной: экскреция формиминглутаминовой кислоты с мочой значительно увеличивается (>18 мг). При миокардиодистрофии, по данным ЭКГ, имеет место нарушение реполяризации миокарда левого желудочка. С помощью УЗИ органов брюшной полости определяется увеличение селезенки. Фолиеводефицитную анемию приходится дифференцировать с В12-дефицитной анемией, острым эритромиелозом, миелодиспластическим синдромом, пароксизмальной ночной гемоглобинурией, гипопластической и аутоиммунной гемолитической анемией.
Лечение и профилактика фолиеводефицитной анемии
Лечение фолиеводефицитной анемии требует нормализации питания, устранения провоцирующих факторов, проведения заместительной терапии. Пациентам назначается прием фолиевой кислоты внутрь в дозе 1-5 мг в сутки в течение 4-6 недель под контролем лабораторных показателей крови. При терапии антагонистами витамина В9 назначается его парентеральное введение. Пациенты с нарушением всасывание фолиевой кислоты, должны находиться под наблюдением гематолога и пожизненно получать заместительную терапию.
В профилактическом приеме фолиевой кислоты нуждаются беременные, больные с талассемией, гемолитической анемией. В целях предупреждения патологии плода и акушерских осложнений прием фолиевой кислоты по 0,4 мг/сутки необходимо начинать еще в рамках прегравидарной подготовки (за несколько месяцев до зачатия) и продолжать на протяжении всей беременности и грудного вскармливания. Известно, что профилактический прием фолиевой кислоты, начатый еще до наступления беременности, позволяет снизить частоту рождения детей с врожденными пороками ЦНС в 3,5 раза.
Источник
Мегалобластные
анемии
— группа заболеваний, хар-ся появлением
в красном костном мозге мегалобластов
— клеток красного ядра больших размеров
с измененной структурой ядра, которые
прослеживаются на всех стадиях
дифференцировки эритроидных
предшественников. Появление мегалобластов
связано с нарушением синтеза ДНК и
замедлением созревания клеток.
Витамин
B12-дефицитная
анемия
— группа заболеваний, связанных с
дефицитом цианокобаламина (витамин
B12)
или нарушением его метаболизма.
Причины
дефицита витамина В12:
1)
неполноценное питание (исключительно
вегетарианское);
2) дефицит внутреннего
фактора: гастрит типа А, иммунные антитела
к фактору Кастля или к париетальным
клеткам желудка, гастроэктомия, врожденный
дефицит его без нарушения функции
желудка, рак желудка;
3) хронический
панкреатит, синдром Золингера-Эллисона,
заболевания конечного отдела подвздошной
кишки (болезнь Крона, тяжелый энтерит),
синдром «приводящей кишки»;
4)
дисбактериоз (развитие бактерий в слепых
петлях);
5) наличие гельминтов (широкий
лентец);
6) хронический алкоголизм;
7)
заболевания печени (цирроз, гепатит);
8)
прием некоторых лекарственных средств,
избыточное применение антиметаболитов
при лечении опухолей также может вызвать
нарушение синтеза ДНК.
Клиника.
Болеют
лица в возрасте 45-65 лет, редко клиника
встречается у людей до 30 лет, чаще болеют
женщины. Обычно манифестация (прогрессия)
наступает весной или осенью. Заболевание
развивается постепенно, нередко долгое
время болезненное состояние проявляется
поражением ЖКТ, иногда признаками
поражения нервной системы (радикулиты),
адаптированной (легкой степени) анемией.
Выражены синдромы: поражение кроветворной
системы, ЖКТ и нервной системы. Клиника
проявляется слабостью, одышкой,
тахикардией, периодической диареей,
жгучими болями в языке при приеме острой
и кислой пищи, парестезиями, снижением
чувствительности, а при тяжелых анемиях
— спутанностью сознания, депрессией,
деменцией. Объективно: покровы бледные
с матовым и лимонно-желтым оттенком.
Язык гладкий, сглаженный, атрофичный
(иногда, гиперпластичный), блестящий,
влажный, иногда красный и воспаленный
(«лакированный» язык, глоссит Хантера).
Селезенка часто увеличена, иногда
увеличена печень. Парестезии пальцев
рук и ног. Атрофия мышц, полиневриты,
расстройства координации (неуверенная
или шаткая походка, нескоординированные
движения).
Диагностика:
— очень
низкое содержание витамина В12
в плазме (менее 100 пг/л, N 160-950 пг/л),
увеличение ферритина, уменьшение
гаптоглобина, повышение ЛДГ; — антитела
к внутреннему фактору или к париетальным
клеткам в сыворотке крови (обнаруживаются
в 50% случаев). — гиперхромия,
макроцитарная
гипо-, норморегенераторная (диспластическая)
анемия.
Обнаруживаются мегалоциты (11-14 мкм),
макроформы и анизоцитоз, включения в
эритроцитах (тельца Жолли, кольца Кебота,
зернистость Гейнца), полисегментация
нейтрофилов. — мегалобластный костный
мозг («синий» при окраске по Романовскому);
— отрицательный тест Шиллинга (при
экскреции мочи после приема радиоактивного
витамина В12
внутрь уменьшается выделение кобаламина);
— при Ph-метрии желудочного сока гипо- и
ахлоргидрия; — при биопсии слизистой
желудка — фундальный гастрит, гипертрофия
бокаловидных клеток, атрофия париетальных
и главных клеток, клеточный атипизм; —
увеличение билирубина за счет непрямого
(неконъюгированного).
Лечение.
Режим
амбулаторный или стационарный в
зависимости от тяжести анемии. Диета:
с повышенным содержанием белков,
преимущественно продукты животного
происхождения. Лекарственная терапия
заключается в назначении цианкобаламина
по 1000 мкг в/м 1 раз в день, далее по 500 мкг
3-4 недели, затем по 200 мкг/сут в течение
1-1,5 месяца или по 500 мкг 1 раз в неделю 1
месяц. С целью профилактики рецидивов
пожизненно вводят цианкобаламин
по 500 мкг 2 раза в месяц. Уже в первые
сутки после в/м введения витамина В12
происходит трансформация мегалобластного
типа в нормоцитарный, усиливается
эритропоэз. Через 48-72 часа после первой
инъекции витамина
В12начинает
увеличиваться число ретикулоцитов.
Ретикулоцитарный
криз нарастает
к 7-12 дню, что может быть оценено как
результат эффективной терапии. В
клинических условиях фолиевая кислота
не должна использоваться для лечения
В12-дефицитной
анемии, так как могут развиться серьезные
неврологические расстройства даже при
ликвидации анемии. Трансфузии эритроцитов
проводят при угрозе анемической комы
— наиболее грозного и плохо поддающегося
лечению осложнения В12-дефицитной
анемии. Прогноз
при адекватном лечении благоприятный.
Хронизация анемии отмечается при
алкоголизме и у лиц после тотальной
резекции желудка или кишечника. После
достижения ремиссии больные подлежат
диспансерному наблюдению, проведению
ФГС с биопсией слизистой желудка и
противорецидивному лечению витамином
В12
весной
и осенью.
Фолиеводефицитная
анемия
— анемия, обусловленная дефицитом
фолиевой кислоты или нарушения ее
утилизации в процессе эритропоэза, что
приводит к мегалобластному типу
кроветворения.
Патогенез.
Фолиевая
кислота
и ее соединения известны под названием
фолатов. Организм получает фолаты при
расщеплении содержащихся в пище
полиглютаматов в моноглютаматы в тонком
кишечнике. В плазме происходит превращение
метилтетрафолата в присутствии витамина
В12
в тетрагидрофолаты. Последние превращаются
в формил-ТГФ (фолиновая кислота), затем
в дезокситимидин-монофосфат с последующим
синтезирующим действием на ДНК. Таким
образом, дефицит витамина В12
ведет к нарушению синтеза фолиновой
кислоты и развитию В12-дефицитной
анемии. Дефицит фолиевой кислоты ведет
к развитию фолиеводефицитной анемии.
Суточная потребность фолатов составляет
100 мкг. Запасы, создаваемые в тканях
(печень), достаточны для синтезирования
ДНК в течение 1-3 мес.
Этиология.
1.
Недостаток фолиевой кислоты в пище (в
том числе вскармливание новорожденных
козьим или порошковым молоком). 2.
Нарушения всасывания в тонком кишечнике
и нарушения депонирования в печени (в
том числе при злоупотреблении алкоголем).
3. Прием антагонистов фолиевой кислоты
(метотрексата), аналогов пурина и
пиримидина, противосудорожных препаратов
— дифенина, фенобарбитала. 4. Повышение
потребности в фолиевой кислоте
(беременность, новорожденные,
миелопролиферативные синдромы,
хронический гемолиз). 5. При очень активной
пролиферации клеток (гемолиз, лейкозы
и другие опухоли, инфекции, псориаз).
6.
Угнетение системы дигидрофолат-редуктазы
(при приеме ЛС, при алкоголизме).
Клиника
сходна с В12-дефицитной
анемией. Не характерен атрофический
гастрит с ахилией, нет фуникулярного
миелоза. Не наблюдается геморрагический
диатез. Более выражены функциональные
признаки поражения ЦНС. Встречается
чаще у детей, молодых женщин, алкоголиков,
больных эпилепсией.
Диагностические
критерии дефицита фолиевой кислоты:
низкий уровень содержания фолатов в
сыворотке (натощак) 3-25 нг/мл; низкий
уровень содержания фолатов в эритроцитах
(N 100-415 нг/мл); макроцитарная диспластическая
анемия; мегалобластный костный мозг;
нормальный или несколько сниженный
уровень витамина В12
в сыворотке крови (менее 100 мг/мл, N
160-930 мг/мл).
Гемограмма
и миелограмма
сходны с витамин В12-дефицитной
анемией.
Дифференциальный
диагноз
с В12-дефицитной
анемией представлен в таблице.
Основные
дифференциально-диагностические
признаки витамин В12—
(2 столбик) и фолиеводефицитной анемий
(3 столбик)
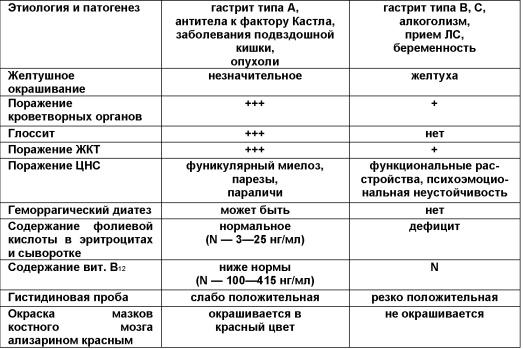
Лечение.
Фолиевая
кислота внутрь
5-15 мг/сут на протяжении 4-6 недель до
получения ремиссии. В последующем при
неустраненной причине — поддерживающая
терапия 1-5 мг/сут.
40.
Хронический миелолейкоз: этиология,
патогенез, роль хромосомных аббераций
в развитии лейкоза, фазы лейкемического
процесса, терапия 1-ой линии, терапия
резерва. Показания к трансплантации
костного мозга, исходы и осложнения
ХМЛ.
Хронический
миелолейкоз (ХМЛ)
–
хронически протекающее миелопролиферативное
заболевание, при котором наблюдается
повышенное образование
гранулоцитов, преимущественно нейтрофилов,
являющихся субстратом опухоли. Источник
опухоли –
клетка-предшественник
миелопоэза.
Этиология.
Причиной
патологического роста клеток считается
мутация клетки-предшественника
миелопоэза (частично детерминированная
полипотентная клетка). Это доказывается
обнаружением у больных ХМЛ патологической
Ph-хромосомы
(филадельфийской) в клетках миелоидного,
эритроидного,
моноцитарного и тромбоцитарного рядов.
Ph-хромосома
является частым
клеточным маркером, подтверждающим
происхождение всего патологического
клона клеток при ХМЛ от одной материнской.
Несмотря на то, что лейкозными
являются все три ростка костного мозга,
в развернутой стадии ХМЛ
наблюдается безграничный рост, только
одного ростка –
гранулоцитарного. Существенно повышается
продукция и мегакариоцитов (тромбоцитов).
Классификация.
Заболевание закономерно проходит в
своем развитии две стадии –
моноклоновую (развернутая доброкачественная)
и поликлоновую (терминальную
злокачественную). Этому соответствуют
три фазы хронического миелолейкоза в
клиническом отображении:
—
хроническая –гиперплазия
гранулоцитарного ростка кроветворения
в красном костном мозге, при этом
способность клеток к дифференцировке
и созреванию сохранена; миелоидная
пролиферация костного мозга +
небольшие изменения
в крови без явлений интоксикации;
наблюдается умеренный лейкоцитоз, со
сдвигом лейкоцитарной формулы до
миелоцитов, увеличением содержания
зрелых и созревающих гранулоцитов в
красном костном мозге, эритро-
тромбоцитопоэз сохранены, селезенка
нормальных размеров;
—
фаза акселерации –
через 3-3,5 года выраженные
клинико-гематологические проявления
(интоксикация
продуктами распада лейкозных клеток,
увеличение печени и селезенки,
миелоидная пролиферация костного
мозга + изменения в крови: появляются
бластные клетки, анемия, тромбоцитопения;
нарастают симптомы интоксикации —
лихорадка, потливость, слабость, снижение
массы тела. Важный признак — резистентность
к успешно применявшейся ранее
химиотерапии);
—
бластный криз или терминальная
(соответствует
развитию поликлоновой опухоли) –
рефрактерность
к проводимой цитостатической терапии,
истощение, значительное увеличение
селезенки и печени, дистрофические
изменения внутренних органов,
выраженные изменения крови (анемия,
тромбоцитопения).
Появление
в периферической крови бластных клеток
(до 30–90%),
в связи с чем заболевание приобретает
черты острого лейкоза. Чаще
всего в костном мозге и периферической
крови бластный криз хар-ся
появлением миелобластов, однако могут
встретиться и недифференцируемые
бластные клетки. Одновременно
происходит значительное
угнетение тромбоцитопоэза, развивается
геморрагический синдром.
Клиническая
картина.
Миелопролиферативный
синдром (обусловлен
миелоидной пролиферацией костного
мозга) включает:
а)
общие
симптомы, вызванные интоксикацией,
разрастаниями лейкозных клеток
в костном мозге, селезенке и печени
(потливость, слабость, снижение массы
тела, тяжесть и боль в области селезенки
и печени), оссалгии.
б)
увеличение
печени и селезенки;
в)
лейкемические
инфильтраты в коже;
г)
характерные
изменения в костном мозге и
периферической крови.
Синдром,
обусловленный осложнениями:
а)
геморрагический
диатез (геморрагии и тромбозы вследствие
нарушения
прокоагулянтного и тромбоцитарного
звеньев гемостаза);
б)
гнойно-воспалительные
(пневмонии, плевриты, бронхиты, гнойные
поражения
кожи и подкожной клетчатки), обусловленные
резким снижением активности
иммунитета;
в)
мочекислый диатез (гиперурикемия
вследствие повышенного распада
гранулоцитов).
При
исследовании периферической
кровиобнаруживают:
лейкоцитоз
(кол-во
лейкоцитов колеблется в широких
пределах)
с появлением в лейкоцитарной формуле
пролиферирующих форм
(миелобласты и промиелоциты) и созревающих
гранулоцитов (миелоциты,
метамиелоциты). Функциональные
свойства лейкоцитов и содержание в них
ферментов изменены: снижена активность
щелочной фосфатазы нейтрофилов, нарушена
способность
к фагоцитозу.имеется
базофильно-эозинофильная ассоциация.в
ранних стадиях болезни
возможно обнаружение гипертромбоцитоза,
в дальнейшем — тромбоцитопения.развитие
нормоцитарной,
нормохромной анемии, связанной в
основном с вытеснением лейкозным клоном
красного
ростка кроветворения, можно наблюдать
в развернутой клинико-гематологической
стадии. В терминальной стадии анемия
становится еще более выраженной.ускорение
СОЭ
При
исследовании костного
мозга:
1) обнаруживают миелоидную пролиферацию
костного мозга, нормальный миелопоэз
полностью замещен патологическим
клоном. 2) В мазке костного мозга
преобладают гранулоциты: соотношение
лейкоциты/эритроциты достигает 10:1,
20:1
за счет увеличения гранулоцитов.
3) Если в периферической крови высокий
тромбоцитоз, в костном мозге
отмечается большое количество
мегакариоцитов.
При
пункции
увеличенной
селезенкиобнаруживается
преобладание миелоидных клеток.
Диагностическими
критериямизаболевания
являются:
лейкоцитоз
более 20 — 103
в 1 мкл крови;появление
в лейкоцитарной формуле пролиферирующих
форм (миелобласты и промиелоциты) и
созревающих гранулоцитов (миелоциты,
метамиелоциты);миелоидная
пролиферация костного мозга (по данным
миелограммы и
трепанобиопсии);снижение
активности щелочной фосфатазы нейтрофилов
(менее 25 ед);обнаружение
Ph-хромосомы
в кроветворных клетках;расширение
плацдарма кроветворения (по данным
сцинтиграфии костей);увеличение
размеров селезенки и печени.
ХМЛ
следует дифференцировать от так
называемых лейкемоидных реакций,
которые могут возникать при ряде
заболеваний (туберкулез, рак, различные
инфекции, почечная недостаточность и
пр.). По определению А.
И. Воробьева (1985), лейкемоидная
реакция
–
это «изменения в крови и органах
кроветворения, напоминающие лейкозы и
другие опухоли кроветворной системы,
но не трансформирующиеся в ту опухоль,
на которую они похожи». При лейкемоидной
реакции наблюдается высокий лейкоцитоз,
в периферической
крови появляются незрелые нейтрофилы,
однако базофильно-эозинофильная
ассоциация не обнаруживается.
Дифференциальный
диагноз
основывается
на выявлении основного заболевания
(рак, туберкулез и пр.), на
повышении активности щелочной фосфатазы
нейтрофилов (вместо ее снижения при
ХМЛ). При стернальной пункции для
лейкемоидной реакции характерно
увеличение содержания миелоцитов,
однако Ph-хромосома
никогда не
определяется.
Лечение.
Воздействие
на функционирование онкогена препаратом
иматиниб мезилат (торговое название —
Гливек) — ингибитор
ABL-тирозинкиназы.
Он соединяется с активными центрами
BCR-ABL-тирозинкиназы, что приводит к гибели
клеток, содержащих ее, т.е. Ph-положительных
клеток. Эффективность превосходит все
ранее известные терапевтические
средства, применяемые у больных ХМЛ
(миелосан, гидроксимочевина, интерферон-α,
аллотрансплатация). В настоящее время
во всем мире Гливек
является препаратом 1-й линии терапии.
Назначается по 400 мг в I стадии, по 600 мг
во II стадии, до 800 мг в III стадии курсами.
Аллотрансплантация гемопоэтических
стволовых клеток и препараты новой
генерации ингибиторов тирозинкиназ
(растительный алкалоид гомогаррингтоин,
который проявил высокую эффективность
в хронической фазе, в фазе акселерации
и даже в бластном кризе ХМЛ. Назначается
по 2,5 мг/кг в/в курсом до 14 дней, затем по
7 дней в месяц для поддержания ремиссии)
используются в качестве 2-й и последующих
линий терапии у больных в хронической
фазе ХМЛ с резистентностью к Гливеку
или его непереносимостью.
ПОКАЗАНИЯ
К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА:
—
Аллогенная
трансплантация костного мозга: острые
лейкозы; хронический миелолейкоз;
тяжелая апластическая анемия;
гемоглобинопатии; врожденные иммунодефициты
и нарушения метаболизма.
—
Аутологичная
трансплантация костного мозга:
злокачественные лимфомы; некоторые
солидные опухоли; аутоиммунные
заболевания.
Прогноз.
Длительность
жизни больных ХМЛ в среднем составляет
3–5
лет,
у отдельных больных достигает 10 лет и
более. Осложнения
ХМЛ. Острая
сердечно-сосудистая недостаточность,
инфекционные осложнения, ДВС-синдром
и др.
Профилактика.
Точных мер предупреждения ХМЛ не
существует, в связи с
чем можно говорить лишь о вторичной
профилактике болезни, которая состоит
в предупреждении обострений болезни
(поддерживающая терапия, исключение
инсоляции, простудных заболеваний).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник

