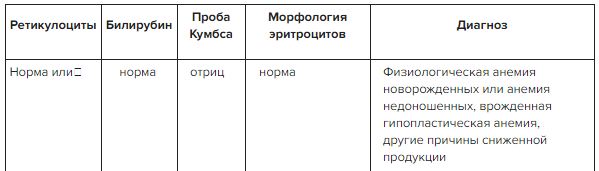
Федеральные клинические рекомендации по диагностике и лечению железодефицитной анемии
Железодефицитная анемия – заболевание, распространенное среди всех групп населения, однако тяжелая его форма встречается достаточно редко.
 Железодефицитная анемия – это гематологическое заболевание, возникающее по множеству причин и напрямую связанное с недостатком железа в организме человека вследствие нарушений его поступления, усвоения или повышенных потерь.
Железодефицитная анемия – это гематологическое заболевание, возникающее по множеству причин и напрямую связанное с недостатком железа в организме человека вследствие нарушений его поступления, усвоения или повышенных потерь.
Данная патология характеризуется гипохромной анемией и микроцитозом.
↯
Больше статей в журнале
«Заместитель главного врача»
Активировать доступ
Возникновению железодефицитной анемии, как правило, предшествует период латентного дефицита железа, чаще всего рассматриваемый как приобретенное функциональное расстройство и характеризующийся скрытым недостатком этого микроэлемента, снижением его запасов в организме и недостаточным содержанием его в тканях при отсутствии явной анемии.
Заболевание сочетает в себе сидеропенический и анемический синдромы. Рассмотрим клинические рекомендации по железодефицитной анемии.
Причины и признаки
Эксперты считают основной причиной развития ЖДА неправильное питание. Также причинами заболевания являются кровотечения, приводящие к так называемой хронической постгеморрагической анемии, и заражение глистами, характерное для местностей с низкой санитарной культурой.
Симптомы ЖДА:
- бледная сухая кожа, иногда с голубоватым оттенком;
- истончение, искривление ногтей;
- выпадение, слабость, сухость, ранняя седина волос;
- вкусовые извращение, пристрастие к необычным запахам;
- атрофический глоссит;
- тахикардия, одышка, отеки;
- пониженное артериальное давление;
- снижение работоспособности, концентрации внимания, памяти;
- мышечная слабость;
- у женщин – расстройства менструального цикла.
✔ Дифференциальная диагностика анемий в неонатальном периоде, скачайте таблицу в Системе Консилиум.
Скачать таблицу
Клинические проявления ЖДА неспецифичны, то есть характерны для любой формы анемии, однако они значительно утяжеляют течение болезни, снижая качество жизни больного.
Несмотря на то, что клиническая картина при ЖДА очерчена довольно четко, ее малая распространенность, а также отсутствие тяжелых и средней тяжести форм в популяции приводит к тому, что симптоматика сидеропении и анемии обладает низкой чувствительностью и не всегда позволяет выявить болезнь.
В связи с этим основополагающее значение в диагностике железодефицитной анемии приобретают лабораторные и инструментальные исследования.
В статье вы найдете только несколько готовых образцов и шаблонов.
В Системе «Консилиум» их более 5000.
Успеете скачать всё, что нужно, по демодоступу за 3 дня?
Активировать
Диагностика
Лабораторная диагностика включает в себя:
- ОАК.
- ОАМ.
- Анализ кала на скрытую кровь.
- Исследование мокроты и промывных бронхиальных вод на гемосидерин, атипичные клетки и Mycobacteriumtuberculosis.
Если диагноз ЖДА подтверждается лабораторными исследованиями, больному показан целый ряд инструментальных методов исследования для выявления или исключения возможного источника внутреннего кровотечения.
К ним относятся:
- ФГДС;
- колоноскопия;
- мануальное и ультразвуковое исследование органов малого таза у женщин;
- цистоскопия, УЗИ почек;
- рентген грудной клетки.
Клинические рекомендации по ЖДА
Клинические рекомендации по железодефицитной анемии у детей и взрослых устанавливают стандарт, определяющий объем и критерии качества оказания медпомощи больному при развитии анемического синдрома.
Он предназначен для лечебных организаций и учреждений федерального, регионального и муниципального уровней, систем ОМС и ДМС, другими медорганизациями различных организационно-правовых форм деятельности, направленной на оказание медицинской помощи.
✔ Железодефицитная анемия: стандарт лечения из расчета 21 день, таблица в Системе Консилиум.
Лечение железодефицитной анемии
Согласно клиническим рекомендациям по ЖДА, препараты для ее лечения условно делятся на:
- ионные солевые;
- препараты железа на основе ГПК.
По данным исследований, эффективность и тех, и тех средств одинакова. Однако в процессе терапии солевыми препаратами возможны проблемы:
- передозировка или отравление из-за неконтролируемого всасывания действующего вещества организмом;
- взаимодействие с другими медикаментами и с некоторыми продуктами питания;
- неприятный металлический привкус;
- стойкое окрашивание зубов и десен в темный цвет;
- низкая комплаентность (частый отказ больных от лечения).
Клинические рекомендации по ЖДА у детей отмечают, что при приеме солевых препаратов могут наблюдаться боли в животе, тошнота, рвота, запор, диарея.
Этих проблем можно избежать, назначая пациентам современные препараты железа на основе ГКП (гидроксида полимальтозата).
Данная группа средств отличается большей безопасностью и имеет ряд преимуществ:
- отсутствие риска передозировки и интоксикации;
- отсутствие окрашивающих зубы и десны свойств;
- приятный вкус;
- хорошая переносимость;
- отсутствие взаимодействия с пищей и другими лекарствами;
- антиоксидантные свойства;
- высокая комплаентность лечения.
Основные пероральные препараты железа, применяемые в лечении железодефицитной анемии, а также содержание в них элементарного железа приведены в таблице ниже.
Лечение детей: клинические рекомендации
Согласно клиническим рекомендациям по железодефицитной анемии, лечение данного заболевания у детей имеет свои нюансы, которые необходимо учитывать при оказании медицинской помощи.
Например, применение у детей до 3 лет солевых препаратов железа в дозе 5—8 мг/кг массы тела в сутки вызывает интоксикацию у больных, поэтому не имеет смысла и крайне нежелательно с терапевтической точки зрения.
В практике отечественных врачей-педиатров долгие годы был принят так называемый трапециевидный терапевтический план лечения железодефицитной анемии у детей. Он предполагает, в первые 3—5 дней лечения дозировка солевых препаратов железа возрастает постепенно, чтобы избежать негативного влияния на слизистую оболочку ЖКТ.
Полную дозу солевого препарата железа применяли в течение 1,5—3 месяцев исходя из степени тяжести заболевания с последующим постепенным ее снижением до 50% к моменту окончания лечения.
Главный недостаток этой схемы в том, что она, как и множество других, была разработана эмпирически, а ее клиническая эффективность никогда не была доказана исследованиями.
Разработка препаратов железа на основе ГПК дало основание для пересмотра плана лечения железодефицитной анемии у детей и взрослых.
В Федеральном научно-клиническом центре детской гематологии, онкологии и иммунологии (ФНКЦ ДГОИ) им. Дмитрия Рогачева Минздрава России (г. Москва) было проведено исследование, направленное на сравнению клинической эффективности двух планов лечения ЖДА различной степени тяжести у детей и подростков: традиционного трапециевидного, описанного чуть выше, и нового, предполагающего прием полной дозы препарата железа на основе ГПК на протяжении всего периода терапии.
В ходе исследования были оценены:
- переносимость препарата железа на основе ГПК;
- эффективность терапии в ранние и поздние сроки.
Была доказана высокая эффективность лечения детей и подростков с железодефицитной анемией средством на основе ГПК. После завершения курса лечения были достигнуты следующие показатели:
- нормализация концентрации НЬ — у 96,9% больных;
- нормализация СЖ — у 73,4% больных;
- нормализация СФ — у 60,9% больных.
Незначительное количество нежелательных явлений (запор в течение первого месяца лечения) и 100%-ная приверженность пациентов к лечению позволили сделать вывод, что препарат железа на основе ГПК — оптимальный вариант терапии железодефицитной анемии у детей и подростков.
Также было обнаружено преимущество использования полной дозы препарата на основе ГПК в течение всего курса лечения:
- нормализация концентрации СЖ — у 90,6% больных;
- нормализация СФ — у 75%.
При применении традиционного трапециевидного плана лечения аналогичные показатели составили 56,3% и 46,9% соответственно.
Использование парентеральных препаратов железа показано в том случае, если есть какие-либо противопоказания для перорального приема медикаментов, либо они не оказывают должного эффекта.
Внутривенное или внутримышечное введение препаратов железа применяется в следующих случаях:
- тяжелая форма железодефицитной анемии;
- непереносимость препаратов железа для приема внутрь;
- устойчивость к лечению пероральными препаратами железа;
- язва желудка или двенадцатиперстной кишки;
- состояние после операций на ЖКТ;
- операции на ЖКТ в анамнезе;
- анемии, связанные с хроническими болезнями кишечника (НЯК, болезнь Крона);
- хроническая почечная недостаточность, преддиализный и диализный периоды;
- наличие противопоказаний к переливанию эритроцитарной массы, в т.ч. и из религиозных соображений;
- необходимость срочного насыщения организма железом.

ЖДА у взрослых
Лечение железодефицитной анемии направлено на ликвидацию причин заболевания (пересмотр рациона питания, обнаружение и устранение источника кровопотери), а также на пополнение запасов этого микроэлемента в организме.
Основные принципы лечения ЖДА:
- назначение лекарственных средств, содержащих железо, так как возместить его недостаток в организме невозможно никаким другим способом:
- в приоритете – назначение средств для перорального приема;
- расчёт дозы препарата выполняется индивидуально для каждого больного исходя из его веса и терапевтического плана;
- длительность лечения – 3 месяца при легкой форме анемии, 4,5 месяца – при средней, 6 месяцев – при тяжелой;
- устранение дефицита железа в тканях организма, пополнение его запасов в депо (определяется по нормализации уровня СФ);
- контроль эффективности лечения препаратами железа.
Клинический случай: Гемотрансфузия и кровоизлияние в сетчатку, рассмотрим в Системе Консилиум.
Профилактика
Если распространенность железодефицитной анемии в регионе превышает отметку в 40%, власти принимают решение провести фортификацию, то есть обогащение железом продуктов питания, наиболее часто употребляемых населением. Однако нужно, чтобы их употребляли не менее 65% людей. Чаще всего речь идет о хлебе и макаронах.
Стоит отметить, что методика фортификации достаточно сложна, так как не существует идеального пищевого продукта, а также нет и соединения железа, хорошо всасывающегося и без проблем переносимого всеми группами населения. Поэтому эффективность фортификации не превышает 50% среди охваченного населения.
Гораздо лучшие результаты приносит профилактика железодефицитной анемии у лиц, входящих в группу риска развития анемии. Речь идет о так называемой саплиментации – добавке микроэлементов (железа, йода, магния и др.) извне.
Наглядный пример данной методики – назначение препаратов железа беременным женщинам для профилактики развития железодефицитных состояний. Клинические рекомендации по железодефицитной анемии у взрослых в нашей стране предполагают, что препарат железа в дозе 60 мг в сутки назначается во II и III триместрах беременности, а также в течение 3 месяцев кормления грудью.
В то же время национальные рекомендации США предписывают беременным женщинам прием препаратов железа в дозе 30 мг в сутки в течение всего периода гестации.
Между тем, нужно отметить, что даже при охвате саплиментацией 50-95% беременных женщин необходимую дозу железа получают лишь 67% женщин.
Доказано, что в первую очередь недостаток железа в организме вызван неправильным питанием. Это означает, что первичная профилактика железодефицитной анемии заключена в рациональном, сбалансированном и здоровом рационе человека любого возраста.
Материал проверен экспертами Актион Медицина
Источник
Син.: анемия воспаления
Код по МКБ-1 D63.8
Анемия хронических болезней (АХБ) является второй по распространенности после
ЖДА и наблюдается у пациентов с острой или хронической активацией иммунной
системы вследствие различных как инфекционных, так и неинфекционных заболеваний
(см. рисунок).

Рисунок 1. Наиболее частые причины анемий в клинической практике.
Наиболее частые состояния, которые могут приводить к развитию АХБ, представлены в таблице (см. таблицу).
В настоящее время считается, что образование гепцидина – ключевой механизм развития АХБ. Являясь гормоном, секретируемым гепатоцитами в условиях воспаления, гепцидин блокирует всасывания железа в кишечнике и реутилизацию железа из депо (депонирование железа в клетках моноцитарно-макрофагальной системы), тем самым снижая концентрацию железа в плазме крови, что способствует развитию железодефицитного эритропоэза. Другим важным фактором развития АХБ является неадекватно низкая продукция ЭПО вследствие избыточной продукции провоспалительных цитокинов. Таким образом, ведущую роль в развитии АХБ играет
комплекс факторов, основными из которых являются нарушение гомеостаза железа
вследствие повышенной продукции гепцидина и нарушение эритропоэза в виде
неадекватно низкой продукции ЭПО степени анемии, что является патогенетическим
обоснованием терапевтического применения при них эритропоэзстимулирующих
препаратов (ЭСП).
АХБ развивается не только при хронических, но и острых воспалительных заболеваниях. Снижение уровня Hb можно обнаружить уже менее, чем через 2 недели
от начала заболевания. Обычно это умеренная, микроцитарная анемия с уровнем Hb
90-130 г/л и гематокритом 30-40%. Лишь у 20% пациентов гематокрит может снижаться меньше 25%. При хроническом течении анемии, она становится более
гипохромной с более выраженным воспалительным компонентом в ее этиологии. При
острой инфекции, когда анемия развивается быстро, она часто нормохромная.
| Заболевания, ассоциируемые с анемией хронических болезней | Предположительная распространенность анемии при данном заболевании (%) |
|---|---|
Инфекции (острые и хронические)
| 18 – 95 |
Рак
| 30 – 77 |
Аутоиммунные реакции
| 8 – 71 |
Хроническая реакция трансплантат против | 8 – 70 |
Хронические заболевания почек | 23 – 50 |
1.1. Особенности диагностики анемии хронических болезней
Принципиальное различие между ЖДА и АХБ заключается в том, что ЖДА имеет
отношение к абсолютному дефициту железа, тогда как патофизиология АХБ является
мультифакторной. С высокой долей вероятности об АХБ следует думать, если анемия
развилась на фоне тяжелых заболеваний. АХБ необходимо также исключить в случаях,
когда перо-ральная ферротерапия в течение 4 нед не привела к повышению НЬ >10 г/л.
С этой целью проводится определение биохимических показателей обмена железа с расчетом коэффициента НТЖ и концентрации сывороточного ферритина СФ (см. клинические рекомендации по ЖДА, дифференциальная диагностика). Следует
учитывать, что уровень СФ повышается в условиях воспаления (острые и хронические
инфекции, болезни печени, аутоиммунные и онкологические заболевания), что может
маскировать наличие дефицита железа (ДЖ). Поэтому при повышенном уровне СРБ
(>10 мкг/л) ДЖ констатируется при СФ <50 мкг/л.
Для выявления ДЖ в случаях часто встречающегося сочетания ЖДА и АХБ, при
котором ФС, как правило, нормальный или повышен, в клинической практике
рекомендуется использование коэффициента НТЖ. У пациентов с АХБ в сочетании с
ДЖ НТЖ меньше возрастного уровня, представленного в таблице см. таблицу.
Насыщение трансферрина железом, % | – 1–2 года — < 9% – 3–5 лет — < 13% – 6–15 лет — < 14% – старше 15 лет- <16% |
* не имеют самостоятельного значения для диагностики ДЖ
Нормальный уровень сывороточного трансферринового рецептора 1 (сТФР) и высокая концентрация гепцидина, характерные для АХБ, вероятно, имеют высокую
диагностическую ценность. Однако их применение в клинической практике ограничивается отсутствием доступных коммерческих тест-систем и стандартизации в
педиатрической практике.
1.2. Лечение АХБ
Адекватное лечение основного заболевания – наиболее эффективный способ лечения
АХБ. Однако лечение АХБ необходимо при всех хронических заболеваниях трудно
поддающихся терапии (системные заболевания соединительной ткани, хронические
воспалительные заболевания кишечника, ВИЧ-инфекция и др.), поскольку анемия
значительно ухудшает прогноз и исходы этих заболеваний и является независимым
фактором риска повышенной летальности. Поскольку гепцидин блокирует всасывания
железа в кишечнике, лечение АХБ пероральными препаратами железа не эффективно.
Частичный эффект от пероральной ферротерапии может наблюдаться у пациентов с АХБ, развившейся на фоне ДЖ. Внутривенная ферротерапия с патогенетической точки
зрения более целесообразна при АХБ, однако если она используется в виде
монотерапии (только в случаях доказанного при АХБ ДЖ по низкому уровню НТЖ или
ФС) следует ожидать высокого уровня резистентности (около 50%) к терапии. Это
связано с неадекватно низкой продукцией ЭПО степени тяжести анемии, характерной
для АХБ. Поэтому наиболее эффективной схемой лечения АХБ является
комбинированное использование ЭСП и внутривенных препаратов железа.
Использование пероральных препаратов железа вместо внутривенной ферротерапии
допустимо, но может снижать ответ на рчЭПО терапию.
В настоящее время самый большой опыт применения рч ЭПО у детей и подростков
имеется у пациентов с хронической почечной недостаточностью (см. соответствующие
клинические рекомендации). В литературе доступны немногочисленные публикации о
эффективности рч ЭПО в сочетании с препаратами железа при АХБ у детей.
С практической точки зрения уровень сывороточного ЭПО (с-ЭПО), определяемый у
пациента с анемией, не может просто сравниваться с нормальным значением ЭПО.
Продукция ЭПО почками увеличивается обратно пропорционально степени гипоксии
(снижения концентрации Hb). Поэтому уровень с-ЭПО следует оценивать
относительно степени тяжести анемии. В каждой лаборатории рекомендуется на
основании анализа данных обследования популяции пациентов с анемией (чаще с
ЖДА) рассчитать уравнение регрессии Hb-ЭПО, которое будет моделью адекватности
продукции ЭПО степени тяжести анемии.
Для врача-клинициста важно все анемии разделить на две большие группы: I – анемии
с адекватной продукцией ЭПО и II – анемии с неадекватно низкой продукцией ЭПО
степени тяжести анемии.
Оценку адекватности продукции ЭПО проводят на основании определения отношения
логарифма, определяемого (О) уровня ЭПО (в исследуемой сыворотке) к логарифму предполагаемого (П) уровня ЭПО (в контрольной сыворотке пациента с ЖДА с тем же уровнем Hb) – коэффициент О/П (log ЭПО). Продукцию ЭПО считают неадекватно низкой степени анемии при О/П (log ЭПО) < 0,8.
При анемии с адекватной продукцией ЭПО выявляется высокая степень обратной зависимости уровня Hb от концентрации сывороточного ЭПО. То есть, чем ниже уровень Hb, тем выше концентрация ЭПО в сыворотке крови. Моделью адекватной продукции ЭПО степени анемии является ЖДА (верхняя прямая см.рисунок). При анемиях с неадекватно низкой продукцией ЭПО обратная зависимость уровня Hb от концентрации ЭПО низкая (нижняя прямая см.рисунок). Уровень эндогенного ЭПО при этом виде анемии, если и повышается, то незначительно, и не соответствует
степени снижения уровня Hb (неадекватно низкая степени анемии продукция ЭПО). В группу ЭДА относятся: анемия при хронической почечной недостаточности, АХБ,
ранняя анемия недоношенных, анемия при злокачественных новообразованиях, анемия при хронической сердечной недостаточности, анемия беременных.

Рисунок 2. Зависимость между уровнем Hb и концентрацией сывороточного эритропоэтина (ЭПО) (Log шкала) при анемии с адекватной (верхняя прямая) и неадекватно низкой (нижняя прямая) продукцией ЭПО.
В клинической практике уровень с-ЭПО <100 МЕ/л при НЬ <100 г/л может служить
индикатором неадекватно низкой продукции ЭПО степени тяжести анемии и
предиктором эффективного ответа на рчЭПО-терапию.
Уменьшение продукции ЭПО при ЭДА приводит к гипопролифера-тивному эритропоэзу. Получен ряд убедительных данных, что неадекватно низкая продукция ЭПО является следствием воздействия провоспалительных цитокинов (IJ.-1.TNF-аи INF-y). Повышенные плазменные концентрации этих цитокинов описаны у пациентов с различными ЭДА. Выявление неадекватно низкой продукции ЭПО у пациента с анемией.
1.3. Протокол применения рекомбинантного человеческого эритропоэтина для лечения АХБ у детей и подростков
Показания к применению:
Hb < 100 г/л
Противопоказания к применению:
гематокрит свыше 0,6;
лейкоцитоз свыше 40×109/л;
тромбоцитоз свыше 700×109/л;
индивидуальная непереносимость препарата
Сроки лечения:
продолжительность терапии до 12 недель.
Режимы дозирования:
150-300 МЕ/кг 3 раза в неделю подкожно или 600 МЕ/кг 1 раз в неделю внутривенно.
Терапевтический режим:
стартовая доза рч ЭПО — 150 МЕ/кг
на фоне лечения рчЭПО необходимо дополнительно назначать внутрь
или внутривенно препараты железа в суточной дозе не более 5 мг/кг для
профилактики функционального дефицита железа.
Лабораторный контроль:
общий анализ крови с подсчетом количества эритроцитов, гемоглобина,
гематокрита, ретикулоцитов, тромбоцитов перед началом терапии и на фоне
лечения каждые 7-10 дней.
Требования к результатам лечения:
целевой уровень Hb – 110 г/л
Коррекция дозы рч ЭПО:
При отсутствии полного терапевтического ответа через 2 недели применения рч-
ЭПО в дозе 150 МЕ/кг, определяемого как повышение уровня гемоглобина на ≥ 10 г/л
от исходного при отсутствии трансфузий эритроцитарной массы, разовая доза препарата увеличивается на 50 МЕ/кг. Последующее увеличение дозы рч-ЭПО
предусматривается каждые 2 недели на 50 МЕ/кг при условии недостаточной скорости
прироста уровня гемоглобина (< 5 г/л в неделю), максимально 300 МЕ/кг. Если доза в
300 МЕ/кг не дает эффекта, дальнейшее повышение дозы нецелесообразно.
Максимальная продолжительность введения рч-ЭПО – 12 недель. Если уровень Hb
повышается чрезмерно быстро (более чем на 20 г/л в неделю) или если его концентрация превышает 120 г/л, следует прекратить введение препарата.
Применение ЭСП при АХБ у детей патогенетически обосновано, однако имеет недостаточную доказательную базу. Необходимы многоцентровые рандомизированные
исследования для того, чтобы высказаться за или против применения ЭСП при АХБ в педиатрической практике. До этих пор применение ЭСП возможно в рамках исследовательских протоколов, а также в некоторых исключительных случаях, например, по религиозным убеждениям, как альтернатива гемотрансфузиям.
Диспансерное наблюдение
Учитывая симптоматический характер анемического синдрома, продолжительность наблюдения определяется клиникой основного заболевания.
Источник