Дифференциальная диагностика мегалобластных и железодефицитных анемий
Дифференциальная
диагностика МБА проводится, в первую
очередь, с другими видами анемий.
Сочетание
повышенного гемолиза с признаками
панцитопении характерно также для
аутоиммунной панцитопении,болезни
Маркиафавы-Микели.
Синдром
Имерслунд-Гресбекапредставляет
собой редкую наследственную патологию,
при которой всасывание витамина В12нарушено из-за отсутствия рецепторов
в тощей кишке, связывающих комплекс
В12-внутренний фактор. Заболевание
проявляется МБА, сочетающейся с нормальной
желудочной секрецией, нормальным
содержанием внутреннего фактора,
протеинурией без других изменений в
моче и развития почечной недостаточности.
Сочетание
в клинической картине выраженного
анемического синдрома, абдоминальных
болей и диспепсических расстройств,
иктеричности кожи и склер требует
целенаправленного диагностического
поиска для исключения онкопатологии
органов брюшной полости. По данным
нашей клиники, при первичном осмотре
больных В12ДА в стационаре
предположительный диагноз онкологического
заболевания был поставлен 60% пациентов
(Г.С. Джулай, 2000).
Во
всех случаях дефицита витамина В12следует исключитьинвазию широким
лентецом. В кале иногда могут выявляться
обрывки стробилы, яйца паразита.
Важно
выяснять особенности ранее проведенных
больному операций на органах пищеварения
(гастрэктомия, резекция желудка,
анастомоз с наличием слепой петли
кишечника). Перенесенная в прошлом
гастрэктомия скорее свидетельствует
в пользу В12ДА, в то время как после
резекции 2/3 желудка дефицита кобаламина,
как правило, не развивается.
Дифференциальный
диагноз дефицита витамина В12проводят и сдефицитом фолиевой
кислоты, последний встречается
значительно реже и отмечается при
голодании и алиментарной недостаточности
у детей, лиц, страдающих алкоголизмом,
в период беременности, а также при
употреблении противосудорожных
препаратов. С целью дифференциальной
диагностики этих состояний производят
определение содержания фолиевой кислоты
в сыворотке крови и эритроцитах. При
ФДА эти уровни снижены. В случаях, когда
данные об уровне кобаламина и фолатов
противоречивы, показано определение в
сыворотке крови метилмалоновой кислоты
и гомоцистеина. При В12ДА повышены
концентрации обоих метаболитов, при
ФДА – только гомоцистеина.
Лечение и профилактика мегалобластных анемий
Целью
лечениябольных с МБА является
достижениеполной клинико-гематологической
ремиссиипутем назначения заместительной
терапии витамином В12и (или)
фолиевой кислоты. Это предполагает
восстановление эритропоэза, ликвидацию
проявлений анемического синдрома и
поражения нервной системы, а, если
возможно, устранение причины дефицита
указанных факторов.
Выяснение
причины развития В12Да и ФДА в ряде
случаев может способствовать ее
устранению, однако у части больных
радикальное лечение невозможно, при
этом основным методом их лечения является
пожизненная заместительная терапия.
У
пациентов с преимущественно алиментарными
факторами развития МБА (вегетарианская
диета, алкоголизм, длительная кулинарная
обработка пищи и т.д.) необходима такая
организация питания, при которой в
организм поступает достаточное количество
мясных и молочных продуктов, яиц, свежих
овощей и фруктов.
Рекомендации
гематологов по проведению заместительной
терапиисводятся к следующему.
Вследствие нарушения всасывания витамина
В12в пищеварительном тракте
коррекцию его дефицита следует проводить
препаратами для парентерального
введения. С этой целью
применяютцианокобаламинигидроксокобаламин.
При внутримышечном введении поступление
этих препаратов в кровь происходит
очень быстро, но в организме остается
лишь небольшая часть препарата. Так, из
1 мг введенного цианокобаламина
усваивается лишь 50-80 мкг.
Курсовое
насыщающее лечениецианокобаламиномначинается с дозы 300-500 мкг внутримышечно
ежедневно до наступления ретикулоцитарного
криза (как правило, пик числа ретикулоцитов
достигается к концу первой недели
лечения), а затем – через день в течение
4-6 недель. Закрепление лечебного эффекта
достигается назначением цианкобаламина
по 400-500 мкг 1 раз в неделю еще в течение
2-х месяцев, а затем в той же дозе 2 раза
в месяц не менее полугода.
При
наличии признаков фуникулярного
миелозадозу цианокобаламина
увеличивают до 1000 мкг в сутки, продолжая
лечение до исчезновения всех неврологических
симптомов.
В
последующем рекомендуются ежегодные
профилактические трехнедельные курсыцианокобаламина по 400 мкг через день.
Гидроксокобаламин
является метаболитом цианокобаламина,
в организме быстрее превращается в его
активную коферментную форму и дольше
сохраняется в крови, т.к. более прочно
связывается с белками плазмы и медленнее
выводится. Для преодоления дефицита
витамина В12его достаточно вводить
через день в дозе 1 мг в сутки в течение
4 недель. Закрепление эффекта достигается
введением его в течение 6 месяцев 1 раз
в неделю, затем еще полгода 1 раз в месяц.
В последующем рекомендуются ежегодные
профилактические курсы препарата по
одной инъекции в неделю в течение 2-х
месяцев. Беременным гидроксокобаламин
не назначают.
Активная
заместительная терапия препаратами
кобаламина способствует быстрому
субъективному улучшению больных,
опережающему признаки нормализации
костномозгового кроветворения. Однако
при этом могут развиваться признаки
дефицита железа, необходимого на
построение гемоглобина, что также
нуждается в коррекции железосодержащими
препаратами.
Заместительная
терапия при ФДАпроводитсяфолиевой
кислотойв дозе 5-15 мг в сутки в течение
20-30 дней. Эта дозировка, как правило,
достаточна даже в случае нарушенного
всасывания фолатов. Обычно к парентеральному
введению препарата не приходится
прибегать. При обнаружении ФДА во время
беременности или в период лактации
лечение следует начинать с этой же дозы
препарата, после нормализации показателей
эритропоэза она может быть снижена до
1 мг в сутки на весь период беременности
и кормления грудью.
Профилактика
ФДАдолжна проводиться беременным,
страдающим наследственными и приобретенными
формами гемолитической анемии и
талассемии в дозе не более 5 мг в сутки.
МБА
не следует лечить фолиевой кислотой
эмпирически, поскольку анемия,
обусловленная нераспознанным дефицитом
витамина В12, при этом частично
излечивается, но явления фуникулярного
миелоза при этом прогрессируют.
Гемотрансфузиибольным с МБА должны назначаться лишь
по жизненным показаниям, когда больные
находятся в состоянии анемической комы
или при резком нарушении параметров
гемодинамики.
Во
всех случаях дефицита витамина В12и фолиевой кислоты применение
заместительной терапии должно приводить
к быстрой и стойкой ремиссии, отсутствие
эффекта свидетельствует о том, что
диагноз неверен.
Соседние файлы в папке Учебные пособия
- #
- #
- #
- #
- #

Фото носит иллюстративный характер. Из открытых источников
Людмила Смирнова,
заведующая кафедрой клинической гематологии и трансфузиологии БелМАПО,
доктор мед. наук,профессор.
Анемический синдром является самым распространенным гематологическим синдромом. Многие заболевания системы крови, а также других органов и систем (печени, почек, ЖКТ, иммунной системы, соединительной ткани), злокачественные опухоли различных локализаций могут начинаться с анемического синдрома. Снижение показателей гемоглобина менее 120 г/л у женщин фертильного возраста, менее 110 г/л у беременных, менее 130 г/л у мужчин выступает общепризнанным критерием анемического синдрома.
ИДЕАЛЬНОЙ КЛАССИФИКАЦИИ анемий не существует. Так, самую распространенную железодефицитную можно отнести к разным группам анемий: связанная с кровопотерей, нарушением кроветворения, опухолевым процессом и т. п. В связи с этим классификация по этиологическому принципу слишком громоздкая и неудобная для практического применения.
Андрей Воробьев и Лев Идельсон предложили рабочую классификацию анемий — патогенетическую, приемлемую для практического врача:
1) острые постгеморрагические;
2) железодефицитные;
3) связанные с нарушением синтеза или утилизации порфиринов (сидероахрестические);
4) связанные с нарушением синтеза ДНК и РНК (мегалобластные);
5) гемолитические;
6) связанные с нарушением пролиферации клеток костного мозга.
Каждая из этих групп анемий подразделяется на несколько подгрупп (или даже несколько десятков подгрупп, как, например, гемолитические).
На первом этапе распознавания анемии удобно использовать ИНДЕКСЫ КРАСНОЙ КРОВИ, предоставляемые гематологическим анализатором:
МСН — среднее содержание гемоглобина в одном эритроците. По этому критерию все анемии делятся на нормохромные (28–31 пикограмм (pg) в одном эритроците), гипохромные
( 31 pg). Нормальный показатель МСН характерен для острой постгеморрагической, гемолитической и апластической анемий;
МСV — средний объем эритроцита, нормальные границы 78–98 фемтолитров (fl). По данному показателю анемии делятся на нормоцитарные (78–98 fl), микроцитарные ( 98 fl);
RDW — широта распределения эритроцитов по объему, нормальные границы 11–14 %, выступает показателем анизоцитоза эритроцитов.
Цветовой показатель (ЦП) – устаревший индекс красной крови – показывает, является ли содержание гемоглобина в эритроцитах нормальным, повышенным или пониженным (норма 0,8–1,05). Данный показатель дает большую погрешность, его следует исключить из клинико-лабораторной практики.
Если выявляется гипохромная микроцитарная анемия (МСН
КЛИНИЧЕСКИЕ ПРИЗНАКИ ДЕФИЦИТА ЖЕЛЕЗА: сухость кожи, ломкость волос и ногтей, мышечная слабость, слабость физиологических сфинктеров, дисфагия, извращение вкуса, запаха, субфебрильная температура, повышенная раздражительность, ухудшение памяти.
Подтверждают железодефицитный характер анемии лабораторные показатели: сниженные уровни сывороточного ферритина (СФ) (отражает количество депонированного организмом железа) и сывороточного железа (СЖ). Следует помнить, что ферритин является белком острой фазы, поэтому его уровень может повышаться при наличии очага воспаления, инфекции, опухоли. Главным диагностическим критерием ЖДА является уровень СФ (см. табл. 1).
Таблица 1. Показатели тестов феррокинетики при ЖДА
Выявив гипохромную микроцитарную анемию, следует помнить, что наряду с ЖДА в эту группу входят анемии, связанные с нарушением синтеза порфиринов и гемма, АХЗ. Однако указанные патологии сопровождаются повышенным показателем СФ. АХЗ вошла в МКБ-10 в рамках класса III «Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм», блок D63 «Анемия при хронических болезнях». Развивается на фоне различных заболеваний: пневмонии, ревматоидного артрита, коллагенозов, при инфекционных болезнях, в т. ч. при туберкулезе, остеомиелите, лейкозах. Нефрогенная анемия (при хронической почечной недостаточности) не входит в настоящее время в группу АХЗ, поскольку имеет иной генез.
АХЗ имеет ряд общих признаков: всегда вторична, возникает на фоне длительного воспалительного процесса или опухоли, тяжесть зависит от величины очага воспаления или опухоли, активности процесса, отмечается рефрактерность к лечению препаратами железа. Ассоциируется с дефектной реутилизацией железа, при которой макрофаги не способны освобождать железо, полученное путем фагоцитоза эритроцитов, в циркулирующий пул на транспортирующий железо белок трансферрин. Повышенные запасы ферритина в макрофагах могут быть результатом увеличенного внутриклеточного синтеза апоферритина (белковой части ферритина) в ответ на усиленную продукцию провоспалительных цитокинов: фактора некроза опухолей альфа (TNF), интерлейкинов 1,6 (IL-1, IL-6); отражением этого является подъем ферритина в сыворотке крови, что позволяет рассматривать ферритин как белок острой фазы.
В общем анализе крови обнаруживается анемия — обычно легкой или средней степени тяжести, нормоцитарная, нормохромная или гипохромная микроцитарная. Отражением воспаления могут быть умеренный лейкоцитоз и ускоренная СОЭ, хотя наличие лейкопении не исключает диагноза АХЗ, поскольку повышенные количества гамма-интерферона могут значительно подавлять миелоидные предшественники. Характерную динамику тестов феррокинетики при двух наиболее частых анемиях в клинической практике см. в табл. 2.
Таблица 2. Тесты феррокинетики при АХЗ и при ЖДА
Из табл. 2 видно, что дифференциальная диагностика АХЗ и истинной ЖДА возможна только при условии определения сывороточного ферритина. Это имеет важное практическое значение, поскольку позволяет избежать неоправданного назначения препаратов железа при АХЗ, что нередко происходит в клинической практике.
Среди анемий, связанных с нарушением синтеза порфиринов, наиболее часто встречается
ГИПОХРОМНАЯ АНЕМИЯ при свинцовой интоксикации, с базофильной пунктацией эритроцитов, ретикулоцитозом в периферической крови и высоким содержанием сидеробластов в костном мозге. Для этой анемии характерны признаки токсического полиневрита и приступообразные боли в животе. Анамнез, указывающий на контакт со свинцом (как правило, длительный) поможет установить правильный диагноз.
Гипохромная анемия с высоким содержанием железа в сочетании с гепатомегалией, сахарным диабетом, поражением кожи (пузырьки, плохо заживающие язвы, атрофические рубцы), появления розовой мочи, признаков полиневрита дает основание думать о наследственной анемии с нарушением синтеза порфиринов.
Таким образом, в группе описанных анемий главным дифференцирующим тестом является показатель сывороточного ферритина
При выявлении макроцитоза и гиперхромии (МСV > 100 fl, MCH > 31 pg) можно предположить МЕГАЛОБЛАСТНУЮ АНЕМИЮ. В группу мегалобластных анемий (т. е. связанных с нарушением синтеза ДНК и РНК, сопровождающихся наличием в костном мозге патологических клеток красного ряда — мегалобластов) входят витамин В12-дефицитная (приобретенная и наследственная), фолиеводефицитная, а также ферментопатии (нарушение активности ферментов, участвующих в синтезе пуриновых или пиримидиновых оснований). Клинически для В12-дефицитной анемии характерны три синдрома: анемический, неврологический, поражение ЖКТ.
В периферической крови макроцитоз эритроцитов (MCV 100–160 fl, диаметр мегалоцита 12 мкм и более), отмечаются тельца Жолли, кольца Кебота, базофильная пунктация эритроцитов-макроцитов. Имеют место умеренная лейкопения (за счет нейтропении) и тромбоцитопения, что связано с неэффективным гранулоцитопоэзом и тромбоцитопоэзом. Отмечаются макроформы нейтрофилов, их гиперсегментация, снижение количества палочкоядерных, относительный лимфоцитоз. Уровень ретикулоцитов снижен (
Диагноз устанавливается по сниженному уровню витамина В12 в сыворотке крови, мегалобластическому кроветворению в костном мозге, по типичной морфологической картине периферической крови.
В дифференциально-диагностическом плане следует иметь в виду выход из гемолитического криза, лечение цитостатиками (метотрексат, цитозар и др.), которые нарушают образование ДНК, лучевую терапию онкологических заболеваний, миелодиспластический синдром, острый эритромиелоз.
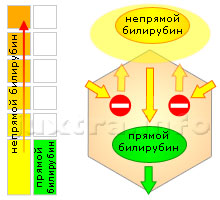
ГЕМОЛИТИЧЕСКИЕ АНЕМИИ сопровождаются укорочением жизни эритроцитов, что обусловлено их повышенным разрушением. Гемолиз приводит к гипербилирубинемии за счет непрямого билирубина, гемоглобинемии, гемоглобинурии, гиперплазии эритроидного ростка костного мозга, ретикулоцитозу.
Гемолитические анемии подразделяют на наследственные и приобретенные. Наследственные делят по принципу локализации генетически детерминированного дефекта: мембранопатии, связанные с нарушением мембраны эритроцитов (сфероцитоз, стоматоцитоз, элиптоцитоз); энзимопатии, связанные с нарушением активности ферментов эритроцитов (глюкозо-6-фосфатдегидрогеназы, 6-фосфоглюконатдегидрогеназы, глютатионредуктазы и др.); гемоглобинопатии, связанные с нарушением структуры цепей глобина (талассемии, нестабильные гемоглобины).
Из приобретенных гемолитических анемий чаще встречаются аутоиммунные гемолитические анемии (АИГА). Различают симптоматические АИГА, они могут развиваться на фоне лимфопролиферативных заболеваний, коллагенозов, неспецифического язвенного колита, хронических гепатитов, солидных злокачественных опухолей, иммунодефицита. Идиопатические АИГА представляют собой самостоятельные гематологические заболевания. На основании серологической характеристики образовавшихся антител к собственному нормальному антигену эритроцитов аутоиммунные гемолитические анемии подразделяют на АИГА с неполными тепловыми агглютининами, с тепловыми гемолизинами, с полными холодовыми агглютининами, с двухфазными гемолизинами. АИГА — нечастые заболевания: на 80 000 населения приходится 1 случай, причем более 70 % — на АИГА с неполными тепловыми агглютининами. При этом заболевании снижается гемоглобин, увеличивается уровень ретикулоцитов, отмечается выраженный анизоцитоз смешанного характера, при внутрисосудистом характере гемолиза выявляются фрагментированные эритроциты (шизоциты). В костном мозге — гиперплазия красного ростка. Характерен лейкоцитоз с левым сдвигом формулы вплоть до миелоцитов. Содержание билирубина повышено, чаще в пределах 25–100 мкмоль/л за счет непрямого. В кале повышенное количество стеркобилина. Диагноз АИГА подтверждается положительной прямой реакцией Кумбса, которая выявляет неполные антитела, фиксированные на поверхности эритроцитов.
АПЛАСТИЧЕСКАЯ АНЕМИЯ связана с недостаточностью костномозгового кроветворения, характеризуется глубокой панцитопенией. Выделяют идиопатические, токсические, лекарственные, ассоциированные с вирусами и клональными заболеваниями кроветворения, а также вторичные (на фоне солидных опухолей, системной красной волчанки и др.) апластические анемии. В периферической крови у больных отмечается нормохромная анемия. Характерны ретикулоцитопения, лейкопения за счет нейтропении, тромбоцитопения. В биохимическом анализе сывороточное железо и коэффициент насыщения трансферрина повышены, уровень сывороточного ферритина повышен. Диагноз устанавливается при обязательном гистологическом исследовании костного мозга (трепанобиопсия), где отмечается почти тотальное заполнение костномозговых полостей жировой тканью с небольшими очагами кроветворных клеток.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ У ПЕРВИЧНЫХ БОЛЬНЫХ С АНЕМИЧЕСКИМ СИНДРОМОМ НЕУТОЧНЕННОГО ГЕНЕЗА должны проводиться в несколько этапов:
- общий анализ крови с тромбоцитами и ретикулоцитами;
- определение СФ (при уровне 200 мкг/л и особенно > 500 мкг/л необходимо выполнить миелограмму после исключения мегалобластной анемии, лейкоза, целесообразна окраска мазка на берлинскую лазурь для подсчета сидеробластов, обязателен онкопоиск).
Оптимальные тесты для скрининга анемического синдрома — выявить уровень гемоглобина и СФ.
Материал адресован врачам: терапевтам, гематологам, трансфузиологам, общей практики.
В практике терапевта анемический синдром встречается в определенных ситуациях, в большинстве случаев терапевт имеет дело с симптоматическими анемиями. Знание характера анемического синдрома и сочетающихся с ним заболеваний облегчает ориентировку на начальном этапе диагностики (см. схему).
Схема
Зависимость характера анемии от патологии