Диагностика гемолитической анемии плода
Гемолитическая болезнь плода – внутриутробный иммунологический конфликт, обусловленный несовместимостью крови плода и матери по ряду антигенов, что приводит к гемолизу эритроцитов ребенка под влиянием материнских антител, преодолевающих плацентарный барьер. Гемолитическая болезнь плода может протекать в отечной, желтушной, анемической форме и даже приводить к внутриутробной гибели плода. В диагностике проводится исследование околоплодных вод (амниоцентез), пуповинной крови, билирубина и гемоглобина у новорожденного. Лечение гемолитической болезни плода требует проведения фототерапии, внутривенной инфузии растворов, обменного переливания крови.
Общие сведения
Патогенетическую основу гемолитической болезни составляют процессы, вызванные иммунологической (антиген-антитело) несовместимостью крови плода и матери. В этом случае имеющиеся в крови у плода антигены наследуются от отца, а в крови матери отсутствуют. Чаще всего (1 случай на 250 беременностей) гемолитическая болезнь плода развивается при конфликте по резус-фактору; также может возникнуть при групповой несовместимости крови и другим менее изученным антигенам. Гемолитическая болезнь плода в 3,5% случаев приводит к перинатальной смертности.
При гемолитической болезни плода под влиянием материнских антител, образующихся к антигенам плода и проникающих через плаценту, у ребенка развивается гемолиз эритроцитов и угнетение гемипоэза. Токсическое воздействие продуктов распада эритроцитов на организм плода (новорожденного) приводит к развитию анемии, увеличению билирубина и бластных (незрелых) эритроцитов.
Гемолитическая болезнь плода
Причины гемолитической болезни плода
Иммунологический конфликт, приводящий к гемолитической болезни плода, чаще всего развивается при изосерологической несовместимости крови по системе Резус (Rh), когда у матери имеется Rh-отрицательная кровь, а у плода – Rh-положительная. В таком случае он носит название резус-конфликт. Изоиммунизация при этом может происходить двумя путями: ятрогенным (при сенсибилизации женщины переливаниями Rh(+) крови в прошлом) или при плодово-материнском трансплацентарном переносе эритроцитов плода в материнский кровоток в процессе беременности и родов. В случае Rh-несовместимости гемолитическая болезнь плода редко бывает сопряжена с первой беременностью; чаще развивается от 2-ой или 3-ей беременности с возрастанием рисков с каждой последующей гестацией.
Другой возможной причиной гемолоитической болезни служит несовместимость крови плода и матери по системе АВ0, т. е. при группе крови матери 0 (I), а у плода любой другой. При этом антигены А и В от плода проникают через плаценту в материнский кровоток и вызывают выработку иммунных α- и β- антител с последующим конфликтом «антиген-антитело». Гемолитическая болезнь плода при АВО-несовместимости имеет более легкое течение, чем при Rh-несовместимости. При АВ0-несовместимости гемолитическая болезнь плода может развиться уже в течение 1-ой беременности.
В относительно редких случаях гемолитическая болезнь плода может быть связана с иммунологическими конфликтами по системам Даффи, Келл, MNSs, Кидд, Лютеран и др. или антигенам P, S, N, М.
Проявления гемолитической болезни плода
У беременных специфической картины патологии не наблюдается; иногда нарастание внутриутробных реакций может вызывать у женщины симптомокомлекс, сходный с гестозом. Гемолитическая болезнь плода может проявляться следующими вариантами: внутриутробной гибелью плода в период с 20 по 30 неделю беременности; отечной, желтушной или анемической формах. Общими проявлениями, характерными для всех форм гемолитической болезни плода, служат наличие нормохромной анемии с увеличением в крови эритробластов, гепатомегалии и спленомегалии.
При отечном варианте гемолитической болезни у плода увеличиваются размеры селезенки, печени, сердца, желез, нарастает гипоальбуминемия. Эти изменения сопровождаются выраженным отеком подкожно-жировой клетчатки, асцитом, перикардитом, плевритом, увеличением массы ребенка в 2 раза по сравнению с нормой. При отечном варианте гемолитической болезни плода отмечается резко выраженная анемия (Er -1-1,5 x 1012/л, Нb 35-50 г/л), эритробластемия, увеличение и отечность плаценты. Тяжелые нарушения обмена могут вызывать внутриутробную гибель плода или смерть ребенка вскоре после родов. Отечную форму гемолитической болезни плода отличает крайне тяжелое течение, что в большинстве случаев приводит к летальному исходу.
При желтушном варианте гемолитической болезни плода ребенок чаще рождается от срочных родов, доношенным, чаще с нормальным цветом кожи. В этом случае гемолитическая болезнь плода проявляется спустя несколько часов после рождения – у ребенка стремительно нарастает желтушная окраска кожи; реже желтуха бывает врожденной. У новорожденных с желтушной формой гемолитической болезни увеличены селезенка, печень, лимфоузлы, иногда сердце, отмечается интенсивный прирост непрямого билирубина в крови.
Гипербилирубинемия опасна возможностью повреждения гепатоцитов, кардиомиоцитов, нефронов, нейронов с развитием билирубиновой энцефалопатии. При ядерной желтухе (билирубиновой интоксикации) ребенок вялый, плохо сосет, часто срыгивает, у него развивается гипорефлексия, рвота, судороги. Критический уровень непрямого билирубина, опасный в плане поражения ЦНС, — более 306-340 мкмоль/л у доношенных и 170-204 мкмоль/л у недоношенных. Следствием билирубиновой энцефалопатии может являться гибель ребенка или последующее отставание в психическом развитии.
При анемической форме гемолитической болезни повреждающее воздействие на плод, как правило, невелико. На первый план выходят анемия, бледность кожи, гепатомегалия и спленомегалия. Тяжесть проявлений гемолитической болезни плода определяется титром антител у беременной и степенью зрелости новорожденного: тяжелее заболевание протекает у недоношенных детей.
Диагностика гемолитической болезни плода
В настоящее время акушерство и гинекология придает важное значение своевременному выявлению и правильному ведению беременности, угрожаемой по развитию гемолитической болезни плода. При постановке беременной на учет у нее определяют группу крови и Rh-фактор, выясняют аналогичные данные отца ребенка, интересуются гемотрансфузионным анамнезом, наличием в прошлом мертворожденных детей, самопроизвольных выкидышей или детей с гемолитической болезнью плода. При угрозе развития гемолитической болезнью плода у женщины в динамике контролируют титр специфически антител.
Пренатальная диагностика гемолитической болезни плода включает проведение акушерского УЗИ, допплерографии маточно-плацентарного кровотока и максимального кровотока в средней мозговой артерии с оценкой функционального состояния развивающегося ребенка. Характерными ультразвуковыми критериями гемолитической болезни плода являются плацентомегалия, многоводие, расширение пуповинной вены; сплено- и гепатомегалия, кардиомегалия, наличие перикардиального выпота, гидроторакса.
Учитывая, что гемолитическая болезнь часто сопровождается гипоксией, проводится кардиотокография с оценкой сердечной деятельности плода. В случае получения данных за гемолитическую болезнь плода требуется проведение инвазивных исследований – кордоцентеза и амниоцентеза под контролем УЗИ. При рождении ребенка сразу определяется его резус и групповая принадлежность, исследуется содержание Hb и билирубина в пуповинной крови.
Лечение гемолитической болезни плода
Лечебными задачами при гемолитической болезни плода служат быстрое выведение из крови ребенка токсических факторов гемолиза – непрямого билирубина и антител, а также повышение функций страдающих систем и органов. Выбор способа родоразрешения женщин с изоиммунизацией определяется состоянием плода, сроком беременности, подготовленностью родовых путей. В случае отсутствия данных за тяжелую форму гемолитической болезни плода, на сроке беременности свыше 36 недель, зрелости шейке матки возможны естественные роды. При тяжелом состоянии плода предпочтительнее кесарево сечение за 2-3 недели до ожидаемого срока.
У новорожденных с гемолитической болезнью плода ежедневно контролируется показатели Hb, Ht, билирубина. При необходимости проводится коррекция анемии эритроцитарной массой, инфузионная дезинтоксикационная терапия. Важной составляющей лечения гемолитической болезни плода служит фототерапия, способствующая разрушению непрямого билирубина в коже ребенка. Светолечение проводится в импульсном или непрерывном режиме с помощью ламп дневного или синего света.
При более тяжелых проявлениях гемолитической болезни плода показано проведение капельного внутрижелудочного введения жидкости и заменного переливания крови. При гемолитической болезни плода, обусловленной Rh-конфликтом, при заменном переливании используется одногруппная Rh (-) кровь. В случае несовместимости по ABO переливается эритроцитная масса 0(I) группы в соответствии с Rh-принадлежностью новорожденного и одногруппная плазма. Развитие отека легких и выраженной дыхательной недостаточности требует проведения ИВЛ; наличие асцита диктует необходимость выполнения лапароцентеза под УЗИ-контролем.
Профилактика гемолитической болезни плода
Заключается в предупреждении Rh-иммунизации женщин – внимательном переливании крови с учетом Rh-принадлежности. Женщинам с Rh(-) кровью категорически не рекомендуется прерывание беременности, наступившей впервые. Методом специфической профилактики Rh-конфликта у женщин с Rh(-) кровью служит введение иммуноглобулина антирезус Rho человека после абортов, родов Rh(+) плодом, внематочной беременности, а также после инвазивной пренатальной диагностики — биопсии хориона, амниоцентеза, кордоцентеза.
Источник

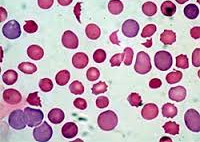
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
Общие сведения
Гемолитическая анемия (ГА) — малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.
Патогенез
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Классификация
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии — анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические — анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом — обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические анемии связаны с недостатком определенных ферментов эритроцитов (чаще — Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет. Особенностям клинического течения гемоглобинопатий — талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Диагностика
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.
Лечение
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.
Источник