Цитокины и атеросклероз молекулярные механизмы патогенеза
Атеросклероз
– хроническое прогрессирующее заболевание
крупных и средних эластических и
мышечно-эластических артерий. Атеросклероз
характеризуется пролиферативно-синтетическим
ответом ряда клеток сосудистой стенки
и крови – гладкомышечных макрофагов,
тромбоцитов, фибробластов на патологические
(качественно своеобразные или количественно
избыточные) ЛП, с формированием в интиме
фиброатером.
Причины
развития атеросклероза:
Гиперхолестеринемия;
Гиперлипидемия
ЛПОНП, ЛППП и ЛПНП (вызывают генетические
дефекты рецепторов, апобелков, СД,
гипотериоз, переедание).Изменение
нормальной структуры ЛПНП под действием
ПОЛ и гипергликемии. Избыток глюкозы
гликозилирует апобелки, повышенное
ПОЛ (при гипоксии, воспалении) повреждает
липиды и апобелки ЛП. Модифицированные
ЛПНП становятся чужеродными для
организма, атакуются антителами и
поглощаются макрофагами с участием
«скевенджер-рецепторов»
(рецепторов-мусорщиков);Повреждение
сосудистой стенки высоким артериальным
давлением (психоэмоциональные стрессы),
ПОЛ (гипоксия, курение (через СО),
воспаления), иммунными реакциями,
токсинами и другими ядовитыми веществами
(Pb,
Cd).
Повреждающие факторы разрыхляют и
истончают (до исчезновения) гликокаликс
энтероцитов, увеличивают межэндотелиальные
щели, что создает на поверхности
эндотелия зоны повышенной клейкости
и проницаемости;Принадлежность
к мужскому полу (гормональный статус).
Молекулярные
механизмы развития атеросклероза
Развитие
атеросклероза проходит в 6 стадий:
Стадия
измененного эндотелия.
На поверхности поврежденного эндотелия
скапливаются тромбоциты и моноциты.
Модифицированные ЛПНП проникают под
поврежденный эндотелий сосудов. За
ними направляются моноциты (в ткани
они макрофаги) и захватывают ЛП через
скевенджер-рецепторы. Этот процесс не
ингибируется избытком ХС, поэтому
макрофаги перегружаются ХС и превращаются
в «пенистые клетки».
Отдельные «пенистые клетки» есть у
новорожденных.Стадия
жировых полосок.
При увеличении количества «пенистых
клеток» они образуют липидные
полоски.
«Пенистые» клетки адсорбируют все
остальные липиды без разбора. Поврежденный
эндотелий, активированные макрофаги,
тромбоциты выделяют БАВ, которые
стимулируют пролиферацию ГМК и миграцию
их в очаг повреждения.Стадия
переходная.
Активированные ГМК синтезируют коллаген
и эластин, что приводит к прорастанию
бляшки фиброзной тканью. Клетки под
фиброзной оболочкой некротизируются,
а ХС начинает откладываться в межклеточном
пространстве. Может происходить разрыв
эндотелия сосудов.Стадия
атеромы. ХС
межклеточного пространства формирует
в центре бляшки липидную каплю –
атерому,
которая через разрушенный эндотелий
выступает в просвет сосуда.Стадия
фиброатеромы.
Атерома пропитываясь солями кальция,
белками, ГАГ и приобретает плотную
фиброзную крышку. Атерома становиться
фиброатеромой.Стадия
осложнения фиброатеромы.
Фиброатерома не стабильна, она может
надрываться и изъявляться, что приводит
к обострению атеросклероза.
Осложнения.
Поврежденный эндотелий прекращает
синтез PGI2,
который в норме ингибирует тромбоциты.
Тромбоциты активируются и секретируют
тромбоксан ТХА2
и тромбоцитарный фактор роста (пептид).
Тромбоцитарный фактор роста привлекает
в бляшку клетки крови, ГМК, что способствует
росту бляшки и развитию очага воспаления.
ТХА2 →
агрегацию
тромбоцитов →
образование тромбов → закупорка сосудов
→ ишемия тканей → некроз тканей →
изъявления стенок сосудов → кровотечения,
аневризмы. Оторвавшиеся тромбы → эмболии
сосудов.
Чаще
всего атеросклероз развивается в
коронарных, мозговых, почечных артериях,
артериях нижних конечностей и в аорте.
Атеросклероз коронарных артерий
проявляется ИБС, мозговых – ИБ мозга,
почек – вазоренальной артериальной
гипертензией. Спазм или тромбоз коронарных
сосудов ведет к инфаркту миокарда,
эмболия сонных артерий ведет к развитию
инсультов.
Смертность
от последствий атеросклероза (инфаркт
миокарда, инсульт) лидирует в общей
структуре смертности населения.
Биохимические
основы лечения атеросклероза
Лечение
гиперхолестеролемии, как правило,
комплексное.
I
Диета. Необходимо
употреблять:
продукты
гипокалорийные, гипохолестериные, с
низким содержанием легкоусвояемых
углеводов (растительная пища). Поступление
ХС с пищей не должно превышать 0,3 мг/сут;полиеновые
ЖК семейства ω-3 (морепродукты). Из них
синтезируются простагландины,
подавляющие тромбообразование и
замедляют развитие атеросклеротической
бляшки. Ненасыщенные ЖК также ускоряют
выведение ХС из организма (механизм
не ясен);витамины
С, Е, А и другие антиоксиданты ингибирующие
ПОЛ и поддерживающие нормальную
структуру ЛПНП и их метаболизм.
Липримал
дает самый сильный эффект
II.
«Размыкание» цикла энтерогепатической
циркуляции жёлчных кислот. Лекарства
типа холестирамина, холестипол
(полимеры) адсорбируют в кишечнике
жёлчные кислоты, выделяются с фекалиями
и таким образом уменьшают возврат
жёлчных кислот в печень. В печени
увеличивается захват ХС из крови для
синтеза новых жёлчных кислот.
III.
Ингибирование синтеза ХС.
Наиболее эффективные препараты для
лечения атеросклероза — ингибиторы
ГМГ-КоА-редуктазы, например антибиотик
мевакор.
Такие препараты могут почти полностью
подавить синтез ХС в организме, нормализуя
уровень ХС.
IV.
Активация катаболизма ЛП.
Лекарственные препараты — фибраты
(клофибрат, фенофибрат) активируют ЛПЛ
и ускоряют катаболизм ЛПОНП. Эти препараты
также активируют окисление ЖК в печени,
уменьшая тем самым синтез ТГ и ЭХС и,
как следствие, секрецию ЛПОНП печенью.
Для
эффективного лечения атеросклероза
применяют, как правило, комбинированное
воздействие нескольких лекарственных
препаратов.
|
Берсенёв Алексей Вячеславович диссертация
По
современным представлениям атеросклероз
– это хроническая системная воспалительная
реакция организма, развивающаяся на
фоне дислипидемии и сопровождающаяся
образованием одиночных или множественных
очагов липидных отложений (атероматозных
бляшек) на внутренней поверхности
сосудов [134].
Полагают,
что именно системная воспалительная
реакция способствует развитию дислипидемии
(ДЛП) и запускает процесс атерогенеза
[33,53]. В свою очередь алиментарные и
наследственные ДЛП также индуцируют
проявления синдрома системного
воспалительного ответа и усугубляют
тяжесть атеросклеротического поражения
сосудов в организме [12,13,18,22,43].
В
присутствии провоспалительных факторов,
таких как окисленные ЛП (в особенности
низкой и очень низкой плотности)
[16,18,43], инфекционные агенты [33,53] и
различные неспецифические стресс-факторы,
в организме активируется
макрофагально-моноцитарная система и
усиливается выработка провоспалительных
цитокинов (интерлейкинов: IL-1, 6, фактора
некроза опухоли: TNF-α и др.). Эти цитокины,
с одной стороны, вызывают в сосудистом
эндотелии экспрессию молекул адгезии
– ICAM-1, ICAM-2 (intracellular adhesion molecules), VCAM-1
(vascular cell adhesion molecules), селектины и др. и
нарушают структуру эндотелиальной
выстилки сосудов, а с другой вызывают
экспрессию в гепатоцитах генов,
ответственных за синтез в печени
острофазных белков. Участие печени в
острофазном процессе и, следовательно,
в инициации и модуляции системной
воспалительной реакции организма
[66,134], смещает в ней баланс биохимических
механизмов, что вызывает прежде всего,
нарушения липидного обмена, поскольку
печень играет центральную роль в
регуляции этого вида обмена в организме.
Длительно поддерживаемая в организме
активация макрофагально-моноцитарной
системы из адаптивной постепенно
превращается в повреждающую, при которой
не только нарушается регуляция печенью
липидного обмена, но и создаются условия
для прогрессирования ДЛП и атеросклероза,
а также для развития их осложнений
[12,13,22].
При
ДЛП и атеросклерозе клетками-мишенями
(при системной воспалительной реакции)
являются, прежде всего, клетки печени
– гепатоциты, купферовские клетки,
эндотелиоциты, а также эндотелиальная
выстилка сосудов [16,17], изменения в
которых развиваются параллельно,
постепенно прогрессируют, ведут к
формированию хронического гепатита
[17], а также к типичному повреждению
сосудистой стенки атеросклеротическим
процессом.
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Множество факторов вносит вклад в патогенез атеросклероза, в том числе эндотелиальная дисфункция, дислипидемии, воспалительные и иммунологические факторы, разрыв бляшки, и курение.
Эндотелиальная дисфункция
Эндотелий формирует активный биологический субстрат между кровью и другими тканями, образует уникальный тромборезистентный слой между кровью и потенциально тромбогенными субэндотелиальными тканями. Эндотелий также модулирует тонус, рост, гемостаз и воспаление по всей системе кровообращения. Эндотелиальная сосудорасширяющая дисфункция является начальным шагом в развитии атеросклероза и вызвана главным образом потерей эндотелием оксида азота
Эндотелиальная дисфункция связана со многими из традиционных факторов риска развития атеросклероза, в том числе гиперхолестеринемией, сахарным диабетом, гипертонией, курением сигарет. В частности, дисфункция эндотелия индуцируется окислением липопротеинов низкой плотности (ЛПНП), а в некоторых отношениях это можно рассматривать в качестве конечного и основного фактора. Это может быть улучшено путем коррекции диеты, с помощью терапии статинами (ГМГ-КоА редуктазы), что повышает биодоступность оксида азота, применения ингибиторов фермента, преобразующего ангиотензин, высокими дозами антиоксидантов, таких как витамин С или флавоноиды, содержащиеся в красном вине и фиолетовом виноградном соке. Однако клинические преимущества этих методов лечения были убедительно продемонстрированы только для статинов.
1. Воспаление. Признаки воспаления в атеросклеротических поражениях были отмечены, начиная с самых ранних гистологических наблюдений и воспаление имеет центральное значение для понимания патогенеза атеросклероза. Макрофаги, которые были модифицированы путем окисленного LDL высвобождения различных воспалительных веществ, цитокины и факторы роста [29,30]. Среди многочисленных клеток , которые были вовлечены являются: модифицированные путем окисления макрофаги, цитокины, факторы роста, белок хемотаксиса моноцитов (МСР) -1, растворимый CD40 лиганд; интерлейкин (IL) -1, ИЛ-3, ИЛ-6, ИЛ-8 и ИЛ-18 и фактор некроза опухолей альфа. Сывороточный С-реактивный белок связан с атеросклеротическими сердечно-сосудистыми заболеваниями, однако генетические данные не подтверждают его роль в качестве причинного фактора риска. Липопротеин-ассоциированная фосфолипаза А2 (Lp-PLA2) является макрофаг-секретируется ферментом, высокое содержание которого повышает риск развития инфаркта миокарда (ИМ) и инсульт в популяционных исследованиях. Цитокины могут участвовать в патогенезе атеросклероза. Медиаторы, такие как интерлейкин-1 или фактора некроза опухоли-альфа имеют множество атерогенных эффектов. Они усиливают экспрессию молекул клеточной поверхности, таких как ICAM-1, VCAM-1, CD40, CD40L и селектина на эндотелиальных клетках, гладких мышечных клеток и макрофагов. Провоспалительные цитокины могут также индуцировать клеточную пролиферацию, способствуют выработке активных форм кислорода, стимулируют металлопротеиназы матрикса, и индуцируют экспрессию тканевого фактора. Другие цитокины, такие как интерлейкин-4 и интерлейкин-10, являются антиатерогенными. активация лейкоцита — лейкоцитарный (циркулирующих моноцитов, а также в меньшей степени Т-лимфоциты), набор наблюдается в начале атеросклеротического поражения, обеспечивая некоторые доказательства роли системного воспаления.
2. Дислипидемии. Липидные аномалии играют решающую роль в развитии атеросклероза. Эпидемиологические исследования, проведенные в странах по всему миру, показали увеличение числа случаев атеросклероза, когда концентрации холестерина в сыворотке крови были выше 150 мг / дл (3,9 ммоль / л).
Полезно обобщить основные замечания.
Высокий уровень липопротеидов низкой плотности (ЛПНП)холестерина и низкий уровень липопротеинов высокой плотности (ЛПВП), являются особенно важными факторами риска развития атеросклероза.
Липопротеиды низкой плотности накапливаются в эфире холестерина обогащенных макрофагов (пенистые клетки) атеросклеротической бляшки. Накопление холестерина в пенистых клетках приводит к митохондриальной дисфункции, апоптозу и некрозу, с выпуском клеточных протеаз, воспалительных цитокинов и протромботических молекул.
Окисленные липопротеины низкой плотности, способствуют воспалительным и иммунным изменениям с увеличением агрегации тромбоцитов и развития нестабильности бляшки. Уровни окисленных ЛПНП увеличены у пациентов с острым коронарным синдромом и положительно коррелируют с тяжестью синдрома.
Липопротеиды высокой плотности , в отличие от липопротеидов низкой плотности , имеют предположительные антиатерогенные свойства, которые включают обратный транспорт холестерина, поддержание функции эндотелия, а также защиту от тромбоза. Существует обратная зависимость между уровнем липопротеидов высокой плотности-холестерина в плазме и сердечно-сосудистыми рисками.
Текущие эпидемиологические и генетические данные подтверждают причинную роль для богатых триглицеридами липопротеинов, особенно те, которые содержат аполипопротеин C3.
Роль липопротеина является довольно многомерная благодаря своей структуре, где липопротеин низкой плотности-подобный фрагмент липопротеина -а, способствовует развитию атеросклероза тромбообразованию, препятствуя фибринолизу. Дополнительные функции Липопротеина-а включают в себя инициирование сигнальных путей в макрофагах и сосудистых эндотелиальных клетках, что приводит к изменениям клеточного фенотипа и проатерогенной экспрессии генов, образование пенистых клеток.
3. Гипертония. Артериальная гипертензия является одним из основных факторов риска развития атеросклероза, особенно в коронарных и церебральных артериях. Это может увеличить напряжение артериальной стенки, что может привести к нарушению процессов регенерации и образованию аневризм(патологическое выпячивание стенки артерии).
4. Курение. Курение сигарет является еще одним важным фактором риска, и это влияет на все фазы атеросклероза от эндотелиальной дисфункции до острых клинических событий, причем последний в значительной степени. Следующие наблюдения были сделаны:
В организме человека, воздействие сигаретного дыма ухудшает эндотелий-зависимую вазодилатацию, возможно, путем сокращения оксида азота (NO) .
Курение сигарет связано с повышенным уровнем нескольких маркеров воспаления, включая С-реактивного белка, интерлейкина-6 и фактора некроза опухоли альфа у мужчин и женщин
Курение сигарет может снизить доступность тромбоцитарного оксида азота ( NO), уменьшает чувствительность тромбоцитов к экзогенному оксиду азота NO (оба фактора могут привести к увеличению активации и адгезии, увеличение уровня фибриногена,а также уменьшить фибринолиз.
Курение сигарет увеличивает окислительной модификации ЛНП и снижает плазменную активность параоксоназы, фермент, который защищает от окисления липопротеидов низкой плотности.
5. Сахарный диабет. В дополнение к атерогенному эффекту от дислипидемии, исследования показали, что высокие уровни инсулина предшествуют развитию заболеваний артерий. Атеросклероз и тип 2 диабета имеют схожие патологические механизмы, в том числе повышение уровней цитокинов, таких как МСР-1 и интерлейкин-6 (ИЛ-6), которые вносят вклад в ускоренную прогрессию атеросклероза.
Клиническое значение атеросклероза и его осложнений пробудило огромный интерес к исследованию механизмов, лежащих в основе этого заболевания. Ранее были выдвинуты две основные гипотезы: одна из них подчеркивает значение пролиферации клеток интимы, другая фокусирует внимание на рецидивирующем тромбообразовании и организации тромбов.
Современные представления об атерогенезе заимствуют элементы обеих теорий и добавляют описанные ранее факторы риска. Согласно гипотезе «ответ на повреждение» атеросклероз представляет собой хроническую воспалительную реакцию и процесс заживления артериальной стенки в ответ на повреждение эндотелия. Поражение прогрессирует в результате взаимодействия модифицированных липопротеинов, макрофагов моноритарного происхождения и Т-лимфоцитов с нормальными клеточными компонентами артериальной стенки.
Соответственно этой модели атеросклероз обусловливают следующие патогенетические процессы:
— хроническое повреждение эндотелия приводит к повышенной сосудистой проницаемости, адгезии лейкоцитов и тромбозу;
— накопление липопротеинов (в основном ЛПНП и их окисленных форм) в стенке сосудов;
— адгезия моноцитов к эндотелию с их последующей миграцией и трансформацией в макрофаги и пенистые клетки;
— адгезия тромбоцитов;
— высвобождение факторов активированными тромбоцитами, макрофагами и клетками сосудистой стенки, включая миграцию гладкомышечных клеток либо из медии сосудистой стенки, либо из циркулирующих клеток-предшественников;
— пролиферация гладкомышечных клеток и образование ВКМ;
— накопление липидов как вне, так и внутри клеток (макрофагов и гладкомышечных клеток).
Теперь детально рассмотрим основные механизмы атерогенеза.
а) Повреждение эндотелия. В основе гипотезы «ответ на повреждение» лежит дисфункция эндотелия, а не утрата его вследствие любого типа повреждения (путем механического слущивания, под влиянием гемодинамических сил, отложения иммунных комплексов, облучения или химических веществ), когда происходит лишь утолщение интимы. Ранние повреждения стенки сосуда в случае богатой липидами диеты и других факторов риска появляются в участках морфологически интактного эндотелия, но с нарушенной функцией. Такой эндотелиальный слой имеет повышенную проницаемость, усиленную адгезию лейкоцитов и измененную экспрессию генов.
Специфические этиологические факторы, способствующие дисфункции эндотелия при раннем атеросклерозе, изучены недостаточно полно. К этим факторам относятся гипертензия, гиперлипидемия, токсичные вещества табачного дыма, гипергомоцистеинемия и инфекции. Воспалительные цитокины, в частности фактор некроза опухолей (TNF), также могут стимулировать проатерогенные формы экспрессии генов эндотелиальных клеток. Наиболее важные причины дисфункции эндотелия — гемодинамические нарушения и гиперхолестеринемия.
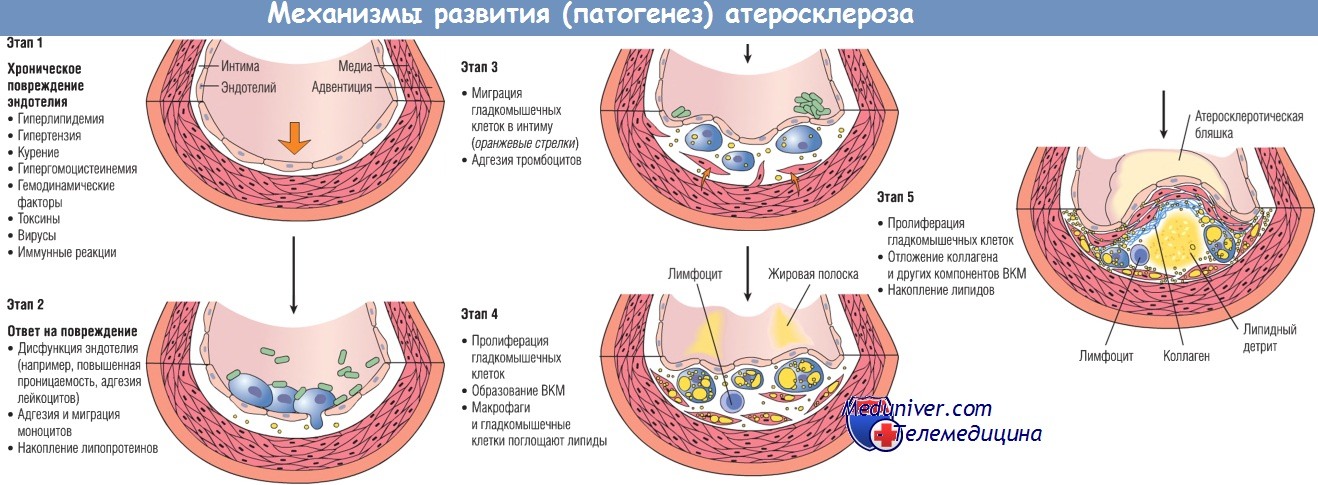
Развитие изменений артериальной стенки согласно гипотезе «ответ на повреждение».
ВКМ — внеклеточный матрикс.
б) Гемодинамические нарушения. Значение гемодинамических нарушений в патогенезе атерогенеза иллюстрирует факт, что бляшки имеют тенденцию локализоваться в устьях артерий крупного калибра, участках ветвления артерий и вдоль задней стенки брюшной аорты, т.е. там, где кровоток имеет особые характеристики. Исследования in vitro показали, что нетурбулентный ламинарный кровоток в нормальной сосудистой сети индуцирует гены, продукты которых (например, антиоксидантная супероксиддисмутаза) защищают от атеросклероза. Такие «атеропротективные» гены объясняют неслучайную локализацию ранних атеросклеротических поражений.
в) Липиды. Липиды обычно транспортируются с кровотоком, будучи связанными со специфическими апопротеинами (в виде липопротеиновых комплексов). Дислипопротеинемия является результатом мутаций, изменяющих апопротеины или клеточные рецепторы липопротеинов, а также результатом других состояний, влияющих на уровень липидов (например, нефротического синдрома, алкоголизма, гипотиреоза, сахарного диабета). К частым аномалиям липидного статуса (присутствующим у многих пациентов, перенесших инфаркт миокарда) относятся:
(1) повышенный уровень ЛПНП;
(2) сниженный уровень ЛПВП;
(3) повышенный уровень аномального липопротеина (а).
Причастность гиперхолестеринемии к атерогенезу доказывают следующие данные:
— преобладающими липидами в атеросклеротических бляшках являются холестерин и его эфиры;
— генетические дефекты захвата и метаболизма липопротеинов, обусловливающие липопротеинемию, ассоциируются с ранним атеросклерозом. Так, гомозиготная семейная гиперлипопротеинемия из-за дефекта рецепторов ЛПНП и неадекватного поглощения ЛПНП в печени может вызвать инфаркт миокарда до возраста 20 лет. Ранний атеросклероз получен в экспериментах на животных с генетически созданным дефицитом аполипопротеинов или рецепторов ЛПНП;
— другие генетические или приобретенные заболевания (например, сахарный диабет, гипотиреоз), вызывающие гиперхолестеринемию, способны стать причиной раннего атеросклероза;
— эпидемиологический анализ показал корреляцию между тяжестью атеросклероза и уровнем общего холестерина или ЛПНП в плазме;
— снижение уровня холестерина в сыворотке при соответствующей диете или на фоне приема лекарственных средств замедляет скорость прогрессирования атеросклероза, вызывает регрессию некоторых бляшек и снижает риск сердечнососудистых осложнений.
Механизмы, посредством которых хроническая гиперлипидемия способствует атерогенезу:
— хроническая гиперлипидемия, особенно гиперхолестеринемия, может непосредственно нарушать функцию эндотелиальных клеток, повышая местную продукцию свободных радикалов кислорода, называемых активными формами кислорода (АФК). АФК способны повреждать ткани за счет ускоренного распада оксида азота, что снижает его вазодилататорную активность;
— при хронической гиперлипидемии липопротеины накапливаются в интиме. Эти липиды окисляются под действием АФК, продуцируемых макрофагами или эндотелиальными клетками местно. Окисленные ЛПНП поглощаются макрофагами с помощью скавенджер-рецепторов, отличающихся от рецепторов ЛПНП, и накапливаются в фагоцитах (пенистых клетках). Кроме того, окисленные ЛПНП стимулируют высвобождение факторов роста, цитокинов и хемоки-нов эндотелиальными клетками и макрофагами, что усиливает миграцию моноцитов в поврежденные участки. Наконец, окисленные ЛПНП цитотоксичны для эндотелиальных и гладкомышечных клеток и способны индуцировать дисфункцию эндотелия. На роль окисленных ЛПНП в атерогенезе указывает факт их накопления в макрофагах на всех стадиях формирования атеросклеротических бляшек.
г) Воспаление. Процесс воспаления способствует инициации, прогрессированию и развитию осложнений атеросклероза. В норме сосудистая стенка не адгезирует воспалительные клетки, но уже на ранних стадиях атерогенеза артериальные эндотелиальные клетки с нарушенной функцией экспрессируют молекулы, стимулирующие адгезию лейкоцитов. В частности, молекула адгезии сосудистого эндотелия 1 (VCAM-1) обеспечивает адгезию моноцитов и Т-клеток к эндотелию. После этого они мигрируют в интиму под влиянием местно продуцируемых хемокинов.
Моноциты трансформируются в макрофаги и с высокой авидностью поглощают липопротеины, включая ЛПНП. Миграция и дифференцировка моноцитов в макрофаги (и в конечном итоге в пенистые клетки) теоретически носит протективный характер, поскольку эти клетки удаляют потенциально болезнетворные липидные частицы. Однако окисленные ЛПНП стимулируют активацию макрофагов и продукцию цитокинов (например, TNF). Это еще больше повышает адгезию лейкоцитов и продукцию хемокинов (например, моноцитарного хемоаттрактантного белка 1), что дает стимул для миграции дополнительного количества мононуклеарных воспалительных клеток. Активированные макрофаги продуцируют также реактивные метаболиты кислорода, усиливающие окисление ЛПНП, и секретируют факторы роста, индуцирующие пролиферацию гладкомышечных клеток.
Т-лимфоциты, привлеченные в интиму, взаимодействуют с макрофагами и поддерживают хроническую воспалительную реакцию. Нет четкого представления, реагируют ли Т-клетки на специфические антигены (например, на бактериальные или вирусные антигены, на белки теплового шока, на модифицированные составляющие сосудистой стенки и липопротеины) или они неспецифически активируются в условиях локального воспаления. Как бы там ни было, активированные Т-клетки вырабатывают в зоне повреждения интимы воспалительные цитокины (например, IFN-y), которые могут стимулировать макрофаги, эндотелиальные и гладкомышечные клетки.
Вследствие хронического воспаления активированные лейкоциты и клетки сосудистой стенки высвобождают факторы роста, стимулирующие пролиферацию гладкомышечных клеток и синтез ВКМ.
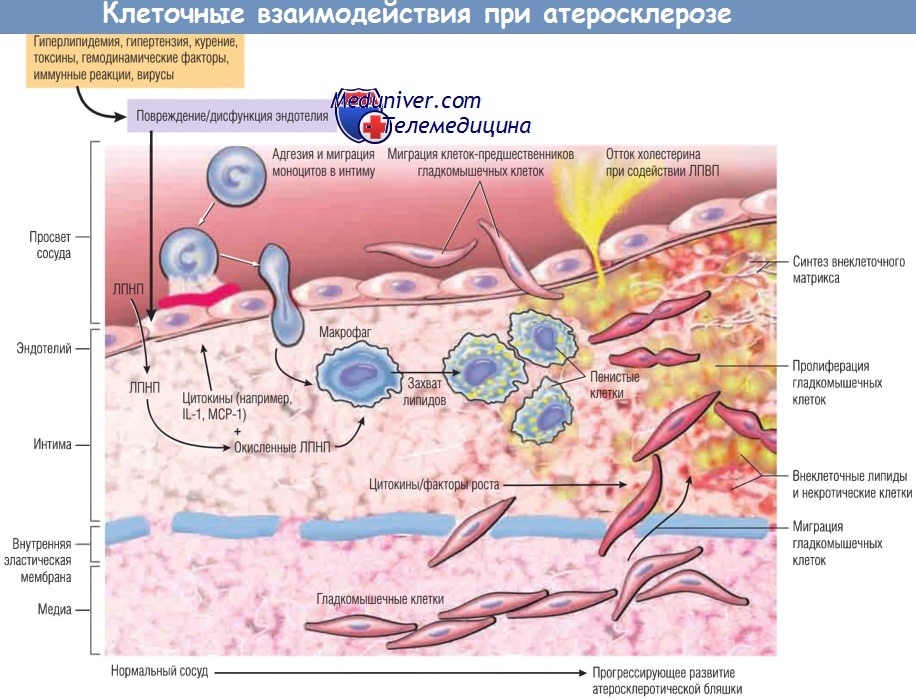
Гипотеза клеточных взаимодействий при атеросклерозе.
Предполагается, что гиперлипидемия и другие факторы риска повреждают эндотелий,
что приводит к адгезии тромбоцитов и моноцитов и высвобождению факторов роста (включая тромбоцитарный фактор роста),
индуцирующих миграцию и пролиферацию гладкомышечных клеток.
Пенистые клетки атеросклеротических бляшек образуются из макрофагов с помощью рецепторов липопротеинов очень низкой плотности и скавенджер-рецепторов модифицированных липопротеинов низкой плотности (ЛПНП),
например окисленных ЛПНП, и гладкомышечных клеток (механизм образования менее изучен).
Внеклеточные липиды попадают в бляшку из просвета сосуда, особенно в случае гиперхолестеринемии, а также из дегенерирующих пенистых клеток.
Накопление холестерина в бляшке отражает дисбаланс между притоком и оттоком холестерина,
а липопротеины высокой плотности (ЛПВП), вероятно, способствуют выведению холестерина из бляшки.
Гладкомышечные клетки мигрируют в интиму, пролиферируют и продуцируют ВКМ, включая коллаген и протеогликаны.
IL-1 — интерлейкин-1; МСР-1 — моноритарный хемоаттрактантный белок 1.
д) Инфекция. Было бы заманчиво предположить, что инфекция может индуцировать местный воспалительный процесс, лежащий в основе атеросклероза, однако эта гипотеза еще нуждается в доказательстве. В атеросклеротических бляшках обнаружены герпес-вирус, цитомегаловирус и С. pneumoniae, и у пациентов с тяжелым атеросклерозом сероэпидемиологические данные указывают на повышенный титр антител к С.pneumoniae. Не ясно, участвует ли С. pneumoniae в патогенезе атеросклероза, поскольку она часто ассоциируется с бронхитом и курением, которое является фактором риска ИБС. Данная инфекция широко распространена (как и атеросклероз), поэтому трудно определить, есть ли причинная связь или это просто совпадение.
Тем не менее вполне возможно, что микроорганизмы способны инфицировать атеросклеротические бляшки на ранней стадии их формирования, при этом чужеродные антигены могут потенцировать атерогенез, индуцируя местный иммунный ответ, или инфекционный агент способствует развитию местного протромботического статуса.
и) Пролиферация гладкомышечных клеток. Пролиферация гладкомышечных клеток и формирование ВКМ превращают жировые полоски (наиболее ранняя стадия поражения) в зрелую атеросклеротическую бляшку и способствуют ее увеличению. (Напомним, что гладкомышечные клетки интимы могут быть производными клеток-предшественников, циркулирующих в крови, и характеризуются пролиферативным и синтетическим фенотипами, что отличает эти клетки от гладкомышечных клеток подлежащей медии.) В пролиферации этих клеток и синтезе ВКМ участвуют некоторые факторы роста, включая PDGF (высвобождаемый локально прилипшими тромбоцитами, а также макрофагами, эндотелиальными и гладкомышечными клетками), фактор роста фибробластов и трансформирующий фактор роста a (TGF-a).
Мигрировавшие гладкомышечные клетки синтезируют ВКМ (в т.ч. коллаген), стабилизирующий атеросклеротические бляшки, но активированные воспалительные клетки в атеросклеротической бляшке могут вызвать апоптоз гладкомышечных клеток интимы, а также повысить катаболизм ВКМ, приводя к нестабильности бляшек.
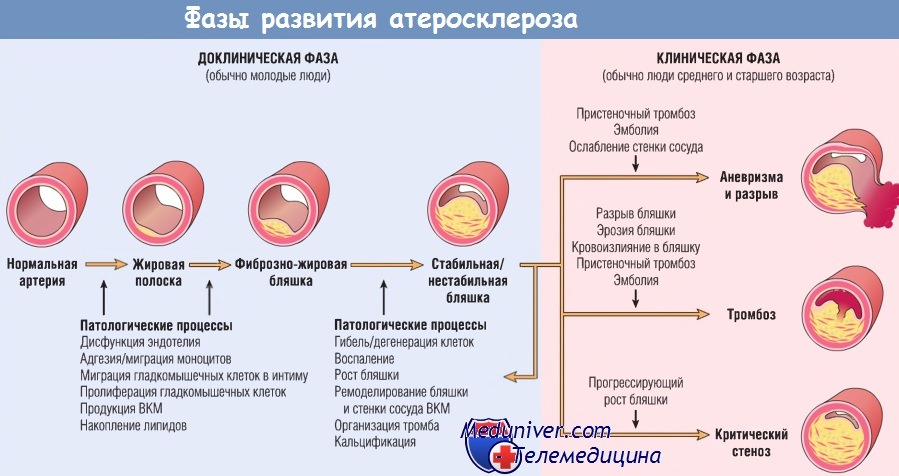
На рисунке ниже проиллюстрирована гипотеза развития атеросклероза как хронической воспалительной реакции (вместе с процессами, направленными в конечном итоге на попытку сосудистого «исцеления»), индуцированной разнообразными воздействиями, включая повреждение эндотелия, накопление и окисление липидов и тромбоз. Атеросклеротические бляшки — патологические динамические образования, состоящие из эндотелиальных клеток с нарушенной функцией, мигрировавших и пролиферирующих гладкомышечных клеток с примесью лимфоцитов и макрофагов. Все эти клетки способны секретировать медиаторы, влияющие на атерогенез.
Таким образом, бляшки в интиме на ранних стадиях развития немного больше по размеру, чем агрегаты, состоящие из гладкомышечных и макрофагальных пенистых клеток. По мере прогрессирования патологического процесса атеросклеротическая бляшка видоизменяется за счет ВКМ, синтезируемого гладкомышечными клетками. В интиме особенно хорошо выражена соединительная ткань, образующая фиброзную покрышку бляшки, при этом поражение обычно сохраняет центральное ядро из нагруженных липидами клеток и липидного детрита, который может кальцифицироваться. Со временем бляшка в интиме все больше выступает в просвет сосуда или сдавливает подлежащую медию, вызывая ее дегенерацию. Разрыв фиброзной покрышки может привести к тромбозу и острой окллюзии сосуда.
— Рекомендуем ознакомиться со следующей статьей «Морфология атеросклероза»
Оглавление темы «Атеросклероз и его последствия»:
- Причины и факторы риска атеросклероза
- Механизмы развития (патогенез) атеросклероза
- Морфология атеросклероза
- Последствия и осложнения атеросклероза
- Механизмы развития аневризмы и ее расслоения
- Механизмы развития и морфология аневризмы брюшной аорты
- Признаки аневризмы брюшной аорты
- Признаки аневризмы грудной аорты
- Механизмы развития (патогенез) расслоения аорты
- Морфология расслоения аорты



