Бронхиальная астма передозировка адреномиметика
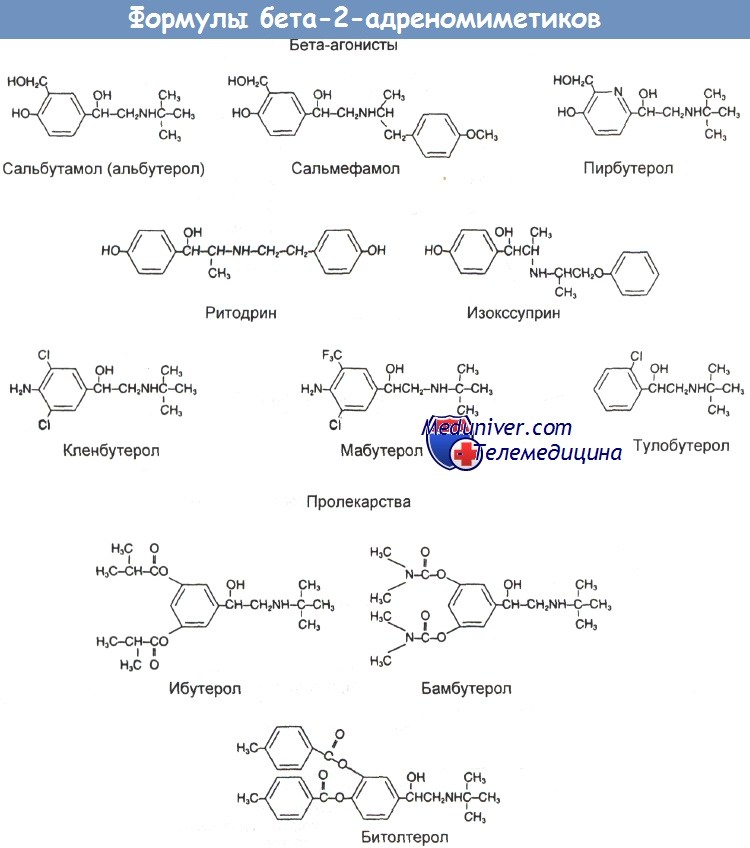
Отравление бета-2-адреномиметиками для лечения бронхиальной астмыИзопреналин (изопротеренол) был первым избирательным агонистом бета-адренергических рецепторов, полученным в 40-е годы еще до разработки в 1948 г. самой концепции альфа- и бета-подгрупп этой системы. Метапротеренол (орципреналина сульфат) появился позже в форме перорального препарата. Неудобство создавала заметная кардиостимуляция, вызываемая этими продуктами. В середине 60-х годов бета-адренергические рецепторы были разделены на b1- и b2-типы. Было обнаружено, что b1-рецепторы связаны с силой и частотой сердечных сокращений, а b2-рецепторы — с расслаблением гладкой мускулатуры бронхов и матки. Это привело к поиску более избирательных b2-агонистов, которыми оказались, в частности, изоэтарин, сальбутамол (альбутерол) и тербуталин. Некоторые из этих лекарственных средств применяются при лечении астмы (сальбутамол, тербуталин, фенотерол), а другие используются как токолитики в случае преждевременных родов (ритодрин, изокссуприн). Однако высокие дозы всех этих веществ вызывают тремор скелетной мускулатуры и кардиостимуляцию, что ограничивает их применение. Разработаны также пролекарства (ибутерол, бамбутерол, битолтерол), которые превращаются в активную форму в органах-мишенях.
а) Смертность от бета-2-адреномиметиков. Увеличение смертности от астмы в Великобритании в 60-е годы было связано с применением ингаляционных форм, высвобождающих очень мощный и относительно неселективный бета-агонист изопротеренол. Отмечена сходная корреляция числа летальных исходов с количеством ежемесячно продаваемых баллончиков или ингаляционных доз других бета-агонистов (в частности, сальбутамола). В 70-е годы увеличение смертности от астмы в Новой Зеландии шло параллельно распространению фенотерола, селективного бета-2-агониста длительного действия, никогда не допускавшегося на рынок США. Возможными факторами, способствующими таким летальным исходам, считаются регулярное (не только в случае приступа) применение лекарства, развитие гипокалиемии, бесконтрольное применение, большая сила фенотерола по сравнению с другими бета-агонистами, необычная гидробромидная форма этого средства и индуцирование парадоксального бронхоспазма продуктами, содержащимися в аэрозольном носителе, например эмульгаторами, консервантами (хлорид бензалкония, сульфиты) и даже загрязняющими примесями. Впоследствии использование фенотерола в Новой Зеландии было сильно ограничено; его назначают в Австралии в случае астмы слабой — умеренной степени тяжести. В Великобритании и США разработаны специальные инструкции по лечению этого заболевания. Предполагается, что примерно 20 астматиков погибли из-за применения сальметерола ксинафоата.
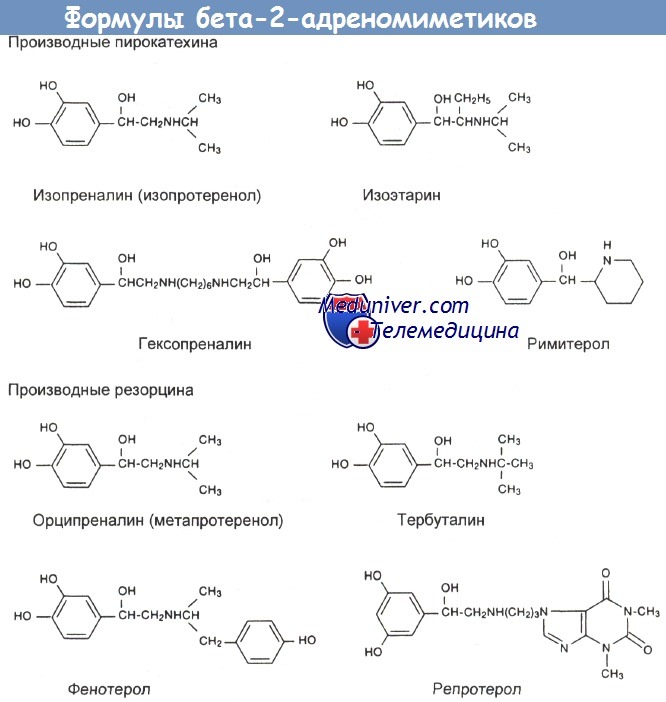
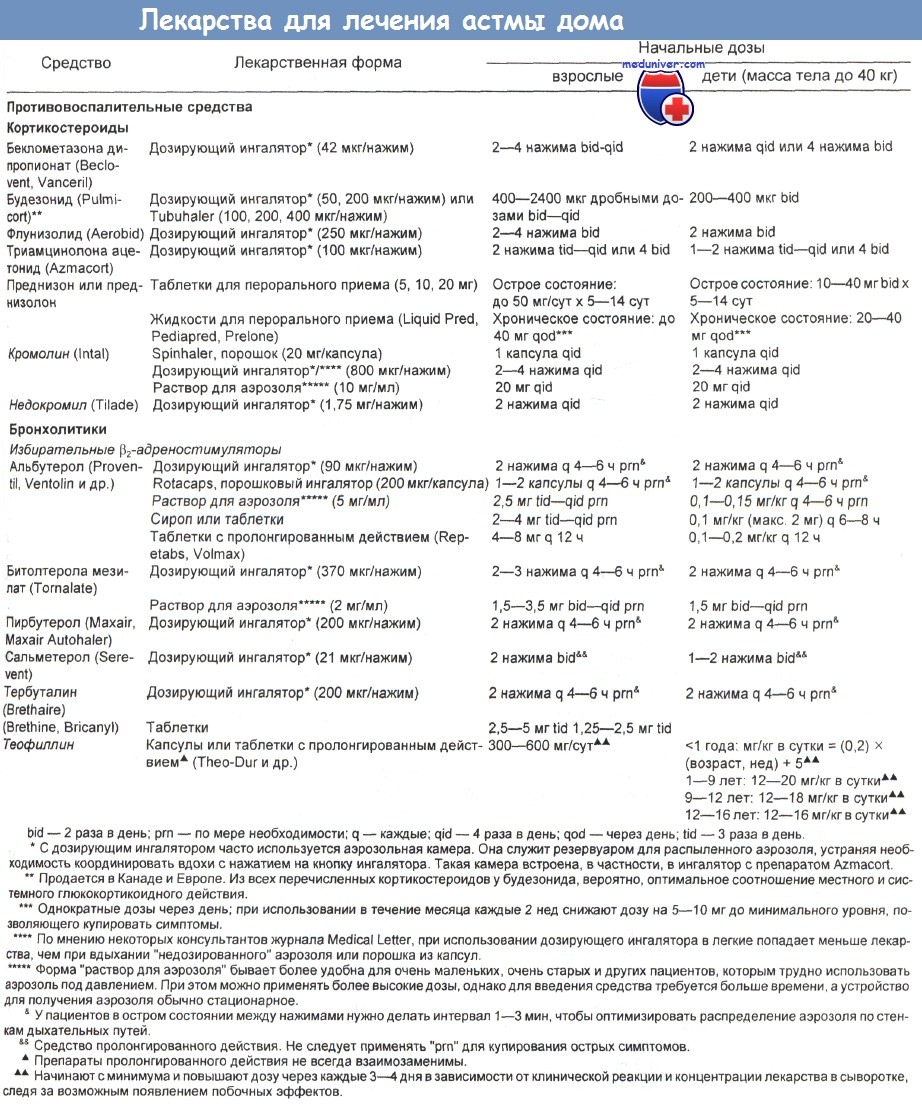
б) Структура и классификация бета-2-адреномиметиков. Агонисты b2-адренергических рецепторов представляют собой синтетические соединения, молекула которых включает пирокатехиновое кольцо или близкую к нему группу и этаноламинную боковую цепь. Пирокатехиновое кольцо определяет главным образом силу действия, а боковая цепочка — избирательность. У самых сильных лекарств (например, тербуталина, фенотерола, сальбутамола) с бензольным кольцом соединены 2 гидроксильные группы. N-алкильное замещение в боковой цепи понижает общую бета-андренергическую активность и усиливает бета-2-избирательность. в) Применение. С медицинской точки зрения большинство b2-агонистов наиболее эффективно в качестве бронхолитиков при лечении бронхиальной астмы, хронического бронхита и бронхоспастических состояний. Многие b2-агонисты используются также для купирования сокращений матки при преждевременных родах. г) Лекарственные формы. В таблицах ниже приведены бета-2-агонисты, доступные в США и Великобритании. Некоторые другие, близкие к ним лекарственные средства перечислены в отдельной таблице также ниже. д) Терапевтическая доза бета-2-адреномиметиков. Лекарственные формы и начальные дозы некоторых бета-2-агонистов приведены в таблице ниже. Такие средства, как сальбутамол (альбутерол) в дозе 100—200 мкг и тербуталин (250—500 мкг), применяются не регулярно, а по мере необходимости. При астме предпочтительный путь введения — ингаляция. Лекарство поступает непосредственно в дыхательные пути, дозы низкие, а побочные эффекты сведены к минимуму. У пациентов с нормальной легочной функцией и нечастыми приступами такого лечения бывает достаточно. При острой тяжелой астме тоже можно применять ингаляции бета-2-агониста (2,5— 5 мг сальбутамола или 5—10 мг тербуталина). Для его распыления используют сжатый кислород (в больнице или при перевозке в машине «Скорой помощи») или, если этот метод недоступен, многократно распыляют аэрозоль из дозирующих ингаляторов в более крупную емкость (2 дозы по 5 мг, т. е. 20—50 нажатий, по 5 нажатий одновременно), а оттуда дают больному. Бета-2-агонисты являются только одной из составных частей общей схемы лечения (кислородотерапия, стероиды, внутривенное введение бронхолитиков).
е) Токсичная доза бета-2-адреномиметиков: — Сальбутамол (альбутерол). Взрослые. Женщина в возрасте 44 лет, принявшая внутрь 100 таблеток сальбутамола по 2 мг (терапевтическая доза 2—4 мг 3—4 раза в сутки), была госпитализирована с симптомами передозировки бета-2-стимуляторов (тахикардия, электрическая нестабильность скелетных мышц, возбуждение) и выжила. У женщины в возрасте 76 лет, принявшей перорально 40 таблеток сальбутамола по 4 мг, появились сходные симптомы в сочетании с гипокалиемиеи, которые исчезли после проведенной поддерживающей терапии. У женщины в возрасте 17 лет развились симптомы передозировки после перорального приема неустановленного количества таблеток сальбутамола по 2 мг. Она выздоровела при поддерживающей терапии. Мужчина в возрасте 26 лет после приема внутрь одновременно сальбутамола и теофиллина страдал от эпилептических припадков и таблеточных безоаров в желудке; спасти его не удалось. Женщине, больной астмой, в возрасте 35 лет по ошибке внутривенно ввели 10 мг сальбутамола; у нее появились прошедшие через день симптомы передозировки; 5 взрослых пациентов с пероральной передозировкой сальбутамола выздоровели без осложнений. Дети. В одном обзоре описаны 40 пациентов, принявших внутрь от 5 до 100 мг (возраст младше 10 лет) и от 14 до 240 мг (возраст старше 10 лет) сальбутамола. Все выздоровели без осложнений. Сто двадцать детей в возрасте младше 12 лет после перорального приема до 96 мг альбутерола (сальбутамола) наблюдались либо на дому (дозы ниже 0,6 мг/кг), либо в медучреждениях (0,3—6,3 мг/кг); все выздоровели при минимальном лечении. У астматика в возрасте 14 лет, принявшего внутрь 40 мг альбутерола, был такой же исход: он тоже выздоровел. Ребенок в возрасте 22 мес принял перорально около 30 мг альбутерола (до 3 мг/кг); у него появились тремор, гипогликемия и слабая гипокалиемия. Он выздоровел, получив только поддерживающее лечение. — Тербуталин. Женщина в возрасте 67 лет с бронхоспазмом и уровнем теофиллина в крови 7 мкг/мл через 18 ч после его измерения получила 2,5 мг тербуталина подкожно вместо рекомендованной дозы 0,25 мг. У нее развились усиленное сердцебиение, боль в груди, тремор, тахикардия и гипертензия с электрокардиографическими изменениями, указывающими на ишемию миокарда. Тремор постепенно прошел за следующие 24 ч. Мужчина в возрасте 77 лет принял внутрь 20 таблеток тербуталина по 2,5 мг и 9 таблеток флуразепама по 15 мг. После этого в течение 24 ч у него наблюдались тремор и тахикардия. Женщина в возрасте 35 лет с диабетом и подозрением на преждевременные роды получила по ошибке подкожную дозу 2,5 мг тербуталина вместо положенных 0,25 мг. За этим последовали боль в груди, тахикардия и электрокардиографические изменения, характерные для ишемии миокарда; состояние нормализовалось через 2 сут. Тербуталин с успехом применялся для профилактики преждевременной родовой деятельности, приводящей к выкидышу. У двух других беременных пациенток, получивших по ошибке дозы, в 10 раз превышающие обычную (2,5 вместо 0,25 мг), наблюдались сходные симптомы (тахикардия, повышение пульсового давления); у одной из них плод выжил. Ребенок в возрасте 3 лет проглотил 45 мг тербуталина; у него развились тахикардия, тремор, тошнота и рвота. После лечения бета-блокаторами он выздоровел. Больная астмой в возрасте 22 лет 2 раза принимала перорально по 100 таблеток тербуталина (5 мг). У нее развивалась характерная картина отравления бета-2-агонистами. После промывания желудка, введения активированного угля и поддерживающей терапии она выздоравливала. Женщина в возрасте 22 лет проглотила 30 таблеток тербуталина пролонгированного действия по 7,5 мг. У нее развились бронхоспазм, тахикардия, тремор, гипотензия, острый некроз скелетных мышц и острая почечная недостаточность, но она выздоровела.
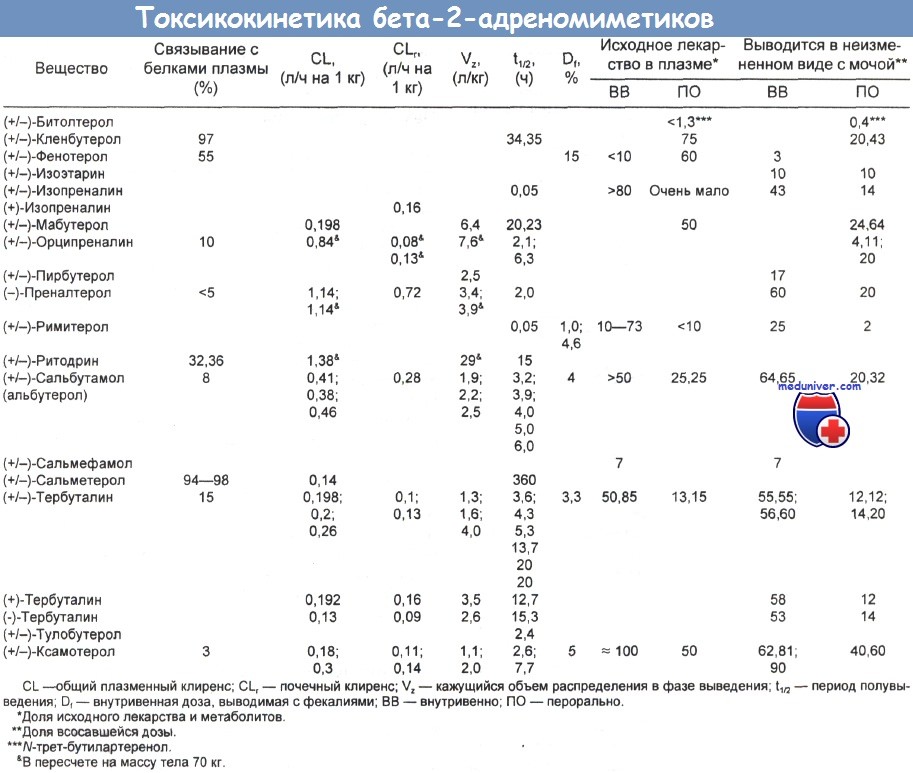
ж) Токсикокинетика бета-2-адреномиметиков. Бета-агонисты применяются перорально, путем ингаляции, а также подкожных, внутримышечных и внутривенных инъекций. Их биодоступность зависит от способа введения. — Всасывание бета-2-адреномиметиков: Пероральное введение. После перорального приема большинство b2-агонистов (сальбутамол, битолтерол) хорошо всасывается. Исключение составляют ксамотерол, римитерол, орципреналин и тербуталин. Несмотря на интенсивное всасывание, системная биодоступность бета-агонистов при пероральном приеме очень низка из-за их активного сульфатирования в печени и, возможно, в стенке тонкого кишечника. В результате пероральная доза бета-агонистов должна быть в 5—10 раз выше парентеральной. Введение в легкие. Для облегчения бронхоспазма бета-2-агонисты можно вводить непосредственно в легкие путем ингаляции с помощью дозирующего ингалятора (т. е. из баллончика под давлением) или в виде аэрозоля, образуемого специальным распылителем. После аэрозольного введения доля полученной дозы (исходное вещество и его метаболиты), обнаруживаемая в моче, составляет у сальбутамола и сальмефамола до 80 %, для изопреналина — 69 %, для тербуталина — около 50 %, а для фенотерола — 12 %. Большая часть ингаляционного аэрозоля оседает в глотке и затем проглатывается. При таком способе введения метаболизации лекарства по типу эффекта первого прохождения не происходит. После ингаляции максимальный уровень вещества в плазме достигается примерно через 2—4 ч, что сравнимо с данными по пероральному приему и согласуется с тем, что большая часть аэрозоля просто проглатывается. Максимальный бронхолитический эффект наступает через 15—30 мин. При непосредственной инстилляции в бронхи пик плазменной концентрации отмечается примерно через 10 мин. В легкие попадает около 3 % дозы, вводимой путем пероральной ингаляции из баллончика. При использовании стационарного аэрозольного распылителя там всасывается примерно 10—20 % дозы, т. е. проглатывается гораздо меньшая часть последней. Подкожное и внутримышечное введение. После подкожного введения пик плазменной концентрации тербуталина достигается быстрее (через 15—30 мин), чем после перорального, а его системная биодоступность приближается к 100 %. Максимальный плазменный уровень ритодрина также достигается уже через 15 мин. — Распределение. Примерно 10 % большинства бета-агонистов связывается с белками плазмы. Тканевое распределение этих лекарственных средств велико (от 1 до 29 л/кг). — Выведение. Системный клиренс бета-агонистов варьирует от низкого (у тербуталина, мабутерола) до относительно высокого (например, у преналтерола, ритодрина). Выводятся они из организма путем метаболизации и выделения исходного вещества почками. Производные резорцина (тербуталин, сальбутамол, фенотерол, ксамотерол, преналтерол, пирбутерол, орципреналин) метаболизируются путем конъюгации с сульфатом, в результате которой образуется единственный биохимически значимый метаболит. Ритодрин метаболизируется до глюкуронида. Ни сульфатные, ни глюкоронидные конъюгаты бета-агонистов, по-видимому, не обладают фармакологической активностью. После непосредственного интрабронхиального введения человеку лекарства, служащие субстратом для пирокатехин-о-метилтрансферазы, могут подвергаться легочному эффекту первого прохождения. Основной путь выведения парентерально вводимых бета-агонистов — почечная экскреция.
з) Взаимодействие лекарственных средств бета-2-адреномиметиками. Прием диуретиков усиливает гипокалиемию, индуцируемую бета-2-агонистами. Пероральные ингаляции этими средствами одновременно с приемом внутрь других симпатомиметиков приводят к аддитивному симпатомиметическому эффекту. Введение бета-агонистов любым другим способом (например, внутривенно, перорально, подкожно) вместе с теофиллином чревато поражением сердечно-сосудистой системы. Назначать бета-2-агонисты надо осторожнее, если больной уже получает ингибиторы моноаминоксидазы или трициклические антидепрессанты, поскольку они могут потенцировать действие бронхолитиков на сосуды. и) Беременность и бета-2-адремиметики. По-видимому, беременность не оказывает существенного влияния на токсикокинетику бета-2-агонистов. Однако во время нее наблюдалось повышение системного клиренса тербуталина на 30 % с соответствующим понижением системной биодоступности этого средства при пероральном применении. Schatz и соавт. считают, что любой из ингаляционных бронхолитических бета-агонистов можно применять для лечения астмы в период беременности. Женщине с подозрением на преждевременные роды на 21-й неделе беременности по ошибке ввели подкожно 2,5 мг тербуталина (рекомендуемая начальная пероральная доза) вместо 0,25 мг. У нее развились стеснение в груди, тахикардия и электрокардиографические признаки нижнелатеральной ишемии. За двое суток ЭКГ вернулась к норме. Впоследствии у нее произошел выкидыш. Описана смерть женщины с 25-недельной беременностью от сердечной аритмии после подкожного введения ей тербуталина. — Проникновение через плаценту. Когда бета-2-агонисты используются для предупреждения преждевременных родов, наблюдается тахикардия плода с гипергликемией, гипотензией и респираторным дистресс-синдромом у младенцев, появляющихся на свет после неудачной токолитической терапии. Трансплацентарный перенос этих лекарств происходит быстро. FDA отнесло альбутерол к категории С средств для беременных. — Лактация. После перорального приема матерью тербуталина его концентрация в молоке бывает такой же, что и в плазме, или даже выше. Расчетное потребление тербуталина с грудным молоком составляет 0,4—0,7 мкг/кг в сутки — менее 1 % взрослой дозы. У грудных младенцев не отмечается клинических признаков бета-адренергической стимуляции. О других бета-агонистах такого рода данных мало. — Перинатальные эффекты. У больных астмой женщин, принимающих во время беременности бета-2-агонисты, процент перинатальной смертности, врожденных мальформаций у детей, преждевременных родов, рождений детей с низкой массой тела и средняя масса тела младенцев при рождении не превышают нормы. Не наблюдается также отклонений в баллах по шкале Апгар, частоте осложнений при родах и послеродовых кровотечений.
к) Механизм действия бета-2-адреномиметиков. Агонисты бета-2-адренергических рецепторов действуют как на гладкую, так и на скелетную мускулатуру. К их эффектам относятся расширение бронхов, расслабление мышц матки и некоторое расширение периферических кровеносных сосудов (резкое падение диастолического давления), приводящие к приливам и тремору, возможно, из-за повышения сократимости скелетных мышц в результате бета-2-стимуляции. Расслабление гладкой мускулатуры, вероятно, происходит вследствие связывания лекарства с бета-адренергическими рецепторами в клеточной мембране, приводящего к превращению АТФ в цАМФ; это активирует протеинкиназу, а она фосфорилирует белки, усиливающие связывание кальция внутри клетки. Снижение внутриклеточной доступности его ионов ингибирует образование актин-миозиновых связей, что приводит к расслаблению гладких мышц. Бета-2-агонисты оказывают также антиаллергическое действие на тучные клетки, блокируя высвобождение ими медиаторов бронхостеноза, включая гистамин, фактор хемотаксиса нейтрофилов и простагландин D2. Система цАМФ, вероятно, действует как второй посредник регуляции ответа тучных клеток. Бета-2-адренергическая стимуляция также приводит к поступлению калия из сыворотки в клетки, возможно, благодаря активации Nа+/К+-АТФазы; это чревато временным понижением как повышенной, так и нормальной концентрации в ней калия. Гипокалиемическое действие оказывают и внутривенные, и ингалируемые формы бета-2-агонистов. Стимуляция внелегочных бета-2-рецепторов может привести к увеличению частоты сердечных сокращений, удлинению интервала Q—Tc, неспецифическим изменениям зубца Т, тремору скелетных мышц (в них тоже находятся бета-2-рецепторы) и небольшому повышению уровней в крови глюкозы и неэтерифицированных жирных кислот. Высокие концентрации некоторых избирательных бета-2-агонистов, например тербуталина, способны стимулировать и бета-1-рецепторы.
— Также рекомендуем «Клиника отравления бета-2-адреномиметиками для лечения бронхиальной астмы» Оглавление темы «Отравление лекарствами для лечения болезней легких»:
|
Источник

Исходя из патогенеза бронхиальной астмы, в борьбе с астматическими проявлениями применяют бронхорасширяющие средства и противовоспалительные препараты.
Адреномиметики при бронхиальной астме быстро снимают симптомы удушья. Следует помнить, что все бронхолитики обладают симптоматическим действием.
То, насколько часто они используются, будет индикатором эффективности основной, базисной терапии.
Механизм действия адреномиметиков
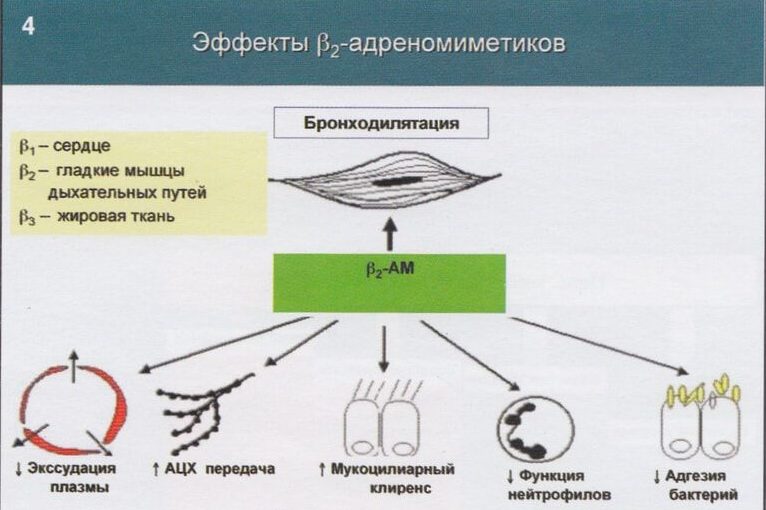
Итак, адреномиметики — обширная группа лекарственных средств, оказывающих стимулирующее воздействие на адренорецепторы. Адренорецепторы локализуются во всех тканях организма — они встроены в клеточные мембраны, представляют собой особые белковые молекулы.
Эффект адреномиметиков определяется воздействием на рецепторы, что приводит к определенным метаболическим изменениям. В итоге может возникать спазм или расширение сосудов и т. д.
Адреномиметики оказывают стимулирующее воздействие на адренорецепторы, подобное действию адреналина и норадреналина. Когда молекула агониста соединяется с рецептором на поверхности клетки, происходит взаимодействие с регуляторным белком.
Этот белок способствует активации особого фермента, стимулирующего синтез аденозинмонофосфата — вещества, участвующего в передаче сигналов в клетке. Вследствие этого в клетке происходят определенные химические процессы, в результате которых изменяется концентрация кальция.
На этот процесс реагирует гладкая мускулатура различных органов, расслабляясь или сокращаясь.
Эффект воздействия
Эффект действия препаратов зависит от типа рецепторов, на которые осуществляется воздействие.
Хотя адренорецепторы бывают 5 типов, мы остановимся только на бета1- и бета2-адренорецепторах, раз речь идет об астме.
Итак, бета1-адренорецепторы локализованы в сердце, и их стимулирование приводит к увеличению ЧСС, повышению артериального давления. Также они находятся в почках.
Бета-2-адренорецепторы локализуются в бронхах, скелетной мускулатуре, сосудах, сердце и других органах. Эффектом их стимуляции будет расслабление гладкой мускулатуры бронхов, снятие спазма, расширение просвета бронхиального дерева.
При астме адреномиметики оказывают симптоматический эффект и используются для купирования и предотвращения приступов.
Классификация адреномиметиков

Адреномиметики, применяемые при бронхиальной астме, разделяются на селективные и неселективные. Первые характеризуются тем, что воздействуют только на бета2-рецепторы, а вторые и на бета1, и на бета2.
При бронхиальной астме бета-агонисты должны воздействовать именно на бронхиальные бета2-рецепторы. Бета2-адреномиметики бывают длительного и короткого действия. Первые обладают пролонгированным эффектом и помогают предупредить ночные приступы, а вторые применяют в качестве средств против обострения астмы.
Следует обратить внимание на то, что адреномиметики, будь то селективные или неселективные, используют только по назначению врача. Если речь идет о адреномиметиках короткого действия, то это экстренные средства, которые ни в коем случае не следует применять бесконтрольно.
Они дают хороший терапевтический эффект, однако могут вызывать побочные явления – аритмию, гипертонический криз или гипотонию и многое другое. Пациентам с сахарным диабетом, артериальной гипертензией, атеросклерозом сосудов головного мозга, заболеваниями щитовидной железы применять такие средства рекомендуется с осторожностью, в той дозе и с той частотой, которую определил врач.
Селективные адреномиметики при бронхиальной астме
Бета-адреномиметики при бронхиальной астме используются как селективные, так и неселективные. Назначаются селективные адреномиметики короткого действия в форме аэрозоля, что позволяет быстро снять симптомы бронхиальной астмы.
Если ребенок не может в силу возраста использовать ингалятор, применяют специальные приборы для распыления лекарственного раствора — небулайзеры. Дозы препаратов для ингаляции при помощи небулайзера выше.
В больших дозах могут активировать бета1-адренорецепторы, альфа-адренорецепторы в сосудах. Неселективные возбуждают эти рецепторы в любых дозах. С этим связаны побочные эффекты — повышение артериального давления, увеличение ЧСС.
Некоторые селективные антагонисты бета-адренорецепторов:

Длительного действия

Как было отмечено выше, бета-адренометики при бронхиальной астме применяют в комбинации с глюкокортикоидами и другими средствами. К средствам длительного действия относят, например, формотерол.

Длительный эффект связан с накоплением вещества в мембранах гладкомышечных клеток. При комбинации с глюкокортикоидами усиливают эффект гормонов, позволяют снизить их дозировку и, соответственно, уменьшить побочные эффекты при использовании для предотвращения ночных приступов, а также проявлений астмы физического напряжения.
Эти препараты не могут использоваться для монотерапии и в качестве экстренных средств для купирования удушья. Также следует избегать резкой отмены таких препаратов.
Короткого действия

При применении оптимальных доз адреномиметиков короткого действия бета1-адренорецепторы миокарда практически не стимулируются.
В эту группу входят следующие препараты:

При приступе удушья адреномиметики короткого действия быстро купируют обострение — при ингаляционном введении эффект наблюдается уже спустя четыре минуты и длится на протяжении нескольких часов. Также они применяются для предупреждения проявлений астмы физического усилия.
Препараты этой группы не подходят для профилактического лечения — это средства экстренной помощи, которые действуют непродолжительное время. При частом использовании их эффективность может уменьшиться. Регулярное применение сальбутамола приводит к учащению приступов астмы физического усилия и увеличивает выраженность воспаления.
Для правильного введения лекарства при помощи ингалятора необходимы соответствующие навыки. В противном случае в бронхиальное дерево попадет меньше лекарства, чем требуется.
Неселективные адреномиметики при бронхиальной астме
Стимулируют бета1-, бета2-, альфа-адренергические рецепторы. При бронхиальной астме применяют следующие неселективные адреномиметики:

Как было отмечено выше, неселективные адреномиметики оказывают активное воздействие на сердечно-сосудистую систему даже в небольших дозах, провоцируют повышение артериального давления.
Важно, что для поддержания нормального качества жизни оптимален ступенчатый подход к использованию препаратов, который предполагает повышение доз и увеличение количества приемов по мере усугубления заболевания. Главная цель — контролировать астму, принимая минимальные дозы лекарств.
Если состояние пациента ухудшается, доза и частота приема увеличивается. Если астма хорошо поддается контролю, то доза и частота приема уменьшается. Чтобы перейти с одной ступени на другую, необходимо хорошо контролировать заболевание в течение определенного времени.
Цель лечения — поддерживать нормальное качество жизни, сохранять привычную физическую активность.
В заключение
Прогноз бронхиальной астмы во многом зависит от того, выполняет ли пациент все предписания, которые касаются как схемы приема препаратов, так и общих правил, знания различий между препаратами базисной и неотложной терапии, профилактических мер.
Даже в период ремиссии в дыхательных путях сохраняется воспалительный процесс, но это не означает, что достичь хорошего самочувствия невозможно. Не стоит надеяться лишь на лекарственные средства: необходимо исключать контакты с аллергенами, соблюдать элиминационные диеты и в целом бережно относиться к своему здоровью.
Источник