Бронхиальная астма и ожирение
БРОНХИАЛЬНАЯ АСТМА И ОЖИРЕНИЕ: КЛИНИКО-ПАТОГЕНЕТИЧЕСКИЕ АСПЕКТЫ ВЫДЕЛЕНИЯ НОВОГО ФЕНОТИПА ЗАБОЛЕВАНИЯ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Игнатова Г.Л.
1
Макарова Е.А.
1
1 ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Заболеваемость бронхиальной астмой и ожирением в развитых странах неуклонно растет. В связи с этим в дополнение к изученным фенотипам астмы в последнее время выделяется особый тип – астма на фоне ожирения, клинико-патогенетические особенности которого пока четко не описаны и требуют уточнения. Проведен анализ современных литературных источников за последние пять лет с использованием общедоступной базы Pubmed. Рассмотрена роль в развитии бронхиальной астмы таких факторов, как системного воспаления на фоне ожирения, роль таких медиаторов, как лептина и адипонектина. Описаны половые различия в патогенезе, специфические черты местного иммунитета (макрофагального и нейтрофильного звеньев). Вместе с тем вопрос о выделении нового фенотипа остается открытым, и до конца не представляется возможным установить причинно-следственную связь, является развитие астмы следствием ожирения, или данные патологии сосуществуют и взаимно друг друга отягощают.
бронхиальная астма
ожирение
лептин
адипонектин
воспаление
1. Bastard J., Maachi M., Lagathu C., Kim M. Recent advances in the relationship between obesity, inflammation and insulin resistance // Eur Cytokine Netw. Mar 2006. Vol. 17(1). pp. 4-12.
2. Beuther D., Sutherland E. Overweight, obesity, and incident asthma: a meta-analysis of prospective epidemilogic studies // Am J RespirCrit Care Med. Apr 2007. Vol. 175 (7). pp. 661-666.
3. Boulet L. Asthma and obesity // ClinExp Allergy. Jan 2013. Vol. 43 (1). pp. 8-21.
4. Camargo C., Weiss S., Zhang S., Willett W., Speizer F. Prospective study of body mass index, weight changew and risk of adult-onset asthma in women // Arch Intern Med. 1999. Vol. 159 (21). pp. 2582-2588.
5. da Silva P., de Mello M., Cheik N., Sanches P. Reduction in the leptin concentration as a predictor of improvement in lung function in obese adolescents // Obesity Facts. 2012. No. 5. pp. 806-820.
6. de Lima Azambuja R., da Costa Santos Azambuja L., Costa S., Rufino R. Adiponectin in asthma and obesity: protective agent or risk factor for more severe disease? // Lung. Oct 2015. Vol. 193(5). pp. 749-755.
7. Delgado J., Quirce S., Barranco P. Obesity and asthma // J Investig AllergolClinImmunol. 2008. Vol. 18. No. 6. pp. 420-425.
8. Friedenberg F., Xanthopoulos M., Foster G., Richter J. The association between gastroesophageal reflux disease and obesity // Am J Gastroenterol. Aug 2008. Vol. 103(8). pp. 2111-2122.
9. Kato H., Ueki S., Kamada R., Kihara J., Yamauchi Y. Leptin has a priming effect on eotaxin-induced human eosinophil chemotaxis // Int Arch Allergy Immunol. 2011. Vol. 155(4). pp. 335-344.
10. Kilic H., Oguzulgen I., Bakir F., Turktas H. Asthma in obese women: outcomes and factors involved // J Investig AllergolClinImmunol. 2011. Vol. 21(4). pp. 290-296.
11. Kim S., Kim T., Lee J., Koo T. Adiposity, adipokines and exhaled nitric oxide in healthy adults without asthma // J Asthma. Mar 2011. Vol. 48(2). pp. 177-182.
12. Kim S.H., Sutherland E., Gelfand E. Is there a link between obesity and asthma? // Allergy Asthma Immunol Res. May 2014. Vol. 6(3). pp. 189-195.
13. Lugogo N., Kraft M., Dixon A. Does obesity produce a distinct asthma phenotype? // J Appl Physiol. 2010. Vol. 108. pp. 729-734.
14. Maltz L., Matz E., Gordish-Dressman H., Pillai D., Teach S. Sex differences in the association between neck circumference and asthma // Pediatr Pulmonol. Jan 2016. pp. doi:10.1002/ppul.23381 [Epub ahead of print].
15. Pakhale S., Baron J., Dent R., Vandemheen K., Aaron S. Effects of weight loss on airway responsiveness in obese adults with asthma: does weight loss lead to reversibility of asthma? // Chest. Jun 2015. Vol. 147(6). pp. 1582-1590.
16. Qiao Y., Xiao Y. Asthma and obstructive sleep apnea // Chin Med J (Engl). Oct 2015. Vol. 128(20). pp. 2789-2804.
17. Scott H., Gibson P., Garg M., Upham J., Wood L. Sex hormones and systemic inflammation are modulators of the obese-asthma phenotype // Allergy. Jul 2016. Vol. 71(7). pp. 1037-1047.
18. Sideleva O., Suratt B., Black K., Tharp W., Pratley R., Forgione P. Obesity and asthma: an inflammatory disease of adipose tissue not the airway // Am J RespirCrit Care Med. Oct 2012. Vol. 186(7). pp. 598-605.
19. Sood A., Dawson B., Eid W., Eagleton L., Henkle J. Obesity is associated with bronchial hyper-responsiveness in women // J Asthma. Dec 2005. Vol. 42 (10). pp. 847-852.
20. Sood A., Dominic E., Qualls C., Steffes M., Thyagarajan B. Serum adiponectin is associated with adverse outcomes of asthma in men but not in women // Front Pharmacol. Oct 2011. pp. 2:55.
21. Sood A., Seagrave J., Herbert G., Harkins M., Alam Y. High sputum total adiponectin is associated with low odds for asthma // J Asthma. Jun 2014. Vol. 51(5). pp. 459-466.
22. Stein M. Possible mechanisms of influence of esophageal acid on airway hyperresponsiveness // Am J Med. Aug 2003. No. 115 Suppl 3A. pp. 55S-59S.
23. Stenius-Aarniala B., Poussa T., Kvarnström J., Grönlund E., Ylikahri M., Mustajoki P. Immediate and long term effects of weight reduction in obese people with asthma: randomised controlled study // BMJ. Mar 2000. Vol. 320 (7238). pp. 827-832.
24. Suzukawa M., Koketsu R., Baba S., Igarashi S., Nagase H. Leptin enchances ICAM-1 expression, induces migration and cytokine synthesis, and prolongs survival of human airway epithelial cells // Am J Physiol — Lung Cell Mol Physiol. October 2015. Vol. 30. No. 8. pp. L801-L811.
25. Taleb S., Herbin O., Ait-Oufella H., Verreth W., Gourdy P. Defective leptin/leptin receptor signaling improves regulatory T cell immune response and protects mice from atherosclerosis // ArteriosclerThrombVasc Biol. Dec 2007. Vol. 27(12). pp. 2691-2698.
26. Telenga E., Tideman S., Kerstjens H., Hacken N., Timens W. Obesity in asthma: more neutrophilic inflammation as a possible explanation for a reduced treatment response // Allergy. Aug 2012. Vol. 67(8). pp. 1060-1068.
27. Tsaroucha A., Daniil Z., Malli F., Georgoulias P., Minas M. Leptin, adiponectin and ghrelin levels in female patients with asthma during stable and exacerbation periods // J Asthma. Mar 2013. Vol. 50 (2). pp. 188-197.
28. Verbout N., Benedito L., Williams A., Kasahara D., Wurmbrand AP. Impact of adiponectin overexpression on allergic airways responses in mice // J Allergy (Cairo). 2013:349520 2013.
29. Yamamoto R., Ueki S., Moritoki Y., Kobayashi Y., Oyamada H. Adiponectin attenuates human eosinophil adhesion and chemotaxis: implication in allergic inflammation // J Asthma. Oct 2013. Vol. 50(8). pp. 828-835.
Бронхиальная астма – широко распространенное в Российской Федерации и практически во всех развитых странах мира хроническое гетерогенное воспалительное заболевание дыхательных путей, одной из главных характеристик которого является вариабельность течения и мозаичность клинической картины. В последние годы клиницистами осуществляется кластеризация симптомов заболевания, ведущая к выделению так называемых «фенотипов бронхиальной астмы» – вариантов течения заболевания, объединенных некоторыми демографическими, клиническими и/или патофизиологическими характеристиками. Особый интерес представляет специфика течения бронхиальной астмы у пациентов с ожирением, ввиду растущей распространенности последнего, что многими авторами расценивается как «эпидемия ожирения». Так, до 65 % взрослого населения США имеет ожирение или избыточную массу тела, среди жителей Испании 39 % имеют избыточную массу тела, 15 % страдают ожирением [7]. Распространенность астмы за последние десятилетия также прогрессивно растет. По данным Центра контроля и предотвращения заболеваний США (CDC), встречаемость астмы среди детей выросла с 3,6 % в 1980 году до 5,8 % в 2003 году.
Взаимосвязь между ожирением (избыточной массой тела) и бронхиальной астмой упоминается исследователями достаточно давно. Лечение астмы на фоне ожирения существенно сложнее и менее эффективно, чем у пациентов с нормальной массой тела. До сих пор остается неясным, почему на фоне ожирения снижен эффект ингаляционных глюкокортикостероидов и бронходилататоров [3]. Достаточно много исследований посвящено эпидемиологии астмы на фоне ожирения. В частности, по данным мета-анализа Beutherи Sutherland (2007), проведенного на основе семи крупных исследований с общим числом наблюдений 333 102, было показано, что повышенный ИМТ (свыше 25,0) сопровождается пропорциональным ростом риска развития астмы. Отношение шансов для субъектов с избыточной массой тела, по их данным составляло 1,38, а при наличии ожирения – 1,92. Авторы охарактеризовали взаимосвязь между избыточной массой тела и риском развития астмы как «дозозависимую» [2]. С другой стороны, заслуживают внимания также исследования, где анализировалась взаимосвязь между изменением массы тела (как в сторону увеличения, так и снижения) и риском развития астмы. Так, для лиц, масса тела которых увеличилась на 25 и более килограммов по сравнению с массой в 18-летнем возрасте, относительный риск заболевания астмой составляет 4,7 по сравнению с контрольной группой лиц со стабильной массой [4]. Справедливо и утверждение о наличии обратной взаимосвязи: снижение массы тела в течение 1 года на 15 % достоверно улучшает показатели FEV1 на 7,6 %, приводит к снижению в препаратах для купирования симптомов в среднем на 1 дозу в сутки и в целом улучшает показатели здоровья, определяемые на основании опросников [23]. Аналогичные результаты показали Pakhale, Baronetal.(2015) в эксперименте по снижению веса в группе пациенток со средним изначальным ИМТ 45,7 кг/м2: при среднем снижении массы тела на 16,5 кг было достигнуто достоверное улучшение показателей FEV1, FVC, качества жизни и контроля над астмой, а также результатов провокационного теста с метахолином [15]. Интересно, что в качестве дополнительного к ИМТ показателю некоторые авторы предлагают рассматривать окружность шеи, по крайней мере, в педиатрической практике. Так, Maltzetal. (2016) обнаружили, что у подростков большая окружность шеи ассоциируется с достоверно худшими показателями контроля над астмой и низким качеством жизни. Вопрос об экстраполяции данного наблюдения на взрослую популяцию может также иметь клиническую значимость [14]. В целом, несмотря на достаточно большой интерес исследователей, остается открытым вопрос – является ли астма при ожирении самостоятельным фенотипом [13]? Также исследователями рассматривается и обратное утверждение: связано ли развитие астмы с каким-либо конкретным типом ожирения. В данном контексте заслуживает внимание наблюдение Sood, Dawson, Eidetal. (2005), показавших наличие гиперреактивности бронхов у женщин с избыточной массой тела, и отсутствие такой взаимосвязи у мужчин [19].
Механизм взаимосвязи между ожирением и астмой принципиально остается неясным, несмотря на большое количество предложенных вероятных патогенетических механизмов, включая механические, иммунологические, генетические и гормональные концепции. В настоящее время наибольший вес приобрела иммунологическая теория взаимосвязи, которая базируется на признании ключевой роли провоспалительных (в частности, лептина) и противовоспалительных адипокинов (адипонектина). Например, Sideleva, Suratt, Blacketal. (2012) выдвинули гипотезу, согласно которой астма является воспалительным заболеванием не столько воздухоносных путей, сколько жировой ткани [18].
Известно, что концентрация лептина в сыворотке крови повышается при ожирении. Рецепторы к лептину обнаруживаются в легочной ткани. Показано, что лептин обладает системным провоспалительным эффектом, который может играть роль в патогенезе астмы: он стимулирует выработку ТНФ-альфа и ИЛ-6 жировой тканью [1], отрицательно модулирует функцию регуляторных Т-лимфоцитов и стимулирует пролиферацию Т1-хелперов, выработку гамма-интерферона [25]. В условиях invitro лептин способен модулировать функциональное состояние эпителиальных клеток воздушных путей, а именно: индуцировать синтез ИЛ-6, VEGF, G-CSF, увеличивать экспрессию молекулы ICAM-1 на их поверхности, одновременно стимулируя миграцию клеток, пролиферацию и блокируя апоптоз [24], стимулирует миграцию эозинофилов и их ответ на эотаксин [9].
Интерес к исследованию роли лептина в патогенезе астмы при ожирении возник в середине 2000-х годов и к настоящему моменту только возрастает. По данным Tsaroucha, Daniil, Malli (2013), уровень сывороточного лептина положительно коррелирует с характеристикой степени тяжести астмы, а также обратно взаимосвязан с показателями FEV1/FVCи FEV (25-75). Также уровень лептина выше у пациентов с атопической астмой и дополнительно повышается в период обострений [27]. При ожирении уровень лептина положительно коррелирует с уровнем оксида азота (II) в выдыхаемом воздухе, а у пациентов с атопией – положительно коррелирует с уровнем IgE [10]. Снижение уровня лептина у пациентов с ожирением и астмой является предиктором улучшения показателей ФВД, таких как FVC, FEV1, PEF [5]. Однако в целом, объем популяционных исследований по взаимосвязи концентрации лептина и риска развития астмы явно недостаточен и не формирует целостной картины. Не вполне ясна причинно-следственная связь между уровнем лептина и показателями ФВД: например, в исследовании Kim (2011) было обнаружено, что у лиц, не страдающих бронхиальной астмой, активность эозинофильного воспаления в бронхах никак не связана со степенью ожирения и уровнем лептина [11]. Возникает вопрос – является лептин фактором, первично модулирующим реактивность бронхов, или клинически лептин приобретает способность влиять на тяжесть астмы по каким-либо другим причинам в процессе патогенеза? Ведь даже в тех исследованиях, где взаимосвязь доказана, лептин явно не является единственным влияющим фактором, а сила взаимосвязи обычно остается весьма умеренной, то есть кроме лептина в патогенезе астмы принимает участие целый ряд синергетически действующих провоспалительных цитокинов.
В контексте взаимосвязи ожирения и астмы в качестве противовоспалительного цитокина обычно рассматривают адипонектин, обладающий способностью ингибировать ТНФ-альфа, ИЛ-1 и NFkB, а также индуцировать синтез других противовоспалительных цитокинов: ИЛ-10, антагонист рецептора к ИЛ-1. Адипонектин и его рецепторы (R1,R2, Т-кадгерин, кальретикулин) экспрессируются на клетках легочной ткани. Показана также способность легочного эндотелия транспортировать адипонектин в просвет альвеол с помощью Т-кадгерина. При этом важно, что концентрация адипонектина в организме при ожирении, как правило, снижается, несмотря на то, что его источником являются адипоциты. Данный парадокс объясняют тем, что макрофаги жировой ткани у пациентов с ожирением активно продуцируют ИЛ-6 и ТНФ-альфа, которые способны напрямую ингибировать секрецию адипонектина. Одна из форм адипонектина, а именно – среднемолекулярная, определяется в мокроте (как у здоровых, так и у больных), и уровень ее у пациентов с астмой достоверно снижен в сравнении с группой контроля. И наоборот, высокий уровень адипонектина мокроты является фактором, снижающим риск заболевания астмой [21]. В эксперименте на трансгенных мышах, несущих ген адипонектина (AdipoTg), показано, что адипонектин сыворотки препятствует аллергической сенсибилизации бронхиального дерева яичным альбумином [28]. Адипонектин в условиях invitro способен модулировать функцию эозинофилов, в частности, эотаксин-индуцированную адгезию и таксис, не влияя существенно на жизнеспособность клеток [29].
Клиническая значимость адипонектина как провоспалительного медиатора также весьма неоднозначна. Например, Sood, Dominic, Qualisetal. (2011) показали, что действие адипонектина имеет выраженные половые различия: у мужчин высокие концентрации его в сыворотке соответствуют худшему клиническому прогнозу, в отличие от женщин. В качестве возможных причин рассматривают: различное соотношение изоформадипонектина у мужчин и женщин, провоспалительное действие тестостерона, которое может нивелировать противовоспалительный эффект адипонектина, различие в представительстве рецепторов в легких у мужчин и женщин [20]. В исследовании de Lima Azambuja (2015) было показано, что у больных с астмой и ожирением уровень адипонектина сыворотки достоверно снижен (16,6 мг/л) по сравнению с группой астматиков с нормальным весом (21,8 мг/л, p=0,014). Однако внутри групп наблюдается парадоксальная обратная корреляция: у пациентов с более высоким уровнем адипонектина наблюдались худшие показатели FEV1 и FVC, на основании чего авторы сделали вывод о возможном наличии даже провоспалительного эффекта [6].
Вполне логично, что у больных астмой на фоне ожирения обнаруживаются измененные показатели неспецифического и местного иммунитета, а именно – состояние нейтрофильного и макрофагального звеньев. Так, у женщин с ожирением и астмой (в отличие от мужчин) наблюдается достоверно повышенный уровень нейтрофилов периферической крови и мокроты [26]. Аналогичные данные получили Scottи Gibson (2016), показавшие взаимосвязь количества нейтрофилов мокроты с уровнем тестостерона и фактом использования оральных контрацептивов [17]. Другим важным механизмом, утяжеляющим астму у больных с ожирением, рассматривают измененную реактивность альвеолярных макрофагов в ответ на стимулы. В норме активация альвеолярных макрофагов протекает по «альтернативном» пути (М2). По неизвестным причинам, при ожирении происходит «перекос» механизма активации в сторону «классического» пути (М1). Активированные данным образом макрофаги имеют меньшую способность к распознаванию апоптических клеток, что в итоге проявляется нарушением клиренса дыхательных путей. По оценке, эффективность функционирования макрофагов у больных с ожирением снижена на 40 % и к тому же отрицательно коррелирует с клиническим эффектом от применения ГКС [12].
Наряду с эффектами, опосредованными цитокинами и особенностями функционирования определенных клеток, фенотип астмы при ожирении формируется также на фоне чисто клинических особенностей пациентов. Так, одним из ключевых коморбидных состояний при ожирении является ГЭРБ. Доказано, что частота и тяжесть ГЭРБ пропорционально связаны с ИМТ [8], и наличие ГЭРБ повышает реактивность бронхов, вероятно, за счет активации блуждающего нерва, а также аспирации микроскопических количеств кислоты желудочного сока и нейроэндокринных механизмов, включающих выброс субстанции Р и нейрокинина А [22]. В целом взаимосвязь крайне мало изучена и на сегодняшнем этапе говорить о достоверном вкладе ГЭРБ в развитие астмы сложно.
В качестве еще одного механизма, который теоретически способен влиять на развитие астмы при ожирении, является обструктивное апноэ во сне. Не подлежит сомнению тот факт, что обструктивное апноэ во сне является неотъемлемым спутником избыточной массы тела, однако неясно, является ли оно фактором, отягощающим течение, либо данные состояния лишь имеют схожий набор симптомов и сосуществуют [16]?
Заключение
До настоящего момента нет определенности, является ли астма на фоне ожирения отдельным фенотипом. Вместе с тем особенности патогенеза и течения заболевания у таких пациентов не вызывают сомнения. В качестве ключевых механизмов формирования фенотипа могут рассматриваться как клинико-анатомические особенности больных с ожирением, так и иммунологические и биохимические взаимосвязи. Механизм формирования астмы при ожирении существенно отличается для мужчин и женщин, что требует учета половых различий при проведении популяционных и клинических исследований.
Библиографическая ссылка
Игнатова Г.Л., Макарова Е.А. БРОНХИАЛЬНАЯ АСТМА И ОЖИРЕНИЕ: КЛИНИКО-ПАТОГЕНЕТИЧЕСКИЕ АСПЕКТЫ ВЫДЕЛЕНИЯ НОВОГО ФЕНОТИПА ЗАБОЛЕВАНИЯ // Современные проблемы науки и образования. – 2016. – № 4.;
URL: https://science-education.ru/ru/article/view?id=25017 (дата обращения: 06.04.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
В статье представлена клинико-аллергологическая характеристика ожирения и бронхиальной астмы. Показано, что ожирение не влияет на тяжесть клинического течения и контроль за симптомами течения бронхиальной астмы.
Введение
Бронхиальная астма (БА) признана одним из наиболее распространенных, тяжелых и социально значимых заболеваний человека ввиду высокой распространенности. БА является гетерогенным заболеванием с точки зрения фенотипов. По оценке Всемирной организации здравоохранения (ВОЗ), более 300 млн человек страдают данной патологией [1]. Известно, что БА сокращает среднюю продолжительность жизни мужчин на 6,6 года, женщин — на 13,5 года, служит причиной инвалидности в 1,5% от общего числа инвалидов по всем причинам и 1,4% всех госпитализаций. Ущерб, наносимый БА, в России ежегодно измеряется потерей 3 млн рабочих дней, 10 млн дней, пропущенных в школе, 1,8 млн случаев оказания скорой и неотложной помощи. Финансовое бремя, связанное с диагностикой и лечением БА, оказывает существенное влияние на экономику стран [2]. БА является проблемой общественного здравоохранения не только для стран с высоким уровнем дохода — ею болеют во всех странах, независимо от уровня их развития. По приблизительным оценкам, ее распространенность в разных странах на сегодняшний день составляет от 3% до 15% населения. Причем в экономически развитых государствах за последние три десятилетия число больных с этим диагнозом возросло более чем втрое [3]. Большинство случаев смерти, связанных с БА, зарегистрировано в странах с низким и средненизким уровнем дохода. Имеется также недостаточный уровень диагностики и лечения БА, что создает, в свою очередь, значительное бремя для отдельных лиц и семей и часто ограничивает деятельность людей на протяжении всей их жизни [4].
Не менее важную медико-социальную проблему в мире представляют собой ожирение и избыточная масса тела (МТ), которые сегодня ВОЗ рассматривает как эпидемию, охватившую миллионы людей. В 1998 г. в мире зарегистрировано 7% взрослого населения земного шара (250 млн больных, страдающих ожирением). По данным ВОЗ, с 1980 г. число лиц во всем мире, страдающих ожирением, увеличилось более чем в два раза, в 2013 г. 42 млн детей в возрасте до 5 лет имели избыточную МТ или ожирение, а в 2014 г. – 1,9 млрд взрослых людей в возрасте 18 лет и старше имеют избыточную МТ [5].
Еще в 1980-х гг. на основе результатов эпидемиологических исследований установлено, что ожирение приводит к появлению респираторных симптомов [6]. Рассматриваются несколько возможных механизмов взаимосвязи ожирения и БА: торакодиафрагмальный механизм [7], уменьшение калибра дыхательных путей [8], а также изменение сократительной способности дыхательных мышц в связи с удлинением вдоха и выдоха, что приводит к гиперреактивности бронхов [9].
Избыточная МТ и ожирение определяются как аномальные и излишние жировые отложения, которые могут нанести ущерб здоровью. Индекс массы тела (ИМТ) рассчитывается как отношение величины МТ в килограммах к росту в метрах в квадрате (кг/м2) и часто используется для классификации ожирения и избыточной МТ. По определению ВОЗ, МТ при ИМТ ≥25 кг/м2 считается избыточной, при ИМТ ≥ 30 кг/м2 — ожирением. ИМТ является наиболее удобной мерой оценки уровня ожирения и избыточной МТ у населения, поскольку он одинаков для обоих полов и для всех возрастных категорий взрослых. Однако ИМТ следует считать приблизительным показателем, т. к. он может не соответствовать одинаковой степени упитанности у различных индивидуумов [10].
Цели исследования
Выявить распространенность ожирения среди пациентов, страдающих БА; представить клинические и функциональные данные больных БА, протекающей в сочетании с ожирением; выявить влияние ожирения на уровень контроля БА, факторы риска усиления тяжести клинического течения БА, протекающей в сочетании с ожирением; изучить возможность использования вибрационного исследования бронхолегочного аппарата (Vibration Response Imaging — VRI) для оценки состояния воздушной проводимости легких у пациентов, страдающих БА в сочетании с ожирением.
Материал и методы
Исследование проведено на базе клиники ФГБУ «ГНЦ Институт иммунологии» ФМБА России как в амбулаторных, так и в стационарных условиях. Нами проведены ретроспективный анализ медицинской документации (амбулаторные карты и истории болезни стационарных больных), обследование с помощью клинико-лабораторных, функциональных (функция внешнего дыхания (ФВД), тест на обратимость бронхиальной обструкции и др.), инструментальных, аллергологических методов (анализ аллергологического, пищевого, фармакологического анамнеза, кожные тесты с атопическими аллергенами, аллерген-специфические IgE — по показаниям), консультация эндокринолога и других специалистов по показаниям, VRI-диагностика, статистическая обработка данных.
В связи с тем, что у пациентов с ожирением избыточная жировая ткань является фактором, искажающим показатели ФВД, мы использовали метод VRI, который позволяет получить достоверные данные о функциональном состоянии респираторного тракта. Это обусловлено тем, что наличие избыточной жировой ткани не влияет на показатели вибрационного исследования бронхолегочного аппарата VRI.
VRI — это неинвазивная, нерадиационная технология, использующая контроль вибрационных сигналов дыхания, создаваемых легкими в течение цикла вдох/выдох. После сбора данных активируются запатентованные алгоритмы программного обеспечения VRIxp для преобразования полученной энергии в динамические изображения легких, которые отображаются на мониторе Workstation VRIxp, вместе с количественными данными о воздушной проводимости легочной ткани для создания визуального восприятия звуков дыхания во время вдоха и выдоха. Процедуры записи VRIxp контролируются пользователем с консоли рабочей станции простыми в использовании инструментами и меню (рис. 1, 2).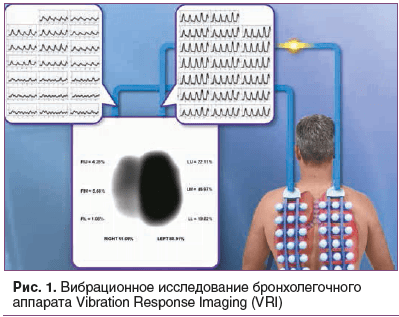
Работа проводилась в несколько этапов. Обследование выполнялось в амбулаторных условиях.
1-й этап: проводился статистический анализ клинико-лабораторных, функциональных и аллергологических показателей 367 больных БА разной степени тяжести и с разным ИМТ, проходивших лечение в клинике. У всех проводилась оценка зависимости степени тяжести БА от ИМТ методом ранговой корреляции Спирмена. Диагноз БА устанавливался в соответствии с критериями GINA.
2-й этап: отбор пациентов в исследование. В исследование были включены пациенты с БА средней степени тяжести в возрасте 18–60 лет, с длительностью течения БА не менее 5 лет, использующие ингаляционные глюкокортикостероиды (иГКС) в средневысоких дозах в качестве базисной терапии БА. У 40 пациентов, удовлетворяющих этим условиям, обследование проводилось в амбулаторных условиях. Пациенты были разделены на 2 группы: основная включала 20 пациентов, имеющих ИМТ более 30 кг/м2; контрольная группа состояла из 20 пациентов, имеющих нормальный ИМТ.
Результаты
Среди всех обследованных пациентов с БА установлено, что распространенность ожирения у стационарных больных БА составила 44,9%, что соответствует распространенности ожирения в популяции.
Степень тяжести БА у больных с нормальной, избыточной МТ и ожирением была сопоставима (рис. 3).
Структура фенотипов БА также была сопоставимой у пациентов, имеющих различный ИМТ, и подробно представлена на рисунке 4.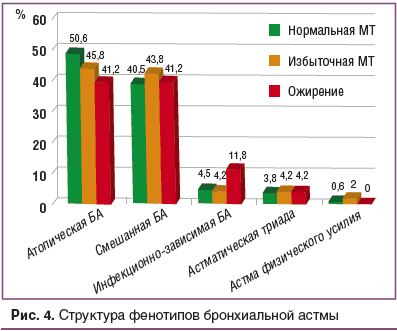
Спектр аллергенов у больных БА в группах с нормальной, избыточной МТ и ожирением был сопоставим (табл. 1).
При использовании метода VRI для определения медианы и стандартного отклонения показателей воздушной проводимости легких различий этих показателей между группами пациентов в зависимости от ИМТ не выявлено (табл. 2).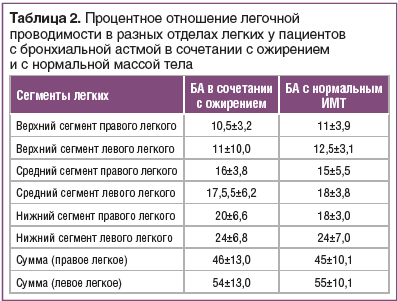
Таким образом, VRI-диагностика может быть рекомендована для оценки состояния воздушной проводимости легких у лиц с ожирением, т. к. механического воздействия жировой ткани на показатели исследования не происходит.
При анализе данных обследования установлено, что распространенность ожирения среди 367 пациентов, страдающих БА и находившихся на стационарном лечении в 2013–2015 гг., составила: в возрасте 18–30 лет — 30%, в 31–40 лет — 37,93%, в 41–50 лет — 45,78%, в 51–60 лет — 55,88%.
В настоящем исследовании установлено, что степень тяжести течения БА, протекающей у пациентов с ожирением, усиливается с возрастом, т. е. чем выше возраст, тем чаще отмечается более тяжелое клиническое течение БА (рис. 5).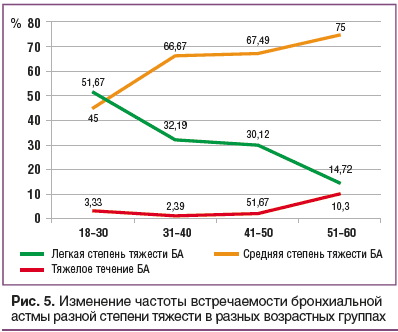
По результатам определения коэффициента ранговой корреляции Спирмена не установлено зависимости степени тяжести течения БА от ИМТ (рис. 6).
Для простоты визуализации было выделено 4 группы пациентов в зависимости от возраста: 18–30, 31–40, 41–50 и 51–60 лет. В этом исследовании не установлена корреляция тяжести течения БА с ожирением (р<0,05) (табл. 3).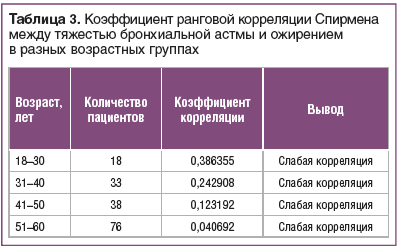
Заключение
Таким образом, распространенность ожирения среди пациентов с БА, находившихся на стационарном лечении (44,9%), оказалась сопоставимой с распространенностью ожирения в общей популяции. По данным ВОЗ, это более 39%.
При применении углубленных клинико-лабораторных, аллергологических, функциональных методов исследования у 367 стационарных больных БА установлено, что на тяжесть течения БА влияет не столько наличие ожирения, сколько возраст — чем старше пациенты, тем тяжесть течения БА выше.
Наряду с использованием стандартных функциональных методов оценки показателей внешнего дыхания нами использован новый метод для оценки воздушной проводимости легочной ткани — вибрационное исследование бронхолегочного аппарата (Vibration Response Imaging — VRI). Данная методика позволила визуализировать механическую составляющую влияния жировой ткани на процесс дыхания. Излишек жировой ткани не мешал оценить степень воздушной проводимости у пациентов, имеющих ожирение, по сравнению с группой контроля. Таким образом, данный метод можно рекомендовать для оценки воздушной проводимости вне зависимости от ИМТ.
На основании полученных результатов можно прийти к заключению о том, что научно обоснованным является включение в алгоритм диагностики и лечения БА, протекающей в сочетании с ожирением, наряду с выполнением российских и международных программ, в т. ч. «Глобальной стратегии лечения и профилактики бронхиальной астмы», методов, направленных на своевременное выявление, назначение и подбор терапии сопутствующих соматических заболеваний в соответствии с рекомендуемыми стандартами.
Источник


