Аутоиммунная гемолитическая анемия этиология патогенез
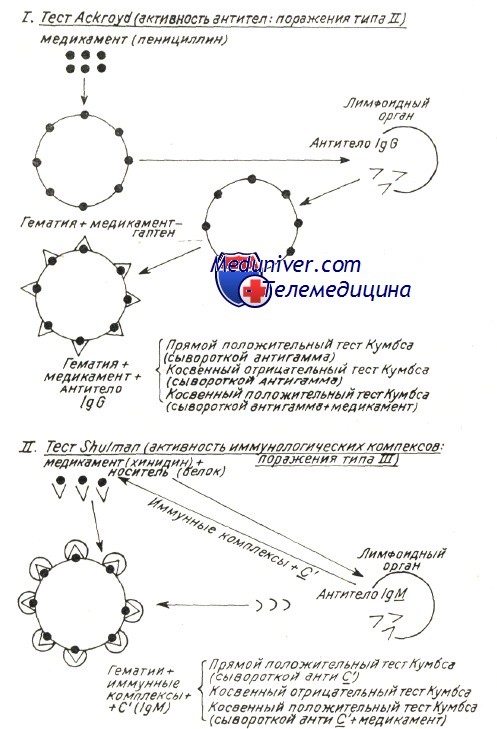
Механизмы развития аутоиммунной гемолитической анемии — патогенезВ механизме развития аутоиммунного гемолиза, независимо от вида антител, спорными представляются две проблемы: Начало аутоиммунного процесса общая проблема механизмов при всех аутоиммунных заболеваниях (Берчану), среди которых аутоиммунная гемолитическая анемия представляется как постоянная модель патогенетического исследования, применимая ряду аутоиммунных процессов. Существует ряд объяснений, в зависимости от вида аутоиммунной гемолитической анемии. Так, при вторичных формах после вирусной инфекции или сенсибилизации к медикаментозным препаратам происходит изменение антигенных структур оболочки эритроцита в результате собственно действия вируса или медикаментозного препарата. Прикрепление частиц вируса и химических антигенов к оболочке может создать новый иммуногенный комплекс, в котором инородные антигены выполняют роль сенсибилизирующего гаптена. Развивающиеся при этом антитела активны также в отношении антигенов эритроцитной оболочки и обусловливают расплавление крови. Таков механизм гемоцитолиза, описанный Ackroyd при гемоцитопении за счет сенсибилизации к медикаментозным препаратам. Поражение оболочки под воздействием вируса, медикаментозного препарата и прочих токсических веществ химической или инфекционной природы — среди широкого диапазона антигенов эритроцита — может «вскрыть» и его слабые антигены. Известно, что к последним иммуная переносимость небольшая, и что, под действием собственно острого, в частности хронического инфекционного процесса она нарушается, в результате чего развиваются аутоиммуные антиэритроцитные антитела, специфичные в отношении слабых антигенов. Проведенные в этом направлении исследования в условиях аутоиммунной гемолитической анемии доказали, что полные или неполные тепловые или холодовые антитела, выявляемые описанными выше способами в своем большинстве располагают групповой специфичностью, подобно изоантителам изоиммуной гемолитической анемии. Характеристика аутоантител при генуинной аутоиммунной гемолитической анемии в зависимости от иммунологических испытаний (видоизменение по Leddy) В таблице приведены не только физическая и биологическая характеристики антител, но и их групповая специфичность. Тепловые антитела вида IgG, выявляемые посредством прямой или косвенной реакции Кумбса с применением сыворотки антигамма и исследованные после их смыва с красных кровяных клеток, равно как и свободные антитела сыворотки специфично изоиммунные в отношении определенного резус-фенотипа. По данным Worlledge 38% тепловых антител антирезус, в то время как Weiner и Vos утверждают, что, с учетом форм резус с «делецией гена» эта пропорция равняется 70%. Доказать это удалось после пересмотра случаев, оказавшихся отрицательными к резус-специфичным антителам, но в которых, тем не менее, определяется наличие специфичности к более слабым резус-антигенам. Это антитела специфичные в отношении «нулевых» резус-гематий или тех, которые содержат лишь антигены ZW, рассматриваемые как D-like (Dacie и Worlledge, Eyster). Видимо они представляют собой антигенное вещество предшествующее антигенам резус-группы (Weiner и сотр.). Итак, иммунологические анализы доказали специфичность тепловых антител, при этом был уточнен ряд подгрупп Rr», h’ в рамках Rh наряду с группами ZW, реже JK и К (Yokoyama). Резус и иммуноглобулиновая специфичности объясняют их закрепление на красных кровяных клетках, но без связывания комплемента; это последнее явление видимо можно проследить лишь в отдельных подклассах иммуноглобулинов. По Muller-Eberhard связывание комплемента наблюдается только на подгруппах IgG1…IgG3 (исключается IgG4). В связи с этим не дано объяснение тому факту, что тепловые антитела, в принципе относящиеся к подгруппе IgG1 с анти-резус специфичностью, либо не связывают комплемент, либо связывают его очень редко.
Холодовые антитела проявили специфичность также к слабым антигенам, таким как антиген 1, который, вопреки этой слабости выявляется в размере примерно 100% той или иной популяции, как отметили Weiner и Vos на 20 тыс. образцов отобранной сыворотки. Лишь небольшой процент располагает специфичностью к антигену i, как было обнаружено в редких случаях гемолитической анемии после инфекционного моно-нуклеоза (Walheim и сотр.). Итак, удалось определить, что располагающие групповой специфичностью анти-I антитела это связывающие комплемент IgM. Другой механизм развития аутоантител можно проследить при гемолитической анемии за счет злокачественной лимфопролиферации, когда происходит расстройство клеточной системы иммунитета (КСИ). Следует предполагать, что в процессе злокачественной эволюции лимфоцитов в условиях хронической лимфатической лейкемии, ЛС или даже ОЛЛ разрастанием охвачены также «клоны» клеток, которые, по теории Burnet, рассматриваются как «запрещенные ». Таковыми являются линии лимфоидных клеток, ответственных за переносимость к сельфу, но остающихся неактивными или «спящими» в период зародышевой «клональной селекции» (Burnet). Их злокачественная пролиферация видимо обусловливает и развитие специфических антител к сельф-антигенам эритроцита в результате активации последних. Однако злокачественная пролиферация может ограничиться активными лимфоидными клетками вида В, ускальзывающими от избирательного угнетающего контроля клеток Т, сохраняющих врожденную иммуную переносимость. Таким образом создается иммуная функциональная диссоциация, обусловливающая выработку аутоиммуных антител. Независимо от гипотезы клиническое наблюдение доказало, что развитие антител и гемолиз прекращаются лишь после уничтожения образующего аутоантитела злокачественного клонуса, посредством цитостатической терапии. Возможно, что механизм пролиферации «запрещенных» клонусов действует и при гемолитической анемии с холодовыми антителами как следствие вирусной инфекции, такой как вирусная пневмония. Известно, что у индивидов в норме титр антител — холодовых агглютининов — невелик, составляя примерно 1/8—1/16. Резкая пролиферация за счет вирусной инфекции обусловливает активацию отдельных латентных лимфоидных клонусов, которые, возможно, ответственны за образование холодовых агглютининов (Van Loghem). В таких случаях, когда, по истечении определенного периода, расплавление крови не прекращается, показанная при гемолитической анемии с Холодовыми антителами цитостатическая терапия может оказать угнетающее действие на эти разросшиеся и образующие аутоантитела клонусы, подобно тому как наблюдается при злокачественной лимфопролиферации. Поскольку присутствие гемолитических аутоантител наблюдается и при некоторых реактивных процессах пролиферации во многих аутоиммунных и иммунодефицитных заболеваниях (Берчану) принято считать, что у подобных больных происходит более сложное нарушение иммунитета, неустойчивость гомеостатической системы иммунитета. В связи с этим, у страдающих иммунодефицитом к нонсельфу возможны отклонения иммунитета с понижением переносимости к сельфу. В механизме развития аутоиммунных заболеваний выявлено определенное отношение между иммунодефицитами к нонсельфу, состояниями гиперсенсибилизации, обусловливающими иммуные комплексы путем хронических неконтролируемых инфекций и развитием аутоиммуной болезни (Берчану). Тот факт, что аутоиммунные процессы, такие как аутоиммунная гемолитическая анемия при заболеваниях за счет отсутствия антител, улучшаются или даже исцеляются правильным назначением иммуноглобулина, подтверждает наличие нарушенного равновесия и лабильности иммунитета. И наконец, принято считать, что при определенных вирусных или микробных инфекциях, в частности отдельных новообразованиях — яичниковых и желудочных (Van Loghem) — в организме появляются антигены, структура которых близка к структуре антигенов отдельных эритроцитных групп. Эти перекрестнореагирующие антигены определяют развитие перекрестнореагирующих антител гемолитического действия и в отношении эритроцитов.
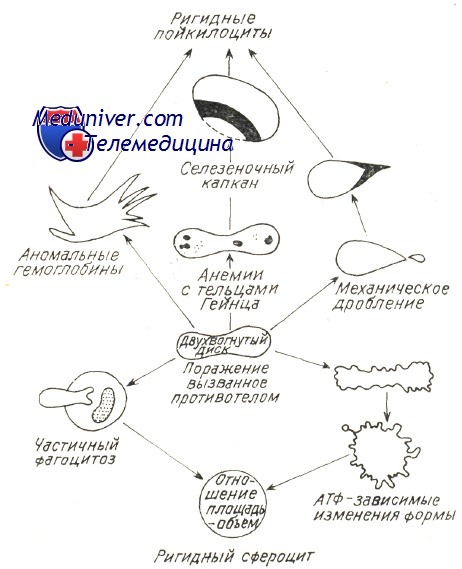
Во всех отмеченных стимулирующих иммунитет механизмах в патологических условиях (злокачественная лимфопролиферация, хроническое заболевание с чрезмерной нагрузкой на иммуную систему, заболевать за счет иммунодефицита), особенно когда аутоиммуная гемолитическая болезнь носит многолетний затяжной характер, следует предполагать нарушение врожденной иммуной переносимости с образованием гемолитических аутоантител, равно как и прочие аутоиммуные расстройства (Берчану). В принципе нарушается наиболее слабая иммуная переносимость к антигенам невысокой иммуногенной способности — Rh, I, i, Т. Реже встречаются случаи нарушения переносимости к крепким антигенам группы АВО, причем они редки в условиях злокачественной лимфопролиферации, когда развиваются «панагглютинины», расплавляющие эритроциты всех групп и переливание крови становится весьма опасным. По новым гипотезам о развитии аутоиммуных заболеваний предполагается наличие нарушения сотрудничества систем Th и Т8; дефицит Ts способствует дерепрессии «запрещенных » клонов В и выделению аутоантител (Берчану). Разрушение красных кровяных клеток в условиях аутоиммуного гемолиза подвергалось основательным исследованиям, в частности изучением реакций в пробирке между антителами и эритроцитами; при этом наблюдалось и действие комплемента в условиях гемолиза за счет холодовых антител, в частности при пароксизмальной холодовой анемии (Rosse и Dovramashkin). Электронномикроскопическое исследование оболочки эритроцита в условиях острого гемолиза при пароксизмальной гемоглобинурии показало, что, под воздействием связывающих комплемент холодовых антител на оболочке образуются «поры ». В связи с этим нарушается обмен катионов после проникновения воды в гематии и развивается острое внутрисосудистое расплавление крови. Поскольку существуют не расплавляющиеся гематии, со связанным на их оболочке комплементом, равно как и находящиеся в процессе расплавления гематии, на которых закрепляются лишь антитела (IgG), принято считать, что антитела необходимы для развертывания приоцесса гемолиза, который, следовательно, прижизненно не представляется возможным лишь под воздействием комплемента (Evans и сотр.). Фракции связанного комплемента видимо направляют механизм расплавления. Фракция С3 играет первостепенную роль в процессе гемолиза с холодовыми антителами. Issit установил роль фракции С3b, как при внутрисосудистом, так и печеночном внутриклеточном расплавлении крови. Явление пожирания красных кровяных клеток периферическими моноцитоидными макрофагами, неизменно наблюдаемое при гемолизе в условиях пароксизмальной гемоглобинурии, равно как и гистопатологическое исследование оперированной селезенки (Jandl) уже давно уточнили этот механизм. Недавно проведенные исследования выявили, что, в концентратах периферических лейкоцитов, несущие на себе Иг и комплемент эритроциты пожираются моноцитами. В зависимости от концентрации иммунных комплексов на эритроцитах увеличивается процент эритрофагоцитоза и наблюдается явление расположения розеткой гематий вокруг макрофагов (Abramson и сотр., Huber, и сотр.). В условиях аутоиммуной гемолитической болезни доказано наличие ряда механизмов внутриклеточного патологического расплавления крови, сокращающего продолжительность жизни красных кровяных телец. Возможно неполные антитела типа IgG или закрепленный на оболочке комплемент изменяют функциональную структуру эритроцита в отношении его подвижности в синусоидных органах, печени и селезенке, затем, посредством явления «секвестрации», его захватывает и разрушает макрофаг. Недавно уточнилось, что в селезенке, секвестрация осуществляется макрофаговыми рецепторами на несущий эритроцитом IgG. Макрофаги печени располагают рецепторами на С, вот почему несущие этот иммуноглобулин эритроциты разрушаются преимущественно в печени (Brown, Гологан и Берчану, Берчану). Этим объясняется положительный результат удаления селезенки лишь при гемолитической анемии с тепловыми антителами типа IgG (Бутояну и Берчану). В последние годы определилось, что в любом гемолитическом процессе, в том числе за счет ауто- или изоиммунных антител, происходит нарушение отношения объема и площади красной юровяной клетки, в связи с чем уменьшаются ее пластичность и элластичность (Weed). В главах, рассматривающих нормальное расплавление крови, говорилось о том, что элластичность гематий способствует их прохождению через поры синусовидиых эндотелиев, диаметром меньше 3 и. При этом эритроциты, располагающие большой степенью эластичности приспосабливают свою форму к размеру пересекаемого отверстия. Исследования в пробирке, при помощи оболочек с порами определенных размеров, уточнили условия прохождения в зависимости от «показателя элластичности», соответствующего показателю «фильтрации» (Jandl, Teitel). При иммуном патологическом гемолизе закрепленные на оболочке антитела или комплемент вызывают ее частичный разрыв и тем самым сокращение площади. Гематии приобретают вид сфероцита, как это отмечается в основном при приступах острого расплавления крови за счет тепловых или холодовых антител. После изменения отношения объем/площадь красные кровяные тельца становятся жесткими, пластичность понижается и прижизненно они более не проходят через поры эндотелия, а в пробирке — через поры циркуляционной мембраны. Итак наблюдается секвестрация гематий, «сенсибилизированных» гуморальными иммунными факторами, обусловливающими этим путем резкое пожирание красных кровяных клеток. Weed предложил схему, объясняющую механизм внутрисосудистого расплавления крови при любом гемолитическом эндоили экзоэритроцитном заболевании. Изменение эластичности, жесткость гематий предшествуют внутриклеточному гемолизу, обусловленному изменением количественного отношения площадь/объем и набуханием гематий в связи с изменением проницаемости или осаждением патологического гемоглобина. — Также рекомендуем «Лечение аутоиммунной гемолитической анемии — схема» Оглавление темы «Гемолитические анемии»:
|
Источник
Гемолитическая анемия — анемия, возникающая в результате повышенного эритродиереза, когда разрушение эритроцитов преобладает над их образованием.
Классификация. По этиологии гемолитические анемии подразделяются на приобретенные и наследственные. В свою очередь в зависимости от этиологических факторов, вызвавших гемолиз эритроцитов, приобретенные гемолитические анемии делятся на токсические, обусловленные действием экзогенных и эндогенных гемолитических ядов; иммунные (гетеро-, изо-, аутоиммунные), когда гемолиз происходит под влиянием комплекса антиген — антиэритроцитарное антитело; механические — при механическом повреждении эритроцитов; мембранопатии, связанные с соматической мутацией пролиферирующих клеток эритроцитарного ряда и образованием популяции эритроцитов с дефектом структуры мембраны.
На основании того, какие генетические нарушения привели к усилению гемолиза эритроцитов, наследственные гемолитические анемии подразделяют на наследственные мембранопатии, ферментопатии и гемоглобинопатии, вызванные генетическими дефектами структуры мембраны, активности ферментов эритроцитов и синтеза гемоглобина. Имеется две разновидности наследственных гемоглобинопатии: анемии, связанные с нарушением синтеза цепей глобина, и анемии, обусловленные наследственным дефектом первичной структуры цепей глобина.
Этиология приобретенных гемолитических анемий. Токсическая гемолитическая анемияможет развиться под влиянием гемолитических ядов (соединения мышьяка, свинца, нитробензол, фенилгидразин; алкоголь, желчные кислоты, токсические продукты азотистого обмена; змеиный, грибной, пчелиный яды и др.), а также при действии возбудителей инфекционных и паразитарных заболеваний (гемолитический стрептококк, анаэробная инфекция, малярийный плазмодий, лейшмания).
Иммунная (гетеро-, изо-, аутоиммунная) гемолитическая анемияразвивается при переливании видо-, группо- и резус-несовместимой крови; резус-несовместимости матери и плода; образовании аутоантител против собственных эритроцитов при изменении их антигенных свойств под влиянием лекарственных препаратов, вирусов, микроорганизмов или в результате соматической мутации иммуноцитов, когда возникает «запретный» клон лимфоцитов, продуцирующих антитела к нормальным антигенам эритроцитов (при лейкозе, системной красной волчанке и др.).
Механическое повреждение эритроцитовможет возникнуть при протезировании кровеносных сосудов и клапанов сердца, длительном марше или беге по твердому грунту (маршевая гемоглобинурия), спленомегалии.
Причиной приобретенной мембранопатииможет стать соматическая мутация эритробластов под действием вирусов, микроорганизмов, лекарственных препаратов с образованием патологической популяции эритроцитов, у которых нарушается структура мембраны и повышается чувствительность к комплементу (пароксизмальная ночная гемоглобинурия).
Патогенез.Механизм гемолиза при приобретенной гемолитической анемиизаключается в повреждении структуры мембран эритроцитов. Одни гемолитические факторы (например, механические) оказывают прямое повреждающее действие, другие (мышьяковистый водород, нитриты), являясь сильными окислителями, вызывают сначала метаболические, а затем функциональные и структурные изменения в мембране и строме эритроцитов, приводящие к их гемолизу. Многие гемолитические яды биологического происхождения обладают ферментной активностью (лецитиназная активность стрепто-, стафилолизинов, яда насекомых и змей), разрушая лецитин мембран. При иммунных гемолитических анемиях IgG и IgM присоединяют к эритроцитарной мембране комплемент, который при этом активируется и вызывает ее ферментативный лизис.
Под влиянием гемолитических агентов в мембранах эритроцитов образуются поры, через которые из клетки выходят ионы калия, фосфаты, а ионы натрия поступают в клетку. Вследствие сдвигов ионного баланса вода проникает в эритроцит, который при этом набухает, приобретает сферическую форму, его клеточная поверхность уменьшается, снижается способность к деформации. Такие сфероциты не могут пройти через межэндотелиальные поры синусов селезенки и фагоцитируются селезеночными макрофагоцитами. Когда объем эритроцита достигает критического (146 % первоначального), а размер пор мембраны превышает 6 нм, наступает гемолиз с выходом гемоглобина в плазму.
Гемолиз эритроцитов при приобретенных гемолитических анемиях происходит преимущественно в кровеносном русле. Однако при резус-конфликте (гемолитическая болезнь новорожденных) антирезусные агглютинины, образовавшиеся в организме резус-отрицательной матери, вызывают гемолиз резус-положительных эритроцитов плода или новорожденного не только внутри сосудов, но и в печени и селезенке (внутриклеточный гемолиз).
При наследственной гемолитической анемиигемолиз обусловлен снижением осмотической и механической резистентности эритроцитов с генетически детерминированными нарушениями структуры мембраны, метаболизма, синтеза гемоглобина.
Так, при наследственной мембранопатии(микросфероцитарная гемолитическая анемия или болезнь Минковского—Шоффара с аутосомно-доминантным наследованием) генетический дефицит в мембране — эритроцитов Са2+-зависимой АТФазы и фосфолипидов приводит к повышению проницаемости мембраны. В клетки поступают ионы натрия и вода, эритроциты превращаются в сфероциты с резко пониженной способностью деформироваться при прохождении через синусы селезенки. Отрыв части оболочки у таких эритроцитов ведет к образованию микросфероцитов с укороченной продолжительностью жизни (8—14 дней вместо 120 дней в норме) в связи с захватом их макрофагоцитами селезенки и печени (внутриклеточный гемолиз).
При наследственной ферментопатии, например глюкозо-6-фосфатдегидрогеназодефицитной анемии (доминантное, сцепленное с X-хромосомой наследование), острый внутрисосудистый гемолиз эритроцитов, возникающий при приеме лекарств с высокой окислительной способностью (противомалярийные препараты, фтивазиди др.), обусловлен повреждением клеточных мембран перекисями, так как в эритроцитах с дефицитом Г-6-ФДГ понижено содержание восстановленного глутатиона (антиоксиданта).
Внутриклеточный гемолиз эритроцитов при наследственной гемоглобинопатии связан с синтезом аномального или не свойственного данному возрасту гемоглобина1. Так, при серповидноклеточной анемии2 образуется HbS (в β-цепи глобина глутаминовая кислота заменена валином), который в восстановленном состоянии выпадает в кристаллы и вызывает деформацию эритроцитов (серповидная форма); гипоксия способствует усилению гемолиза таких эритроцитов. При α-талассемии (генетический дефект синтеза α-цепей) происходит гемолиз эритроцитов с аномальным гемоглобином — Bart—НЬ(γ4) у новорожденных и НЬН(β4) у взрослых людей; при β-талассемии, когда нарушен синтез β-цепей и не образуется НЬА,(α2β2), гемолизируются эритроциты, содержащие фетальный гемоглобин (α2γ2) или же НbА2(α2δ2).
Следствием массивного гемолиза эритроцитов является анемия с нарушением дыхательной функции крови и развитием гипоксии. Образовавшийся при распаде эритроцитов гемоглобин циркулирует в крови (гемоглобинемия) и соединяется с гаптоглобином в крупномолекулярный комплекс, не проходящий через почечный фильтр. Если же содержание свободного гемоглобина в плазме превышает 20,9 ммоль/л (337 г/л) или исходный уровень гаптоглобина низкий, тогда не связанный с последним гемоглобин начинает выделяться с мочой (гемоглобинурия). Частично гемоглобин поглощается клетками макрофагоцитарной системы и расщепляется в них до гемосидерина. Гемосидероз селезенки, почек, печени, костного мозга сопровождается реактивным разрастанием соединительной ткани и нарушением функций этих органов. Повышенное образование из гемоглобина желчных пигментов обусловливает развитие гемолитической желтухи (см. раздел XXII — «Патологическая физиология печени»). Кроме того, внутрисосудистый распад эритроцитов может привести к появлению тромбов и нарушению кровоснабжения тканей, отсюда — трофические язвы конечностей, дистрофические изменения в селезенке, печени, почках. В результате поступления в сосудистое русло большого количества эритроцитарного тромбопластина возможно развитие ДВС-синдрома.
Картина крови. Приобретенная гемолитическая анемия по типу кроветворения является эритробластической, по степени регенерации костного мозга — регенераторной, по цветовому показателю — нормо-или гипохромной, реже — ложногиперхромной (вследствие абсорбции гемоглобина на эритроцитах). Степень уменьшения количества эритроцитов и гемоглобина зависит от интенсивности гемолиза. В мазке крови обнаруживаются клетки физиологической регенерации и дегенеративно измененные эритроциты (пойкилоцитоз; разорванные, фрагментированные эритроциты, анизоцитоз). Появление большого количества эритробластов и нормобластов характерно для гемолитической болезни новорожденных.
При наследственной гемолитической анемии отмечается усиленная регенерация эритроцитарного ростка часто с неэффективным эритропоэзом, когда в костном мозге разрушаются ядерные формы эритроцитов. В мазке крови наряду с регенеративными формами (высокий ретикулоцитоз, полихроматофилия, единичные ядерные формы эритроцитов) находятся дегенеративно измененные клетки (микросфероциты при болезни Минковского — Шоффара, серповидные при S-гемоглобинопатии, мишеневидные, базофильно пунктированные — при талассемии). При частых гемолитических кризах может возникнуть гипорегенераторная анемия.
Дата добавления: 2015-06-05; просмотров: 2370; Опубликованный материал нарушает авторские права? | Защита персональных данных
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 9240 — | 7441 — или читать все…
Читайте также:
Источник