Апластическая анемия патогенез патофизиология
Гипопластическая анемия — заболевание системы крови, характеризующееся угнетением кроветворной функции костного мозга и проявляющееся недостаточным образованием эритроцитов, лейкоцитов и тромбоцитов (пангемоцитопенией) или только одних эритроцитов (парциальная гипопластическая анемия, эритробластофтиз). Основа патологического процесса — нарушение пролиферации и дифференциации клеток костного мозга. Характерным признаком этого заболевания системы крови является полное истощение (аплазия) костного мозга и глубокое нарушение его функции, что сопровождается резко выраженной анемией, лейкопенией и тромбоцитопенией. Недостаточная продукция костным мозгом клеток обусловливает основные механизмы развития заболевания — анемический синдром, инфекционные осложнения в связи с гранулоцитопенией и геморрагический синдром.
Основными этиологическими факторами гипопластических анемий являются: ионизирующая радиация; инсектициды; цитостатические препараты; другие лекарственные средства; антитела против клеток костного мозга; вирусные инфекции (вирусный гепатит); наследственные факторы; идиопатическая гипо- и апластические анемии.
Картина крови
При исследовании периферической крови отмечаются панцитопения, резчайшая анемия с низким ретикулоцитозом, выраженным анизо-пойцилоцитозом. Содержание гемоглобина падает до 15—20 г/л. Лейкопения, тромбоцитопения разной степени. Резкое ускорение СОЭ — до 60—80 мин/ч. Исследование костномозгового кроветворения при апластической анемии обнаруживает картину почти полного опустошения костного мозга
Патогенез
В настоящее время основными патогенетическими факторами апластической анемии считаются:
- · поражение полипотентной стволовой гемопоэтической клетки;
- · поражение клеточного микроокружения стволовой кроветворной клетки и опосредованное нарушение ее функции;
- · иммунная депрессия кроветворения и апоптоз стволовых кроветворных клеток;
- · укорочение жизни эритроцитов;
- · нарушение метаболизма кроветворных клеток.
Поражение полипотентной стволовой гемопоэтической клетки — важнейший патогенетический фактор апластической анемии. Стволовая клетка является родоначальницей всех кроветворных клеток. При апластической анемии значительно снижается колониеобразующая способность костного мозга, нарушается пролиферация кроветворных клеток, в конечном итоге формируется синдром панцитопении — лейкопения, анемия, тромбоцитопения. Окончательно механизм угнетения активности полипотентной стволовой кроветворной клетки не выяснен.
Клиническая картина
Основная клиническая и лабораторная симптоматика приобретенной гипо- и апластической анемии с поражением всех трех кроветворных ростков костного мозга обусловлена тотальным угнетением гемопоэза, а также гипоксией органов и тканей и геморрагическим синдромом. Выраженность симптоматики зависит от степени тяжести и варианта течения анемии.
Больные предъявляют жалобы характерные для анемического синдрома. Характерны кровоточивость (десневые, носовые, желудочно-кишечные, почечные, маточные кровотечения) и частые инфекционно-воспалительные заболевания. При острой форме симптомы развиваются быстро и течение заболевания с самого начала тяжелое. Но у большинства больных заболевание развивается достаточно медленно, постепенно, в определенной мере пациенты адаптируются к анемии. Заболевание обычно распознается при выраженной симптоматике.
При осмотре больных обращает на себя внимание выраженная бледность кожи и видимых слизистых оболочек, часто с желтушным оттенком; геморрагические высыпания на коже, чаще в виде кровоподтеков различной величины. Часто на месте инъекций (внутримышечных, внутривенных, подкожных) образуются обширные гематомы. Геморрагическая сыпь локализуется преимущественно в области голеней, бедер, живота, иногда на лице. Могут наблюдаться кровоизлияния в конъюнктиву и видимые слизистые оболочки — губы, слизистую оболочку полости рта. Могут быть тяжелые носовые, желудочно-кишечные, почечные, легочные, маточные, внутрицеребральные кровотечения. Периферические лимфоузлы не увеличены.
При исследовании внутренних органов могут обнаруживаться следующие изменения:
- · Система органов дыхания — частые бронхиты, пневмонии.
- · Сердечно-сосудистая система — синдром миокардиодистрофии.
- · Система органов пищеварения — при выраженном геморрагическом синдроме могут обнаруживаться эрозии на слизистой оболочке желудка, 12-перстной кишки.
Нередко развивается гемосидероз внутренних органов вследствие повышенного разрушения неполноценных эритроцитов, снижения использования железа костным мозгом, нарушения синтеза гема, частых переливаний эритроцитарной массы.
Лабораторные данные и инструментальные исследования
Общий анализ крови — выраженное снижение количества эритроцитов и гемоглобина; анемия у большинства больных нормохромная, нормоцитарная; характерно отсутствие или резкое снижение количества ретикулоцитов (арегенераторная анемия); наблюдается лейкопения за счет гранулоцитопении с относительным лимфоцитозом; характерна тромбоцитопения. Таким образом, наиболее существенным лабораторным проявлением гипо- и апластической анемии является панцитопения. СОЭ увеличена.
Биохимический анализ крови — содержание сывороточного железа повышено, процент насыщения железом трансферина значительно увеличен.
Исследование стернального пунктата (миелограмма) — выраженное уменьшение клеток эритроцитарного и гранулоцитарного рядов, лимфоцитов и значительная редукция мегакариоцитарного ростка. В тяжелых случаях костный мозг выглядит «опустошенным», в стернальном пунктате можно обнаружить лишь единичные клетки. В костном мозге значительно увеличивается содержание железа, расположенного как внеклеточно, так и внутриклеточно.
Диагностические критерии
- · Нормохромная нормоцитарная арегенераторная анемия с резким снижением или полным отсутствием ретикулоцитов, увеличением СОЭ.
- · Лейкоцитопения, абсолютная гранулоцитопения, относительный лимфоцитоз.
- · Тромбоцитопения.
- · Резко выраженный абсолютный дефицит в миелограмме клеток эритро-, лейко- и тромбоцитопоэза, задержка их созревания.
- * Увеличение содержания железа внутри эритрокариоцитов и внеклеточно.
- · Резкое уменьшение количества или полное исчезновение кроветворных клеток и замещение кроветворного костного мозга жировой тканью в трепанобиоптате подвздошной кости является основным методом верификации диагноза гипо- и апластической анемии).
- · Повышение уровня сывороточного железа.
Источник
Апластическая анемия — это синдром хронической первичной недостаточности гемопоэза с одновременным присутствием панцитопении (анемии, нейтро-пении и тромбоцитопении). По всей видимости, у большинства пациентов развитие заболевания инициируют аутоиммунные механизмы. Способствующим фактором, по крайней мере у некоторых пациентов, вероятно, служат наследственные или приобретенные нарушения КСК.
а) Этиология. Наиболее распространенные причины апластической анемии перечислены в таблице ниже. Большинство случаев известной этиологии связано с воздействием химических веществ и лекарственных средств. Некоторые препараты и химические вещества (включая многие противоопухолевые химиотерапевтические вещества и органический растворитель бензол) вызывают дозозависимую и обратимую супрессию костного мозга.
В других случаях апластическая анемия возникает непредсказуемым образом по типу идиосинкразии в ответ на лекарственные средства (например, хлорамфеникол и соли золота), обычно не вызывающие супрессию костного мозга.
Персистирующая аплазия костного мозга может появиться после различных вирусных инфекций; чаще всего после вирусного гепатита типа не-А, не-В, не-С, не-G (5-10% случаев). Почему апластическая анемия возникает только у некоторых индивидов, до сих пор неизвестно.
Облучение всего тела может разрушать КСК в зависимости от дозы облучения. У лиц, получавших терапевтическое облучение или подвергшихся облучению в результате несчастного случая (например, как это было в Чернобыле), существует риск развития аплазии костного мозга.
В основе некоторых форм апластической анемии лежат наследственные дефекты. Анемия Фанкони представляет собой редкое аутосомно-рецессивное заболевание, вызываемое дефектами мультибелкового комплекса, необходимого для репарации ДНК. Гипофункция костного мозга становится очевидной в раннем периоде жизни и обычно сопровождается множественными врожденными аномалиями, например гипоплазией почек и селезенки, аномалиями костей, чаще всего большого пальца кисти и лучевых костей.
Наследственные дефекты теломеразы обнаруживаются в 5-10% случаев апластической анемии, возникающей у взрослых. Напомним, что теломераза необходима для клеточного «бессмертия» и неограниченной репликации, поэтому последствием частичного дефицита активности теломеразы могут быть преждевременное истощение КСК и аплазия костного мозга. Аномально короткие теломеры, которые обнаруживаются в клетках костного мозга у 50% лиц, страдающих апластической анемией, встречаются более часто, чем мутации теломеразы. Остается неясным, обусловлено ли это укорочение какими-то другими дефектами теломеразы или является следствием избыточной репликации стволовых клеток.
В большинстве случаев инициирующий фактор идентифицировать не удается; 65% случаев попадает в эту идиопатическую категорию.

б) Патогенез. Патогенез апластической анемии изучен не полностью. Маловероятно, что в основе всех случаев лежит единый механизм. Однако очевидно, что существуют два основных этиологических фактора: внешняя, иммуноопосредованная супрессия костномозговых клеток-предшественников и внутренняя аномалия стволовых клеток.
Все большее внимание привлекает экспериментальная модель, в которой активированные Т-клетки супрессируют КСК. Вначале могут произойти антигенные изменения стволовых клеток в результате действия лекарственных средств, инфекционных агентов или других, неизвестных внешних воздействий. Это вызывает клеточный иммунный ответ, в течение которого активированные Тh1 -клетки продуцируют цитокины, например IFN-y и TNF, которые супрессируют и убивают гемопоэтические клетки-предшественники. Такое представление подкрепляется рядом наблюдений.
Исследование немногих сохраняющихся при апластической анемии стволовых клеток костного мозга показало, что у них повышена экспрессия генов, участвующих в апоптозе и активирующих пути клеточной гибели. Примечательно, что экспрессия тех же генов повышена у нормальных стволовых клеток, подвергнутых действию IFN-y.
Еще более убедительные (основанные на клиническом опыте) данные получены при изучении эффектов иммуносупрессивной терапии. Антитимоцитарный глобулин и другие иммуносупрессивные агенты, например циклоспорин, вызывают реакцию в 60-70% случаев. Предполагают, что действие этих лекарственных средств основано на супрессии или гибели клонов аутореактивных Т-клеток. Природа антигенов, распознаваемых аутореактивными Т-клетками, изучена недостаточно. В некоторых случаях мишенями могут быть связанные с GPI белки. Этим можно объяснить связь апластической анемии и пароксизмальной ночной гемоглобинурии.
Альтернативное предположение о том, что апластическая анемия возникает в результате фундаментальных дефектов стволовых клеток, подтверждается присутствием кариотипических аберраций, случайной трансформацией аплазии в миелоидную неоплазию (например, в миелодиспластический синдром либо острую миелоидную лейкемию) и связью с аномально короткими теломерами. Некоторые воздействия на костный мозг (или предрасположенность к повреждению ДНК), вероятно, влекут за собой нарушения, ограничивающие способность стволовых клеток к пролиферации и дифференцировке. Если повреждение значительное, развивается апластическая анемия.
Указанные механизмы не являются взаимоисключающими, поскольку генетически измененные стволовые клетки также могут экспрессировать неоантигены и тем самым служить мишенями для Т-клеток.
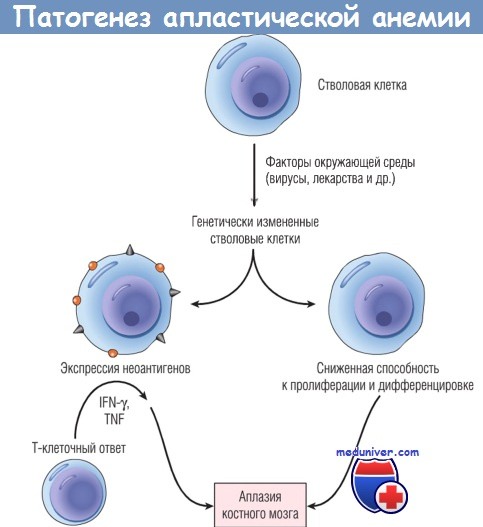
Патофизиология апластической анемии.
Поврежденные стволовые клетки могут продуцировать дочерние клетки, экспрессирующие неоантигены,
которые вызывают аутоиммунную реакцию, или же образуют клональную популяцию со сниженной пролиферативной активностью.
В обоих случаях возможна аплазия костного мозга.
IFN — интерферон; TNF — фактор некроза опухоли.
в) Морфология. Заметно обедненный клетками костный мозг в значительной степени лишен гемопоэтических клеток. Нередко остаются только жировые клетки, фиброзная строма, рассеянные лимфоциты и плазматические клетки. Аспирация костного мозга часто дает мало материала («сухой прокол»), поэтому для исследования лучше всего использовать биоптаты костного мозга. Другие неспецифические патологические изменения — гранулоцитопения и тромбоцитопения — обусловлены мукокутанными бактериальными инфекциями и аномальным кровотечением соответственно. Проведение множественных трансфузий при анемии индуцирует развитие системного гемосидероза.
г) Клинические признаки. Апластическая анемия наблюдается в любом возрасте и не зависит от пола. Обычно начало болезни бессимптомно. Первые проявления варьируют в зависимости от того, какая клеточная линия преимущественно поражена, однако в конечном итоге возникает панцитопения с ожидаемыми последствиями. Анемия вызывает прогрессирующую слабость, бледность и одышку. О тромбоцитопении свидетельствуют петехии и экхимозы. Нейтропения приводит к развитию частых и персистирующих минорных инфекций или внезапных озноба, лихорадки и общей слабости. Спленомегалия, как правило, отсутствует.
Если же она есть, то диагноз «апластическая анемия» должен быть подвергнут тщательной проверке. Со стороны эритроцитов обычно отмечается слабо выраженный нормохромный макроцитоз, а ретикуло-цитопения присутствует всегда.
Диагноз основывают данными исследований биоптатов костного мозга. Важно отличить апластическую анемию от других типов панцитопении, таких как алейкемическая лейкемия и МДС, которые могут иметь идентичные клинические проявления. При апластической анемии костный мозг обычно значительно обеднен клетками, тогда как миелоидные неоплазии ассоциируются с гиперклеточным костным мозгом, заполненным неопластическими клетками-предшественниками.
Прогноз вариабелен. Трансплантация костного мозга — терапия выбора, если есть подходящий донор, что обеспечивает 5-летнюю выживаемость в 75% случаев. Организм пожилых пациентов и тех больных, которым не смогли подобрать подходящего донора, часто хорошо отвечает на иммуносупрессивную терапию.
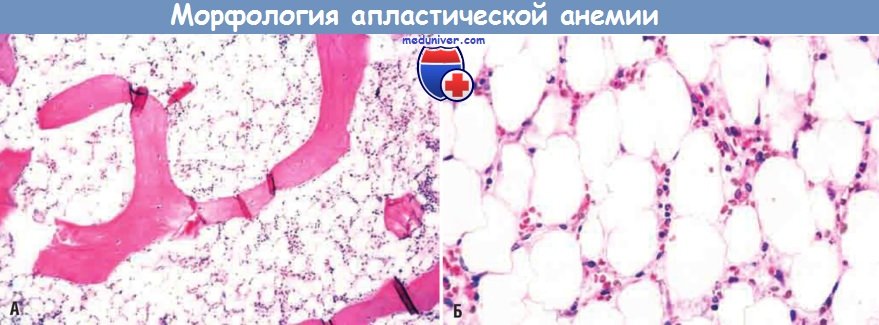
Апластическая анемия (биоптат костного мозга).
Заметное снижение количества клеток в костном мозге, содержащем в основном жировые клетки.
(А) Малое увеличение. (Б) Большое увеличение.
— Рекомендуем ознакомиться со следующей статьей «Механизмы развития (патогенез) эритроцитарной аплазии»
Оглавление темы «Патогенез анемий и кровотечений»:
- Механизмы развития (патогенез) апластической анемии
- Механизмы развития (патогенез) эритроцитарной аплазии
- Механизмы развития (патогенез) недостаточности костного мозга
- Механизмы развития (патогенез) полицитемий
- Классификация геморрагических заболеваний
- Механизмы развития (патогенез) геморрагии из-за патологии сосудистой стенки
- Механизмы развития (патогенез) кровотечения из-за тромбоцитопении
- Механизмы развития (патогенез) иммунной тромбоцитопенической пурпуры
- Механизмы развития (патогенез) лекарственной тромбоцитопении
- Механизмы развития (патогенез) тромбоцитопении при ВИЧ-инфекции
Источник
Сущность гипопластической (и апластической) анемии состоит в резком угнетении костномозгового кроветворения, что сопровождается снижением количества эритроцитов, лейкоцитов и тромбоцитов. Известна также парциальная форма гипопластической анемии с угнетением образования только эритроцитов.
Апластическая анемия (АА) является относительно редким заболеванием. Она встречается с частотой примерно 0,5 на 100 000 населения. По мере увеличения возраста от 1 года до 20 лет число случаев болезни увеличивается; различий в частоте заболевания в период от 20 до 60 лет не выявлено, однако после 60 лет число больных возрастает. В некоторых семьях существует генетическая предрасположенность к болезни.
Этиология.К резкому угнетению костномозгового кроветворения приводят различные причины:
• внешние факторы, оказывающие миелотоксическое действие (иони
зирующая радиация, цитостатические препараты, различные хими
ческие вещества, лекарственные средства);
• внутренние причины (эндогенные): влияние токсичных веществ
при уремии, гипотиреозе и др.;
• идиопатические формы, когда не удается выявить никаких причин
развития анемии (у 50 % больных).
Патогенез.Механизм развития гипоплазии (аплазии) костного мозга окончательно не выяснен. Предполагают несколько механизмов развития АА: 1) поражение полипотентной стволовой клетки костного мозга; 2) подавление кроветворения, связанное с воздействием иммунных механизмов (клеточных, гуморальных); 3) нарушения в функционировании элементов «микроокружения»; 4) дефицит факторов, стимулирующих кроветворение.
Содержание веществ, непосредственно участвующих в процессе кроветворения (железо, витамин Bi2, протопорфирин), не снижено, но они не могут быть использованы кроветворной тканью.
Клиническая картинаболезни чрезвычайно разнообразна и связана в основном с цитопенией и зависит от степени ее выраженности. Соответственно этому проявления болезни чрезвычайно разнообразны: существуют переходные формы от частичного угнетения кроветворения до выраженной аплазии костного мозга.
Можно выделить три основных синдрома: цитопенический, септико-некротический и геморрагический. Их различная выраженность обусловливает пестроту данных, получаемых на различных этапах диагностического поиска.
На I этапе диагностического поиска выявляют такие неспецифические признаки, как повышенная утомляемость, слабость. Часто больные адаптируются к анемии и обращаются к врачу лишь при развернутой картине болезни. Геморрагический синдром проявляется различными кровотечениями (носовыми, маточными), развитием кровоподтеков.
На II этапе в начальных стадиях болезни, а также при хроническом течении выявляется лишь умеренная бледность кожных покровов и видимых слизистых оболочек, иногда кровоподтеки. При остром течении, кроме выраженной бледности, отмечаются значительный геморрагический синдром, некрозы слизистых оболочек, высокая лихорадка. Различные воспалительные заболевания (пневмония) проявляются характерными симптомами. Печень и селезенка обычно не увеличены, но при обнаружении антител к эритроцитам (аутоиммунная форма болезни) могут определяться умеренная спленомегалия, а также легкая желтушность кожи и склер вследствие наличия гемолитического компонента.
Основным в выявлении заболевания является III э т а п. В периферической крови определяется выраженная анемия, обычно нормохромная. Содержание гемоглобина снижается до 20 — 30 г/л. Содержание ретику-лоцитов снижено, что свидетельствует о гипорегенераторном состоянии костного мозга. Характерны выраженные лейкопения, гранулоцитопения. Содержание лимфоцитов не изменено. Число тромбоцитов снижается иногда до нуля. В большинстве случаев значительно увеличивается СОЭ (до 30-50 мм/ч).
В костном мозге уменьшено содержание миелокариоцитов, увеличено число лимфоцитов, тучных и плазматических клеток. Мегакариоциты могут полностью отсутствовать. При гистологическом исследовании костного мозга обращает внимание почти полное исчезновение костномозговых элементов и замещение их жировой тканью.
Содержание железа сыворотки у большинства больных увеличено, насыщение трансферрина железом практически 100 %.
Диагностика.Распознавание болезни основывается на данных цитологического исследования периферической крови и цитоморфологическо-го исследования костного мозга. При подозрении на АА обязательно выполнение трепанобиопсии. Необходимо провести дифференциальную диагностику с рядом заболеваний, протекающих с цитопенией: дебютом острого лейкоза, метастазами рака в костный мозг, костномозговой формой хронического лимфолейкоза. Панцитопения у пожилых людей может быть также проявлением В^-дефицитной анемии (однако при этом в костном мозге обнаруживаются мегалобласты, при патоморфологическом изу-
чении трепаната выявляется гиперплазия костного мозга в противоположность аплазии при АА). Следует подчеркнуть, что диагноз АА является «диагнозом исключения» и устанавливается лишь в случае, если перечисленные причины развития аплазии полностью исключены.
Течение.Согласно международным критериям, принято выделять две основные формы АА. Критериями тяжелой формы являются: содержание нейтрофилов в периферической крови менее 0,5109/л, тромбоцитов — менее 20109/л, ретикулоцитов — менее 10 %о; при исследовании костного мозга отмечается выраженное снижение клеточности или умеренная гипоплазия с количеством гемопоэтических клеток менее 30 %. Если показатели периферической крови соответствуют хотя бы двум критериям, а результаты исследования костного мозга — одному, то можно поставить диагноз тяжелой формы АА. При нетяжелой форме болезни прогноз намного лучше (все перечисленные показатели изменены существенно меньше).
Формулировка развернутого клинического диагнозаапластической (гипопластической) анемии учитывает следующие компоненты: 1) анемии (в данном случае апластической); 2) характер течения (острый, под-острый, хронический); 3) наиболее выраженные синдромы (геморрагический, септико-некротический) и 4) осложнения.
ЛечениеАА — непростая задача, она должна включать:
• ликвидацию (или хотя бы ограничение) контакта больного с лица
ми, страдающими инфекционными заболеваниями (в том числе и
неспецифическими );
• устранение воздействия этиологического фактора (например, ле
карственных или химических средств, если доказана связь между
их приемом и развитием болезни);
• трансфузионную терапию;
• спленэктомию;
• введение антилимфоцитарного глобулина;
• трансплантацию костного мозга.
Объем перечисленных мероприятий несколько различен при разном течении болезни, однако проведение части из них обязательно для всех больных.
Больного АА, особенно при содержании гранулоцитов менее 0,5-109/л, изолируют в специально выделенную палату с боксом (где медицинский персонал меняет обувь и одежду); кожа больного обрабатывается антисептическим мылом, обязательна санация ротовой полости. Для ликвидации кишечной флоры назначают неадсорбируемые антибиотики. Для уменьшения менструальных кровопотерь на длительный срок рекомендуются препараты, уменьшающие кровопотерю или полностью прекращающие менструации (гормональные комбинированные средства).
При глубокой анемии переливают эритроцитную массу или отмытые эритроциты. При количестве тромбоцитов 20-109/л или при наличии геморрагического синдрома осуществляют трансфузии тромбоцитной массы.
При нетяжелой форме эффективна спленэктомия (селезенка является органом, в котором образуются антитела, участвующие в цитотоксических реакциях). Эффект спленэктомии проявляется не сразу.
При тяжелой форме АА эффективен антилимфоцитарный (антимоно-цитарный) глобулин; препарат вводят внутривенно в течение 5 — 8 дней.
Пятилетняя выживаемость после лечения глобулином составляет 50 — 70 %. Антилимфоцитарный глобулин сочетают с циклоспорином А (сан-диммуном), представляющим собой препарат, воздействующий на функцию лимфоцитов путем подавления образования и секреции лимфокинов (возможно, иммуносупрессорный эффект циклоспорина А обусловливает подавление продукции антител против клеток костного мозга и периферической крови). Циклоспорин А назначают внутривенно, а затем внутрь.
При тяжелой форме АА показана трансплантация костного мозга от HLA-совместимого донора; показания к трансплантации ограничиваются возрастом (не старше 40 лет).
Прогноз.При нетяжелой форме А А прогноз более благоприятен. Применение спленэктомии и антилимфоцитарного глобулина обусловливают 5-летнюю выживаемость около 80 % больных. При тяжелой форме болезни прогноз значительно хуже — в течение 6 мес умирают 50 % больных; год прожить могут лишь 20 %.
Профилактика.Исключают контакт с различными внешними факторами (ионизирующая радиация, бензол, цитостатические средства). Меры первичной профилактики идиопатической формы аплазии костного мозга неизвестны.
Источник