Анемия вследствие кровопотери этиология патогенез
Различают острую и хроническую
постгеморрагическую анемии.
Острая постгеморрагическая анемия
Возникает в результате острой массивной
потери крови в объеме от 5 мл/кг массы
тела и выше (травма, хирургическое
вмешательство, желудочные, маточные,
кишечные кровотечения, разрыв фаллопиевых
труб, нарушение гемостаза и др.). Сразу
после потери крови вследствие уменьшения
ее массы появляется общеанемические
признаки — тахикардия, одышка, бледность
кожных покровов и слизистых оболочек,
падение АД. Содержание эритроцитов и
гемоглобина снижается равномерно
(нормоцитемическая гиповолемия),
развивается нормохромная анемия.
Изменения периферической крови носят
стадийный характер. На 2–3-е сутки после
кровотечения в кровь поступает тканевая
жидкость, масса ее восстанавливается
(гидремическая фаза), а количество
эритроцитов и гемоглобина снижается,
падает гематокрит, но в связи с выходом
эритроцитов из депо цветовой показатель
сохраняется в норме (нормохромная
анемия), развивается лейкопения (утрата
лейкоцитов во время кровотечения,
гемодиллюция), тромбоцитопения (утрата
тромбоцитов при потере крови, потребление
при образовании тромба). Наблюдается
умеренный анизоцитоз и пойкилоцитоз
эритроцитов. Возникшая гипоксия ведет
к повышению уровня эритропоэтина и на
4–5-е сутки после кровотечения активируется
функция костного мозга (костномозговая
фаза компенсации) появляются регенеративные
формы эритроцитов — полихроматофилы,
единичные нормобласты (полихроматофильные,
оксифильные), ретикулоцитоз. Анемия
приобретает гипохромный характер, т.
к. ускоренная регенерация опережает
созревание эритроцитов из-за возникшего
дефицита железа. Развивается нейтрофильный
лейкоцитоз со сдвигом влево по
регенеративному типу.
Данные нарушения обусловлены уменьшением
объема циркулирующей крови и гипоксией.
В ответ на кровопотерю включаются
механизмы компенсации, направленные
на восстановление утерянного объема
крови и на борьбу с анемическим состоянием
(гипоксией).
Хроническая постгеморрагическая анемия
Развивается в результате длительно
повторяющихся небольших кровотечений.
Является вариантом железодефицитных
анемий, патогенез и проявления обусловлены
нарастающим дефицитом железа.
Железодефицитная анемия
Железо — один из важнейших микроэлементов,
входящих в состав организма человека.
Взрослому человеку требуется 15–18 мг/сут
железа, из которых всасывается 2–2,5 мг.
При этом биодоступность содержащегося
в пище гемового железа существенно
выше, чем негемового. Основные депо
железа: печень (гепатоциты и макрофаги),
костный мозг, селезёнка, мышцы. Если
метаболизм железа нормален, 30–40 %
нормобластов костного мозга содержат
гранулы ферритина (сидеробласты).
Отсутствие сидеробластов характерно
для железодефицита. Избыток гранул в
сидеробласте служит признаком переполнения
организма железом (гемосидероз) или
неспособности утилизировать его
(сидеробластная анемия). На рис. 2
представлена схема метаболизма железа.
Дефицит железа в организме существует
в двух формах, представляющих собой две
последовательные стадии одного процесса:
латентный (тканевый) дефицит железа
(ЛДЖ) и собственно железодефицитная
анемия (ЖДА).
ЖДА составляет около 80–90 % всех случаев
анемий и является одной из самых
распространенных ее форм. Женщины
страдают данным заболеванием чаще, чем
мужчины, поскольку запасы железа у
последних значительно превышают (на
100–200 %) таковые у женщин. Явный и скрытый
дефицит железа отмечается почти у 60 %
женщин земного шара. Железодефицитные
анемии встречаются во всех возрастных
группах. Различают «истинные» ЖДА —
при абсолютном дефиците железа и «ложные»
— при нарушении включения железа в
гемм, в отсутствие первичного истинного
железодефицита.
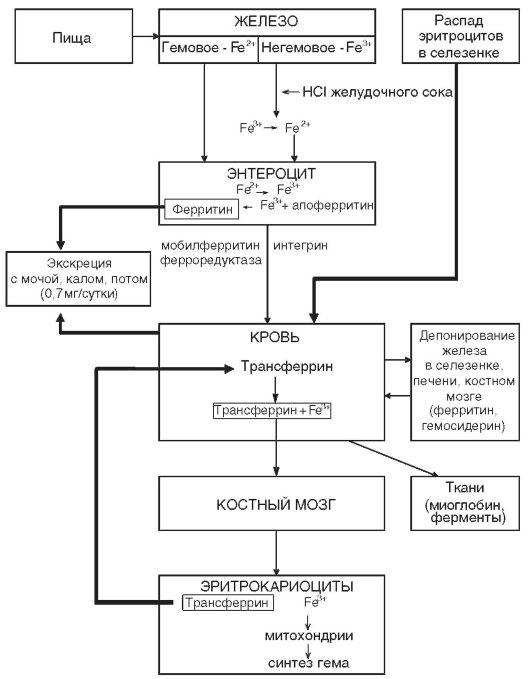
Рисунок 2 – Схема метаболизма
железа в организме
Этиология
По патогенетическому принципу с учетом
основных этиологических причин
железодефицитные анемии делят на пять
основных подгрупп (Л.И. Идельсон): 1)
связанные с повышенной потерей железа;
2) связанные с недостаточным исходным
уровнем железа; 3) связанные с повышенным
расходованием железа; 4) связанные с
нарушением всасывания железа и
недостаточным поступлением его с пищей
(алиментарные); 5) связанные с нарушением
транспорта железа.
Таблица 3.Причины и механизмы
развития железодефицитных состояний
Группы | Характеристика | Патогенез |
Особенные периоды | Дети недоношенные Дети первых лет | Недостаточный |
Интенсивный рост Беременность Лактация | Повышенное | |
Патологические | Хроническая При При Из Из При Припатологии | Повышенная потеря |
Патологические | Патология ЖКТ: Резекция желудка Гипосекреция Хронический Дисбактериозы; Глистные инвазии | Нарушение |
Наследственная Приобретённая | Нарушение | |
Алкоголизм | Комбинация Недостаточное | |
Нарушение | Нерациональное Голодание; Вегетарианская Искусственное | Недостаточное |
Избыточные | Повышенное |
Нередко действуют комбинации указанных
факторов, вызывающих отрицательный
баланс железа. Примером ЖДА, развивающейся
вследствие комплексного влияния
нескольких факторов, является хлороз
(от греч. «хлорос» — бледно-зеленый, или
«бледная немочь»). Название связано со
специфическим цветом лица таких больных.
При ЖДА уменьшается содержание железа
в плазме крови, костном мозге и в тканевых
депо.
Патогенез.
Основным звеном патогенеза заболевания
является снижение содержания железа в
депо, сыворотке крови и костном мозгу.
В результате нарушается синтез
гемоглобина, возникают гипохромная
анемия и трофические расстройства в
тканях, признаками которых являются:
сухость и вялость кожи, ломкость ногтей,
выпадение волос, атрофия слизистой
оболочки языка, повышенное разрушение
зубов, дисфагия, извращение вкуса,
мышечная слабость и др.. В патогенезе
клинических проявлений болезни имеет
значение: нарушение активности
железосодержащих ферментов в тканях
организма (цитохром С, цитохромоксидаза,
сукцинатдегидрогеназа, пероксидаза,
митохондриальная моноаминооксидаза,
α-глицерофосфатоксидаза) и недостаточное
снабжение тканей кислородом. Признаки
гипоксии тканей появляются лишь при
значительной выраженности малокровия,
когда наступает истощение компенсаторных
механизмов, обеспечивающих на ранних
этапах развития дефицита железа
нормализацию отдачи кислорода из
гемоглобина тканям.
Клиническая картинаскладывается
из двух основных синдромов: общеанемического
и сидеропенического.
Общеанемический синдром проявляется
симптомами, характерными для всех видов
анемии: бледность, общая слабость,
быстрая утомляемость, обмороки, одышка,
тахикардия, систолический шум.Сидеропенический синдром характеризуется
рядом трофических нарушений. Отмечаются:
сухость и трещины кожи, преждевременные
морщины, ломкость ногтей, койлонихия
(катлонихия) — ложкообразные ногти,
ангулярный стоматит, атрофия слизистых
оболочек рта, пищевода, желудка,
дыхательных путей. Нарушается иммунитет,
что приводит к хронизации инфекций,
частым ОРЗ; развивается мышечная
слабость, слабость физиологических
сфинктеров. Может возникнуть извращение
вкуса (поедание несъедобных продуктов
— мела, бумаги и др.), пристрастие к
необычным запахам (ацетон, бензин,
краска). Нарушается память, концентрация
внимания. При дефиците железа резко
усиливается абсорбция свинца, и у детей
на этом фоне развивается необратимая
задержка интеллектуального развития.
Нарушение проницаемости мелких сосудов
ведет к отекам лица. Иногда возникает
«сидеропенический субфебрилитет».
Картина крови.Основным признаком
железодефицитной анемии является
гипохромия со снижением цветового
показателя ниже 0,8 и, соответственно,
уменьшением содержания гемоглобина
ниже 110 г/л. Количество эритроцитов, как
правило, остается на исходном уровне,
но в ряде случаев может оказаться
сниженным до 2,0-1,5×1012/л вследствие
нарушения процессов пролиферации клеток
эритроидного ряда в костном мозгу и
усиления неэффективного эритропоэза
(в норме разрушение эритронормобластов
в костном мозгу не превышает 10-15%).
Ретикулоциты в норме или незначительно
увеличены, при прогрессировании ЖДА их
количество снижается. Важным морфологическим
признаком железодефицитных анемий
является анизоцитоз эритроцитов с
преобладанием микроцитов.
Нередко развивается нейтропения (в
результате уменьшения содержания
железосодержащих ферментов в лейкоцитах).
СОЭ в норме или незначительно увеличена.
Уровень тромбоцитов может быть
незначительно повышен (на фоне
кровотечений).
Исследование костного мозга.В КМ
определяется нормобластическая
гиперплазия с нарушением гемоглобинизации
(преобладание базофильных и
полихроматофильных нормобластов при
снижении оксифильных), снижение индекса
созревания нормобластов, снижение
количества сидеробластов вплоть до
полного их отсутствия. Миелоидный и
мегакариоцитарный ростки не изменены.
Биохимический анализ крови – основной
диагностический критерий при ЖДА,
включающий набор тестов, при помощи
которых подтверждается факт дефицита
железа в организме:
снижение уровня сывороточного железа,
снижение уровня сывороточного ферритина,
снижение степени насыщения трансферрина
железом,увеличение содержания трансферрина в
сыворотке,повышение общей и латентной
железосвязывающей способности сыворотки,увеличение содержания растворимых
рецепторов к трансферритину в сыворотке,повышение свободного протопорфирина
IX в эритроцитах.
Количество железа в сыворотке крови
при выраженной ЖДА падает до 5,4–1,8
мкмоль/л при норме 12,5–30,4 мкмоль/л
(мужчины; у женщин этот показатель на
10–15% ниже. Под общей железосвязывающей
способностью сыворотки понимается
количество железа, которое может
связаться с трансферрином (в норме
54,0–72,0 мкмоль/л). В норме одна треть
трансферрина насыщена железом, а две
трети — свободны. Об уровне депонированного
железа можно судить по содержанию железа
в суточной моче после однократного
введения больному 500 мг десферала
(продукт метаболизма актиномицетов,
избирательно выводящий ион железа из
организма). В норме этот показатель
соответствует 0,6–1,3 мг железа, а при
железодефицитной анемии снижается до
0,2 мг в сутки и менее.
Сывороточный ферритин— очень точный
индикатор резервных запасов железа. Он
содержит примерно 15-20% общего запаса
железа в организме взрослого человека.
Определяется почти во всех тканях,
особенно высока его концентрация и
синтетическая способность в печени,
селезенке и костном мозге. Белок в
свободном от железа виде называется
апоферритином. Ферритин состоит из
белковой оболочки, которая окружает
ядро трехвалентного железа в виде
комплексов окиси и фосфата железа.
Каждая молекула апоферритина может
сорбировать до 5000 атомов железа, однако
большинство молекул ферритина содержат
от 1000 до 3000 атомов железа.
Анемии, ассоциированные с заболеваниями
внутренних органов, включают анемии
при эндокринных заболеваниях, заболеваниях
печени и почек.
К числу анемий при эндокринных
заболеванияхотносятся анемии при
заболеваниях щитовидной и паращитовидных
желез, надпочечников, половых желез,
гипопитуитаризме и др., в основе патогенеза
которых лежит депрессия эритропоэза
при дефиците или, напротив, гиперсекреции
ряда гормонов. В частности, такие гормоны,
как тироксин, кортизол, тестостерон в
очень высоких концентрациях вызывают
угнетение пролиферативной активности
эритроидных прекурсоров. В случае
сгущения крови в результате дегидратации
(при надпочечниковой недостаточности,
гипотиреозе) диагностика анемии может
быть затруднена.
К анемиям при заболеваниях печени
относятся анемии, возникающие при
диффузных поражениях органа (циррозе,
хроническом гепатите, гемохроматозе и
др.).
Патогенез анемии при заболеваниях
печени отличается многообразием
патогенетических факторов, что
определяется особенностями патогенеза
основного заболевания. Выделяют следующие
механизмы развития анемии:
угнетение процессов кроветворения в
костном мозгу вследствие прямого
токсического влияния на клетки-предшественницы
гемопоэза алкоголя (при алкогольном
поражении печени) и эндогенных токсинов
(при нарушениях обезвреживающей и
клиренсной функции печени), при нарушениях
метаболизма железа и депонирования
витамина В12и фолиевой кислоты
в пораженной печени;укорочение продолжительности жизни
эритроцитов в результате прямого
повреждающего действия токсических
продуктов экзогенного (алкоголь) и
эндогенного (при эндотоксемии)
происхождения, гиперспленизма, при
нарушениях внутриклеточного метаболизма
эритроцитов (например, в связи с дефицитом
в клетках НАДФ+) и их способности
к деформации (вследствие патологии
клеточной мембраны при изменениях
фракционного состава фосфолипидов,
снижении содержания сиаловых кислот);кровотечения из расширенных вен
желудочно-кишечного тракта (при циррозе
печени), носовые, геморроидальные и
иной локализации (при формирующейся
недостаточности синтеза факторов
свертывания крови вследствие нарушений
белкового обмена).
В подавляющем большинстве случаев при
заболеваниях печени регистрируется
нормохромная нормоцитарная анемия, при
присоединяющемся дефиците железа —
микроцитарная нормоили гипохромная,
при недостаточности витамина В12и фолиевой кислоты, метастазах рака
желудка в печень — макроцитарная анемия
нормо- или гиперхромного типа.
Анемии при заболеваниях почекмогут
выявляться у больных острым
гломерулонефритом, интерстициальным
нефритом, хронической почечной
недостаточностью. Патогенез анемии при
заболеваниях почек определяется
снижением продукции эритропоэтина
клетками юкстагломерулярного аппарата,
депрессией кроветворения в костном
мозгу (в результате нарушения
пролиферативной активности эритроидных
клеток, торможения процессов синтеза
гема) и сокращением срока жизни эритроцитов
(до 40-50 дней) при действии токсических
продуктов азотистого обмена.
Контрольные вопросы по теме:
Охарактеризуйте типовые формы изменений
общего объема циркулирующей крови.Какова этиология олигоцитемических и
полицитемических гиповолемий?Какова этиология олигоцитемических и
полицитемических гиперволемий?Укажите общие механизмы формирования
компенсаторно-приспособительных
механизмов при кровопотере.Каков механизм формирования экстренных
защитно-приспособительных реакций
организма при кровопотерях?Каков механизм формирования долговременных
защитно-приспособительных реакций
организма при кровопотерях?Дайте определение понятию анемия,
каковы принципы классификации?Назовите основные фонды железа в
организме?Перечислите лабораторные показатели,
характеризующие состояние красной
крови при острой кровопотере?Перечислите лабораторные показатели,
характеризующие состояние красной
крови при хронической кровопотере?Какие Вы знаете анемии, ассоциированные
с заболеваниями внутренних органов,
какие особенности для них характерны?
Темы реферативных сообщений:
Этиологи и патогенез ювенильного
хлороза (у девочек в пубертатный период)
при ЖДА
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
—
группа заболеваний и состояний,
характеризующихся уменьшением общего
количества гемоглобина. Уменьшение
содержания в единице объема крови.
При
анемии в периферической крови нередко
появляются эритроциты различной величины
(пойкилоцитоз), формы (анизоцитоз), разной
степени окраски (гипохромия, гиперхромия);
в эритроцитах иногда обнаруживаются
включения — базофильные зерна (так
называемые тельца Жолли), базофильные
кольца (так называемые кольца Кабо) и
т. Д.
На
основании пунктата грудины можно судить
о состоянии (гипер или гипорегенерация)
и типе эритропоэза (эритробластический,
нормобластический и мегалобластический).
Этиология
и патогенез.
Причинами развития анемии могут быть
кровопотеря, недостаточная эритропоэтическая
функция костного мозга( зависит от
дефицита необходимых для нормального
кроветворения веществ- железа, витамина
б12, фолиевой ксилоты), повышенное
кроворазрушение.
Классификация.
В зависимости от этиологии и главным
образом патогенеза различают три
основные группы анемий:
вследствие
кровопотери (постгеморрагические
анемии);
вследствие
нарушенного кровообразования;
вследствие
повышенного кроворазрушения (гемолитические
анемии).
В
каждой группе выделяются формы анемии.
По характеру течения анемии делят на
острые и хронические. В соответствии с
морфологическим и функциональным
состоянием костного мозга, отражающим
его регенераторные возможности, анемия
может быть регенераторной, гипорегенераторной,
гипопластической(гипорегенраторной),
апластической(арегенераторной),
диспластической.
51. Постгеморрагические анемии. Причины, морфологическая характеристика.
Анемии
вследствие кровопотери могут иметь
острое или хроническое течение.
Острая
постгеморрагическая анемия
наблюдается после массивных кровотечений
из сосудов желудка при язвенной болезни,
из язвы тонкой кишки при брюшном тифе,
при разрыве маточной трубы в случае
внематочной беременности, разъедании
ветви легочной артерии при туберкулезе
легких, разрыве аневризмы аорты или
ранении ее стенки и отходящих от аорты
крупных ветвей.
Чем
крупнее калибр пораженного сосуда и
чем ближе к сердцу он расположен, тем
опаснее для жизни кровотечение. При
кровотечениях из сосудов мелкого калибра
смерть обычно наступает при потере
более половины общего количества крови.
В таких случаях постгеморрагической
анемии отмечается бледность кожных
покровов и внутренних органов; посмертные
гипостазы выражены слабо.
Патологическая
анатомия.
Если кровотечение оказалось не
смертельным, то кровопотеря возмещается
благодаря регенераторным процессам в
костном мозге. Клетки костного мозга
плоских и эпифизов трубчатых костей
усиленно пролиферируют, костный мозг
становится сочным и ярким. Жировой
(желтый) костный мозг трубчатых костей
также становится красным, богатым
клетками эритропоэтического и миелоидного
ряда. Появляются очаги внекостномозгового
кроветворения в селезенке, лимфатических
узлах, тимусе и тд.
Хроническая
постгеморрагическая анемия
развивается в тех случаях, когда
происходит медленная, но длительная
потеря крови. Это наблюдается при
небольших кровотечениях из распадающейся
опухоли желудочно-кишечного тракта,
кровоточащей язвы желудка, геморроидальных
вен кишечника, из полости матки, при
геморрагическом синдроме, гемофилии.
Патологическая
анатомия.
Кожные покровы и внутренние органы
бледны. Костный мозг плоских костей
обычного вида; в костном мозге трубчатых
костей наблюдаются выраженные в той
или иной степени явления регенерации
и превращения жирового костного мозга
в красный. Нередко отмечаются множественные
очаги внекостномозгового кроветворения.
В связи с хронической кровопотерей
возникает гипоксия тканей и органов,
которая обуславливает развитие жировой
дистрофии миокарда, печени, почек.
Появляются множественные точечные
кровоизлияния в серозных и слизистых
оболочках, во внутренних органах.
52.
Анемии
вследствие нарушения кровообразования.
Классификация, причины, механизмы
развития, морфологическая характеристика.
Представлены
дефицитными анемиями, возникающими при
недостатке железа, витамина В12, фолиевой
кислоты, гипо- и апластическими анемиями.
1)Анемии
вследствие недостатка железа или
железодефицитные анемии.
Они могут развиваться прежде всего при
недостаточном поступлении железа с
пищей (алиментарная железодефицитная
анемия детского возраста). Они возникают
также при экзогенной недостаточности
железа в связи с повышенными запросами
организма у беременных и кормящих
женщин, при инфекционных заболеваниях.
Также вследствие резорбционной
недостаточности при заболлеваниях ЖКТ
и после резекции желудка или кишечника.
Анемии вследствие недостатка железа —
гипохромные.
2)Анемия
вследствие недостатка витамина B 12 и/или
фолиевой кислоты.
Их характеризует извращение эритропоэза.
Это мегалобластические гиперхромные
анемии. Витамин B 12 и фолиевая кислота
являются необходимыми факторами
гемопоэза.

3)Для
эндогенных гипо- и апластических
анемий наиболее характерно поражение
эритробластического ростка крови
(эритрона) с потерей способности костного
мозга к регенерации. Происходит гибель
активного костного мозга плоских и
трубчатых костей, он замещается желтым,
жировым. Среди
эндогенных фаткоров- наследственные с
развитием семейной апластической анемии
(фанкони) и гипопластической анемии
(эрлиха). В
качестве экзогенных факторов, ведущих
к развитию гипопластических и апластических
анемий, могут выступать радиация,
токсические вещества,некоторые
лек.препараты. При экзогенных полнгого
подавления гемопоэза не происходит,
отмечается угнетение регенераторной
способности костного мозга. Также такие
анемии возникают при замещении костного
мозга лейкозными клетками, метастазами
злокачественной опухоли, рака или
костной тканью.
53.Железодефицитные
анемии .Причины.Морфологические
проявления.
Вызванна
недостатком железа в организме.
Гипохромная анемия.
Причины:
1)Повторные
или длительные кровотечения
2)алиментарная
недостаточность железа(при кормлении
искусств молоком)
3)повышен расход
железа период роста,беременности,при
нарушении всасывания,приинфекциях,нарушениедепонрирования
железа(при гепатите,циррозе)
Следствие:
-атрофические и дистрофические процессы
в тканях и в органах,особенно в пищевом
канале(глоссит,гингивит,кариес зубов)
и в сердце.
-исчезновение гемосидерина
в макрофагоцитах печени и селезенки,снижение
кол-ва сидеробластов и сидероцитов в
костном мозге. Это приводит к уменьшению
транспорта железа в костный
мозг.
-продолжительность жизни
эритроцитов уменьшается.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник