Анемия с аутоиммунным гепатитом
Иммунолог Надежда Кнауэро патогенезе, клинике и лечении иммунного поражения печени
Аутоиммунный гепатит (АИГ) — это хроническое воспалительное заболевание печени, характеризующееся утратой иммунологической толерантности организма к тканевым антигенам [1, 2].
Впервые сведения о тяжелом поражении печени с выраженной желтухой и гиперпротеинемией появились в 30–40‑х гг. XX века. В 1950 г. шведский врач Ян Вальденстрем (Jan Waldenström) наблюдал у 6 молодых женщин хронический гепатит с желтухой, телеангиоэктазиями, повышением СОЭ, гипергаммаглобулинемией. Гепатит хорошо отвечал на лечение кортикотропином [3]. Из-за сходства лабораторных изменений с картиной системной красной волчанки (наличие антинуклеарных антител в сыворотке, положительные результаты LE-теста) одним из названий патологии стал «люпоидный гепатит».
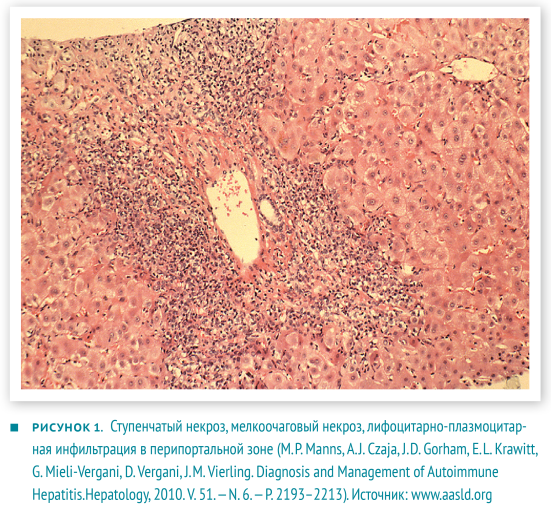
В настоящее время аутоиммунный гепатит определяют как хронический, преимущественно перипортальный гепатит с лимфоцитарно-плазмоцитарной инфильтрацией и ступенчатыми некрозами (рис. 1). Характерные проявления: гипергаммаглобулинемия, появление аутоантител в крови.
Классификация
В зависимости от вида аутоантител выделяют три типа заболевания:
- АИГ 1 типа встречается наиболее часто и характеризуется появлением в крови антинуклеарных антител (АНА, antinuclear antibodies, ANA) и/или антител к гладким мышцам (АГМА, smooth muscle antibodies, SMA).
- При АИГ 2 типа образуются аутоантитела к микросомальным антигенам печени и почек (anti-liver kidney microsomal type-1 antibodies, anti-LKM-1).
- АИГ 3 типа связан с образованием аутоантител к растворимому печеночному антигену, ткани печени и поджелудочной железы (anti-soluble liver antigen/liver-pancreas antibodies, anti-SLA/LP).
Некоторые авторы объединяют АИГ 1 и АИГ 3 в силу сходства клинико-эпидемиологических особенностей [4].Существуют также перекрестные формы (overlap syndrome) различных аутоиммунных патологий печени, включающие в себя АИГ: АИГ+ПБЦ (первичный билиарный цирроз), АИГ+ПСХ (первичный склерозирующий холангит). Пока не вполне ясно, следует ли считать эти заболевания параллельно текущими самостоятельными нозологиями или частями непрерывного патологического процесса.
В качестве отдельной нозологии рассматривается АИГ, развившийся de novo после трансплантации печени, выполненной по поводу печеночной недостаточности, связанной с другими заболеваниями [1, 5].
Аутоиммунный гепатит встречается повсеместно. Распространенность АИГ в европейских странах — около 170 случаев на 1 млн населения. При этом до 80 % всех случаев составляет АИГ 1 типа. АИГ 2 типа распространен неравномерно — до 4 % в США и до 20 % в Европе.
Болеют преимущественно женщины (соотношение полов среди пациентов в странах Европы составляет 3–4:1). Возраст заболевших — от 1 года до 80 лет, средний возраст — около 40 лет [6].
Этиопатогенез
Этиология АИГ неизвестна, однако считается, что на развитие заболевания влияют как генетические факторы, так и факторы окружения.
Важным звеном патогенеза могут быть определенные аллели генов HLA II (человеческий лейкоцитарный антиген типа II, Human leucocyte antigen II) и генов, связанных с регуляцией деятельности иммунной системы [7, 8].
Отдельно стоит сказать об АИГ, входящем в клиническую картину аутоиммунного полиэндокринного синдрома (autoimmune polyendocrine syndrome, autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy, APECED). Это моногенное заболевание с аутосомно-рецессивным наследованием, связанное с мутацией в гене AIRE1. Таким образом, в данном случае генетическая детерминированность является доказанным фактом [4, 9].
Аутоиммунный процесс при АИГ представляет собой Т-клеточный иммунный ответ, сопровождающийся образованием антител к аутоантигенам и воспалительным повреждением тканей.
Факторы патогенеза АИГ:
- провоспалительные факторы (цитокины), продуцируемые клетками в ходе иммунного ответа. Косвенным подтверждением может служить то, что аутоиммунные заболевания часто бывают сопряжены с бактериальными или вирусными инфекциями;
- угнетение активности регуляторных Т-клеток, играющих важнейшую роль в поддержании толерантности к аутоантигенам;
- нарушение регуляции апоптоза, в норме — механизма, контролирующего иммунный ответ и его «правильность»;
- молекулярная мимикрия — явление, когда иммунный ответ против внешних патогенов может затрагивать и структурно схожие с ними собственные компоненты. Важную роль в этом могут играть вирусные агенты. Так, в нескольких исследованиях было показано наличие пула циркулирующих аутоантител (ANA, SMA, anti-LKM-1) у пациентов, страдающих вирусными гепатитами В и С [2,4];
- фактор токсического лекарственного воздействия на печень. Некоторые исследователи связывают манифестацию АИГ с употреблением противогрибковых препаратов, нестероидных противовоспалительных средств.
Клиника
Примерно у четверти больных АИГ начинается остро, описаны даже редкие случаи развития острой печеночной недостаточности. Острый гепатит с желтухой чаще встречается у детей и молодых людей, у этой же группы чаще отмечается фульминантное течение заболевания [6].
Следует отметить, что у некоторых пациентов с явлениями острого АИГ в отсутствие лечения может наблюдаться спонтанное улучшение состояния и нормализация лабораторных показателей. Однако через несколько месяцев обычно наступает повторный эпизод АИГ. Гистологически также определяется персистирующий воспалительный процесс в печени [6].
Чаще клиника АИГ соответствует клинике хронического гепатита и включает в себя такие симптомы, как астения, тошнота, рвота, боли или дискомфорт в правом верхнем квадранте живота, желтуха, порой сопровождающаяся кожным зудом, артралгии, реже — пальмарная эритема, телеангиэктазии, гепатомегалия [2, 6]. При развившемся циррозе печени могут превалировать симптомы портальной гипертензии, явления энцефалопатии.
АИГ может быть сопряжен с аутоиммунными заболеваниями различных профилей:
- гематологического (тромбоцитопеническая пурпура, аутоиммунная гемолитическая анемия);
- гастроэнтерологического (воспалительные заболевания кишечника);
- ревматологического (ревматоидный артрит, синдром Шегрена, системная склеродермия);
- эндокринного (аутоиммунный тиреоидит, сахарный диабет);
и других профилей (узловая эритема, пролиферативный гломерулонефрит) [1, 2].
Диагностика АИГ
Диагностика аутоиммунного гепатита основывается на:
- результатах исследований: клинического, серологического и иммунологического;
- исключении других заболеваний печени, протекающих с аутоиммунным компонентом или без оного (хронический вирусный гепатит, токсический гепатит, неалкогольный стеатоз, болезнь Вильсона, гемохроматоз, а также криптогенный гепатит).
АИГ 1 и 3 типа схожи по демографическим характеристикам заболевших, профилю HLA, активности воспалительного процесса и ответу на терапию. Существенные отличия имеет АИГ 2 типа, поражающий чаще детей и подростков и обычно имеющий острое начало и более тяжелое течение.
Необходимо помнить о вероятном АИГ у пациентов с повышением уровня печеночных ферментов, а также у пациентов с циррозом печени. При наличии признаков холестаза в круг патологий для проведения дифференциального диагноза следует включить первичный билиарный цирроз и первичный склерозирующий холангит.
Клинический поиск включает в себя определение таких лабораторных показателей, как активность аланинаминотрансферазы и аспартатаминотрансферазы (АЛТ и АСТ), щелочной фосфатазы (ЩФ), уровень альбумина, гамма-глобулина, IgG, билирубина (связанного и несвязанного). Необходимо также определение уровня аутоантител в сыворотке крови и получение данных гистологического исследования [9].
Для больных, у которых в течение 4 лет не удалось достичь ремиссии и приостановить развитие цирроза, метод выбора — трансплантация печени. 10‑летняя выживаемость у пациентов, перенесших эту операцию, достаточно высока (75–85 %), однако и доля рецидивов достигает 11–41 %. Сохранение аутоантител в крови не является признаком рецидива АИГ и не позволяет предсказать его развитие.
Методы визуальной диагностики (УЗИ, КТ, МРТ) не имеют решающего вклада в диагностику АИГ, однако позволяют установить факт прогрессии АИГ и исход в цирроз печени, а также исключить наличие очаговой патологии.В целом диагностика базируется на 4 пунктах [10]:
- Гипергаммаглобулинемия — один из наиболее доступных тестов. Показательно повышение уровня IgG при нормальном уровне IgA и IgM. Однако существуют трудности при работе с пациентами с исходно низким уровнем IgG, а также с пациентами (5–10 %) с нормальным уровнем IgG при АИГ. В целом этот тест считается полезным при мониторинге активности заболевания на фоне лечения [6].
- Наличие аутоантител. При этом антитела типов ANA и SMA не являются специфическим признаком аутоиммунного гепатита, также как и антитела anti-LKM-1, встречающиеся у 1/3 детей и малой части взрослых, страдающих АИГ. Только антитела anti-SLA/LP специфичны для АИГ. Также у пациентов могут определяться антитела к двухцепочечной ДНК.
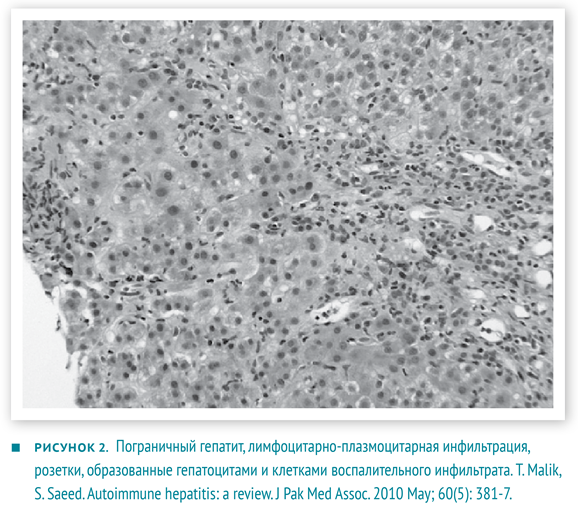
- Гистологические изменения, оцениваются в комплексе с предыдущими показателями. Не существует строго патогномоничных признаков АИГ, но многие изменения являются весьма типичными. Портальные поля инфильтрированы в разной степени Т-лимфоцитами и плазмоцитами. Воспалительные инфильтраты способны «отсекать» и разрушать отдельные гепатоциты, проникая в паренхиму печени, — данное явление описано как ступенчатый (мелкоочаговый некроз), пограничный гепатит (interface hepatitis). Внутри долек возникает баллонная дегенерация гепатоцитов с их отеком, образованием розеток и некрозом отдельных гепатоцитов — рис. 2. Для фульминантного течения часто характерны центролобулярные некрозы. Также могут наблюдаться мостовидные некрозы, соединяющие соседние перипортальные поля [2, 6].
- Отсутствие маркеров вирусного гепатита.
- Международной группой по исследованию АИГ разработана балльная система для оценки достоверности диагноза — табл. 1.
Лечение аутоиммунного гепатита
АИГ относится к заболеваниям, при которых лечение позволяет существенно повысить выживаемость больных.
Показаниями для начала лечения служат:
- повышение активности АСТ в сыворотке крови в 10 раз по сравнению с нормой или в 5 раз, но в сочетании с двукратным повышением уровня гамма-глобулина;
- наличие мостовидных или мультилобулярных некрозов при гистологическом исследовании;
- выраженная клиника — общие симптомы и симптомы поражения печени.
Менее выраженные отклонения в лабораторных показателях в сочетании с менее выраженной клиникой являются относительным показанием к лечению. При неактивном циррозе печени, наличии признаков портальной гипертензии в отсутствие признаков активного гепатита, при «мягком» гепатите со ступенчатыми некрозами и без клинических проявлений лечение не показано [1, 9].
Общая концепция терапии при АИГ предполагает достижение и поддержание ремиссии. Базовой является иммуносупрессивная терапия — глюкокортикостероиды (преднизолон) в качестве монотерапии или в сочетании с азатиоприном [2, 6, 9, 11]. Терапия продолжается до достижения ремиссии, причем важно достичь именно гистологически подтвержденной ремиссии, которая может отставать от нормализации лабораторных показателей на 6–12 мес. Лабораторная же ремиссия описывается как нормализация уровня АСТ, АЛТ, гамма-глобулина, IgG [2].
Поддерживающую терапию более низкими дозами иммуносупрессантов для снижения вероятности рецидива после достижения ремиссии проводят по крайней мере в течение 2 лет.
Кроме того, обсуждается возможность применения препаратов урсодезоксихолевой кислоты (УДХК)при аутоиммунном гепатите в качестве сопутствующей терапии или даже монотерапии [11]. АИГ у пациентов, получавших препараты УДХК при моно- и комбинированной терапии, характеризовался более мягким течением и ускоренной нормализацией лабораторных показателей.
Ответ на лечение
Результаты лечения преднизолоном и азатиоприном при АИГ могут быть следующими:
- Полный ответ — нормализация лабораторных показателей, которая сохраняется в течение года на фоне поддерживающей терапии. При этом нормализуется и гистологическая картина (за исключением небольших остаточных изменений). О полной эффективности лечения говорят и в тех случаях, когда достоверно уменьшается выраженность клинических маркеров аутоиммунного гепатита, и в течение первых месяцев терапии лабораторные показатели улучшаются по крайней мере на 50 % (а в последующие 6 месяцев не превышают нормальный уровень более чем в 2 раза).
- Частичный ответ — отмечается улучшение клинических симптомов и в течение первых 2 месяцев наблюдается улучшение лабораторных показателей на 50 %. В последующем положительная динамика сохраняется, однако полной или практически полной нормализации лабораторных показателей в течение года не происходит.
- Отсутствие терапевтического эффекта (неэффективность лечения) — улучшение лабораторных показателей менее чем на 50 % в первые 4 недели лечения, причем дальнейшего их снижения (вне зависимости от клинического или гистологического улучшения) не происходит.
- Неблагоприятный исход терапии характеризуется дальнейшим ухудшением течения заболевания (хотя в некоторых случаях и отмечается улучшение лабораторных показателей).
О рецидиве заболевания говорят, когда после достижения полного ответа вновь появляются клинические симптомы и ухудшаются лабораторные показатели.
Обычно терапия дает хороший эффект, однако у 10–15 % больных она не приводит к улучшению, хотя и хорошо переносится. Причинами неэффективности терапии могут служить [6]:
- отсутствие ответа на препарат;
- отсутствие комплаенса и приверженности терапии;
- непереносимость препаратов;
- наличие перекрестных синдромов;
- гепатоцеллюлярная карцинома.
В качестве альтернативных препаратов для лечения аутоиммунного гепатита используют и другие иммуносупрессоры: будесонид, циклоспорин, циклофосфамид, микофенолата мофетил, такролимус, метотрексат [1, 2, 6, 11].
Клинический случай
Девочка восьми лет наблюдалась по поводу кожных высыпаний (эритематозные и нодулярные элементы без какого‑либо отделяемого на нижних конечностях), беспокоящих ее в течение 5–6 мес. Два месяца использовала местные средства от экземы, улучшения не было. Позднее возникли дискомфорт в эпигастральной области, слабость, периодически — тошнота и рвота.
Высыпания локализовались на ногах. При гистологическом исследовании кожного биоптата выявлена инфильтрация подкожной жировой клетчатки лимфоцитами без признаков васкулита. Данные явления были расценены как узловатая эритема.При осмотре выявлена невыраженная гепатоспленомегалия, в остальном соматический статус — без выраженных особенностей, состояние стабильное.
По результатам лабораторных исследований:
- ОАК: лейкоциты — 4,5×109/л; нейтрофилов 39 %, лимфоцитов 55 %; признаки гипохромной микроцитарной анемии (гемоглобин 103 г/л); тромбоциты — 174,000/мкл, СОЭ — 24 мм/ч;
- биохимический анализ крови: креатинин — 0,9 мг/дл (норма 0,3–0,7 мг/дл); билирубин общий — 1,6 мг/дл (норма 0,2–1,2 мг/дл), билирубин прямой – 0,4 мг/дл (норма 0,05–0,2 мг/дл); АСТ — 348 Ед/л (норма — до 40 Ед/л), АЛТ — 555 Ед/л (норма — до 40 Ед/л); щелочная фосфатаза — 395 Ед/л (норма — до 664 Ед/л), лактатдегидрогеназа — 612 Ед/л (норма — до 576 Ед/л).
Показатели системы гемостаза (протромбиновое время, международное нормализованное отношение), уровень общего белка, сывороточного альбумина, гамма-глобулина, уровень ферритина, церулоплазмина, альфа-антитрипсина, гамма-глутамилтранспептидазы — в пределах референсных значений.
В сыворотке крови не выявлены HBs-антиген, антитела к HBs, HBc, антитела к вирусу гепатита А и С. Также отрицательными были тесты на цитомегаловирус, вирус Эпштейна — Барр, токсоплазму, бруцеллу. Титр АСЛ-О в пределах нормы.Данных за сахарный диабет, тиреоидит, болезнь Грейвса, пролиферативный гломерулонефрит — не выявлено.
При УЗИ органов брюшной полости визуализировалась увеличенная печень с измененной эхоструктурой, без признаков портальной гипертензии и асцита. Офтальмологический осмотр не выявил наличия кольца Кайзера — Флейшера.
Титр антител anti-SMA — 1:160, ANA, AMA, anti-LKM-1 антитела не выявлены. Пациентка позитивна по гаплотипам HLA DR3, HLA DR4.
При гистологическом исследовании биоптата печени зафиксированы фиброз, лимфоцитарная инфильтрация, образование розеток гепатоцитов и другие признаки хронического аутоиммунного гепатита.
Пациентке выставлен диагноз «аутоиммунный гепатит 1 типа, ассоциированный с узловатой эритемой», начата терапия преднизолоном и азатиоприном. Счет по шкале IAIHG составлял 19 баллов до начала лечения, что характеризуется как «достоверный АИГ».
Через 4 недели терапии отмечалось купирование общеклинической симптоматики, нормализация лабораторных показателей. Через 3 месяца терапии кожные высыпания полностью регрессировали. Через 6 месяцев после окончания терапии состояние пациентки было удовлетворительным, лабораторные показатели — в пределах референсных значений.
Адаптировано из Kavehmanesh Z. et al. Pediatric Autoimmune Hepatitis in a Patient Who Presented With Erythema Nodosum: A Case Report. Hepatitis monthly, 2012. V. 12. — N. 1. — P. 42–45.
Таким образом, АИГ — это достаточно редкое и относительно хорошо поддающееся лечению заболевание. На фоне внедрения современных протоколов иммуносупрессивной терапии 10‑летняя выживаемость больных достигает 90 %. Менее благоприятен прогноз у больных с аутоиммунным гепатитом 2 типа, особенно у детей и подростков, у которых АИГ прогрессирует гораздо быстрее, а эффективность терапии в целом ниже. Следует помнить и о риске развития гепатоцеллюлярной карциномы (4–7 % в течение 5 лет после установления диагноза цирроза печени).
Список источников
- Вирусные гепатиты и холестатические заболевания / Юджин Р. Шифф, Майкл Ф. Соррел, Уиллис С. Мэддрей; пер. с англ. В. Ю. Халатова; под ред. В. Т. Ивашкина, Е. А. Климовой, И. Г. Никитина, Е. Н. Широковой. — М.: ГЭОТАР-Медиа, 2010.
- Kriese S., Heneghan M. A. Autoimmune hepatitis. Medicine, 2011. V. 39. — N. 10. — P. 580–584.
- Аутоиммунный гепатит и его вариантные формы: классификация, диагностика, клинические проявления и новые возможности лечения: пособие для врачей. Т. Н. Лопаткина. — М. 4ТЕ Арт, 2011.
- Longhia M. S. et al. Aethiopathogenesis of autoimmune hepatitis. Journal of Autoimmunity, 2010. N. 34. — P. 7–14.
- Muratori L. et al. Current topics in autoimmune hepatitis. Digestive and Liver Disease, 2010. N. 42. — P. 757–764.
- Lohse A. W., Mieli-Vergani G. Autoimmune hepatitis. Journal of Hepatology, 2011. V. 55. — N. 1. — P. 171–182.
- Oliveira L. C. et al. Autoimmune hepatitis, HLA and extended haplotypes. Autoimmunity Reviews, 2011. V. 10. — N. 4. — P. 189–193.
- Agarwal, K. et al. Cytotoxic T lymphocyte antigen-4 (CTLA-4) gene polymorphisms and susceptibility to type 1 autoimmunehepatitis. Hepatology, 2000. V. 31. — N. 1. — P. 49–53.
- Manns M. P. et al. Diagnosis and Management of Autoimmune Hepatitis. Hepatology, 2010. V. 51. — N. 6. — P. 2193–2213.
- Lohse A. W., Wiegard C. Diagnostic criteria for autoimmune hepatitis. Best Practice & Research Clinical Gastroenterology, 2011. V. 25. — N. 6. — P. 665–671.
- Strassburg C. P., Manns M. P. Therapy of autoimmune hepatitis. Best Practice & Research Clinical Gastroenterology, 2011. V. 25. — N. 6. — P. 673–687.
- Ohira H., Takahashi A. Current trends in the diagnosis and treatment of autoimmune hepatitis in Japan. Hepatology Research, 2012. V. 42. — N. 2. — P. 131–138.