Анемия при нарушение эритропоэз
Термином «анемия» обозначают уменьшение количество эритроцитов, гемоглобина (основной показатель для анемии) и/или гематокрита при нормальном, как правило, общем объеме крови. Непосредственно после острой массивной кровопотери, при дегидратации или гипергидратации диагноз анемии можно ставить только после восстановления ОЦК.
С учетом параметров эритроцитов (MCV и МСН) анемии классифицируют в зависимости от объеме эритроцитов на микроцитарные, нормоцитарные и макроцитарные; в зависимости от соотношения концентрации гемоглобина к количеству эритроцитов — на гипохромные, нормохромные и гиперхромные.
Патогенетическая классификация анемий отражает нарушение отдельных этапов эритропоэза, а та кже продолжительность жизни эритроцитов, циркулирующих в крови (гемолитическая анемия). Кроме того, анемия может развиться в результате острой или хронической кровопотери.
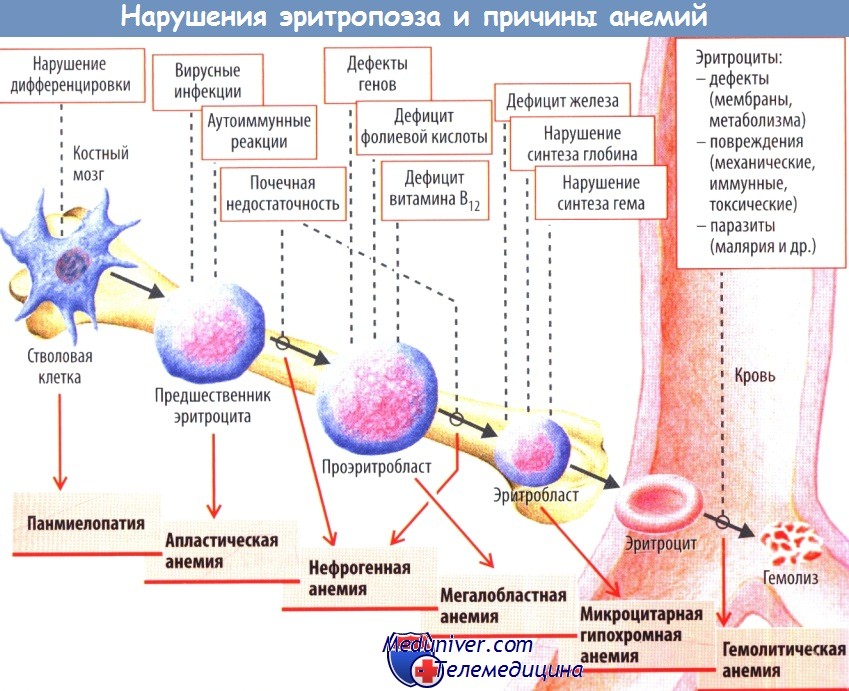
Расстройства эритропоэза возникают при:
1) нарушении или отсутствии дифференцировки плюрипотентных гемопоэтических стволовых клеток (апластическая анемия при панмиелопатии ил и остром миелобластном лейкозе);
2) преходящем (при вирусных инфекциях) или постоянном уменьшении только клеток-предшественниц эритропоэза (изолированная апластическая анемия) вследствие образования аутоантител против эритропоэтина или белков мембраны клеток-предшественниц эритропоэза;
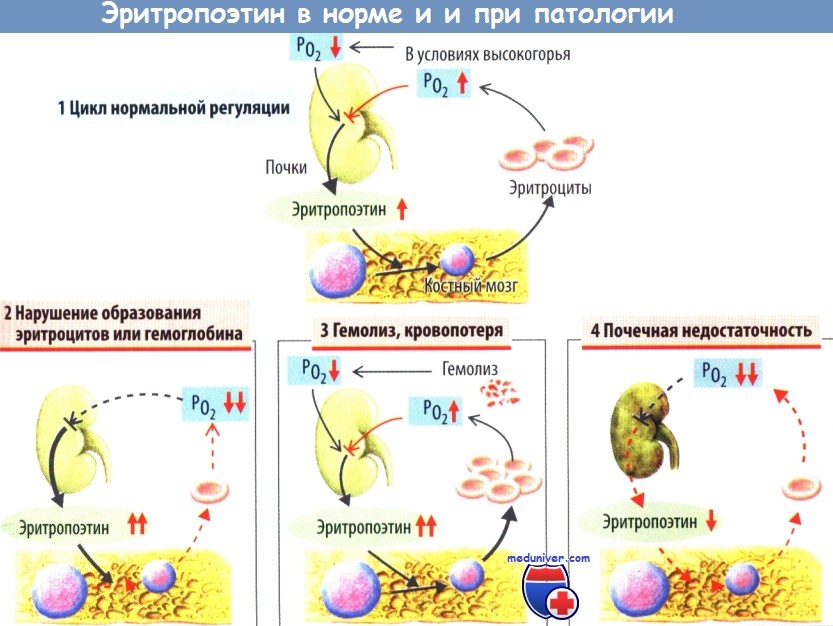
3) дефиците эритропоэтина при патологии почек (так называемая почечная анемия);
4) хроническом воспалении или опухолях, которые активируют помимо прочего интерлейкины, подавляющие эритропоэз (вторичная анемия);
5) нарушениях дифференцировки клеток (неэффективный эритропоэз), причиной которых помимо генетических дефектов может быть дефицит фолатов или витамина В12 (мегалобластная анемия);
6) нарушениях синтеза гемоглобина (микроцитарная гипохромная анемия).
Учебное видео — общий анализ крови в норме и при болезни
Скачать данное видео и просмотреть с другого видеохостинга можно на странице: Здесь.
Нарушение жизненного цикла эритроцитов — эритропоэза
Пролиферация и дифференцировка предшественников эритроцитов и превращение их в зрелые эритроциты происходят в среднем в течение недели. При стимуляции эритропоэза это время может укорачиваться до нескольких суток (напри мер, при быстрой потере клеток вследствие гемолиза или кровопотери). Средняя продолжительность жизни эритроцитов в крови составляет более 100 дней, поэтому кратковременные нарушения образования клеток не выявляются, но ускорение потери клеток быстро приводит к развитию анемии.
(Для нейтрофильных лейкоцитов характерно иное соотношение: время их дифференцировки в костном мозге больше, а время продолжительности ихжизни в периферической крови составляет около 10 ч, поэтому нейтропения развивается при остром нарушении их образования, но не после их потери.)
Учитывая время жизни эритроцита примерно 107 с и общее содержание эритроцитов в крови около 1,6 * 1013, скорость образования эритроцитов составляет 1,6 млн эритроцитов в секунду. При необходимости скорость образования эритроцитов увеличивается до 10 раз без истощения костного мозга. Поэтому гемолитические анемии, которыми некоторые пациенты страдают в течение всей жизни, могут быть в значительной степени компенсированы.
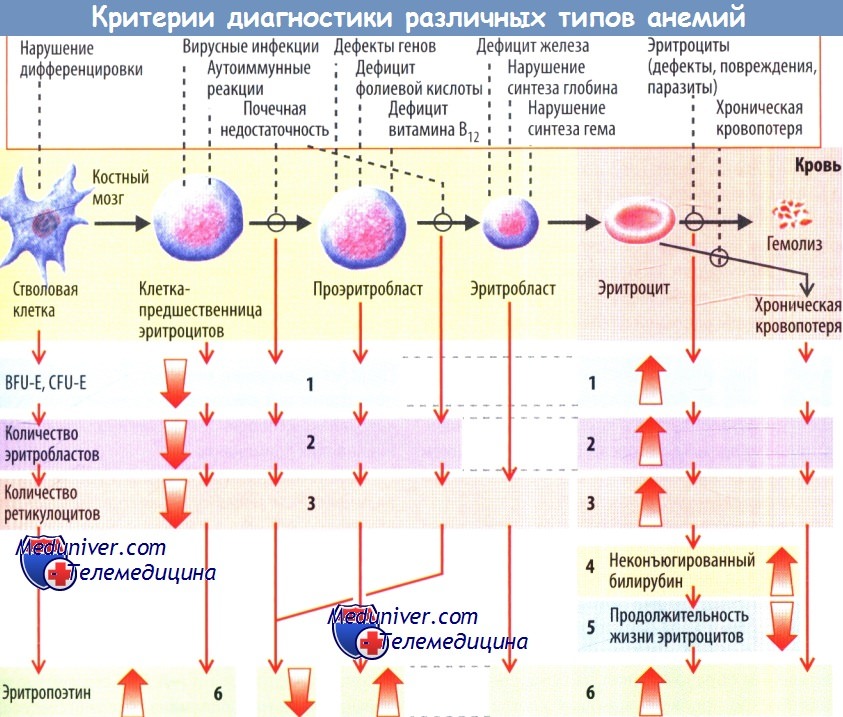
В основе диагностики нарушения жизненного цикла эритроцитов, в частности нарушения эритропоэза на разных стадиях, укорочения продолжительности их жизни или хронической кровопотери лежит ряд принципов.
Стволовые клетки, полученные путем пункции костного мозга, могут быть стимулированы к пролиферации и дифференцировке в клеточной культуре с помощью эритропоэтина. В результате образуются колонии более (бурстобразующие единицы[ BFU-E]) или менее дифференцированных клеток (колониеобразующие единицы [CFU-E]), содержащих гемоглобин.
Их количество уменьшено, если анемия вызвана нарушением образования клеток, и увеличено, если уменьшение клеток происходило на последней стадии дифференцировки (эритробласты, эритроциты).
В окрашенных мазках пунктата костного мозга могут быть морфологически идентифицированы и подсчитаны эритробласты. При аплазии и наличии дефектов дифференцировки стволовых клеток количество эритробластов уменьшается; при стимуляции эритропоэза (например, в условиях усиленного гемолиза) количество эритробластов увеличивается.
Эффективность эритропоэза в целом можно оценить, подсчитав количество ретикулоцитов. Если число ретикулоцитов снижено, следует думать о нарушении образования эритроцитов, т. к. вторая, теоретически возможная, причина этого явления -увеличение продолжительности жизни эритроцитов — не встречается. С другой стороны, увеличение количества ретикулоцитов (ретикулоцитоз) в течение длительного времени свидетельствует о постоя ином укорочении продолжительности жизни эритроцитов в сосудистом русле (в результате хронических кровотечений или гемолиза).
Временный ретикулоцитоз служит признаком стимуляции эритропоэза, например, после острой кровопотери, острого гемолиза или после лечения состояний, характеризующихся нарушениями эритропоэза (после использования высоких доз эритропоэтина).
После разрушения эритроцитов макрофагами билирубин, образующийся из высвобождающегося из эритроцитов гема, после конъюгации в печени выводится с желчью. Концентрация неконъюгирован-ного непрямого билирубина в плазме увеличивается при гемолизе, но в некоторых случаях она также повышается при интенсификации кругооборота гемоглобина вследствие неэффективного эритропоэза.
Продолжительность жизни эритроцитов (укороченная при гемолитической анемии), а также их общий объем могут быть определены с помощью метки эритроцитов in vitro радиоактивным 51Cr (который связывается с бета-цепью гемоглобина) с последующим введением меченых эритроцитов в сосудистое русло. Поскольку 51Cr при гемолизе высвобождается из эритроцитов и затем выводится почками, продолжительность жизни эритроцитов можно рассчитать по степени ежедневного убывания радиоактивности.
Общий объем эритроцита можно определить на основе знаний о принципах разведения индикаторов, т. к. известны количество введенного 51Cr и его начальная концентрация в крови.
Количественное определение эритропоэтина. Сниженная концентрация эритропоэтина в плазме позволяет предположить нефрогенную природу анемии. При большинстве анемий наблюдается компенсаторное увеличение концентрации эритропоэтина.
— Вернуться в оглавление раздела «Патофизиология»
Оглавление темы «Патофизиология человека»:
- Схема механизма переохлаждения организма — гипотермии
- Схема механизма развития ожирения и анорексии, булимии
- Схема образования клеток крови — гемопоэза
- Физиология и длительность жизни эритроцитов
- Схема причин анемий и нарушений эритропоэза
Источник
Классификация.В
зависимости от механизмов нарушения
эритропоэза можно выделить следующие
разновидности анемии:
дисрегуляторная,
обусловленная нарушением регуляции
эритропоэза при снижении выработки
эритропоэтина или повышенной продукции
его ингибиторов (при хронических
заболеваниях почек, гипофункции
гипофиза, щитовидной железы);дефицитная,
возникающая вследствие недостатка
веществ, необходимых для образования
эритроцитов (железо-, В12-,
фолиево-, белководефицитная анемия);ферментопатия,
вызванная нарушением активности
ферментов, участвующих в эритропоэзе
(например, в синтезе порфирина и гема);гипо(а)пластическая
при поражении эритроцитарного ростка
костного мозга, сопровождающемся резким
угнетением костномозгового кроветворения;метапластическая
— при замещении или вытеснении
эритроцитарного ростка другой тканью.
Железодефицитная анемия
Железодефицитная
анемия — анемия, вызванная недостатком
железа в организме в результате нарушения
баланса между его поступлением,
использованием и потерей. Это самый
распространенный вид анемии (80% всей
заболеваемости анемиями).
Этиология.
Наиболее частой причиной развития
железодефицитной анемии (ЖДА) являются
повторные и длительные, иногда массивные
однократные кровотечения, приводящие
к потере железа вместе с эритроцитами.
Чаще всего это наблюдается при маточных,
реже — желудочно-кишечных, почечных,
легочных кровотечениях, при геморрагическом
синдроме (см. «Постгеморрагическая
анемия«).
ЖДА может
возникать при нарушении поступления
железа с пищей (при кормлении детей
только коровьим или козьим молоком) и
повышенном расходе железа в период
роста, созревания организма, при
беременности, лактации. Кроме того,
причиной развития ЖДА служит снижение
всасывания железа при заболеваниях
пищевого канала (гипоацидный гастрит,
хронический энтерит) или резекции его
отделов, а также нарушение транспорта
железа (гипотрансферринемия при поражении
печени, наследственная атрансферринемия3),
его утилизации из резервов4
(при инфекции, интоксикации, глистной
инвазии) и депонировании (при гепатитах,
циррозе печени).
Патогенез. Экзогенный
или эндогенный дефицит железа в организме
характеризуется уменьшением и постепенным
истощением резервов железа, что
проявляется исчезновением гемосидерина
в макрофагоцитах печени и селезенки,
снижением до 2—5% в костном мозге
количества сидеробластов (клетки,
содержащие железо в виде гранул ферритина;
их число в норме — 20—40%). В крови понижается
концентрация сывороточного железа
(гипосидеремия достигает 1,8—2,7 мкм/л
вместо 12,5—30,4 мкм/л в норме) и степень
насыщения им трансферрина, что приводит
к уменьшению транспорта железа в костный
мозг. Нарушается включение железа в
эритроцитарные клетки, снижается синтез
гема в гемоглобине и некоторых
железосодержащих и железозависимых
ферментов (каталазы, глутатионпероксидазы)
в эритроцитах, что повышает их
чувствительность к гемолизирующему
действию окислителей. Увеличивается
неэффективный эритропоэз вследствие
возросшего гемолиза эритрокариоцитов
в костном мозге и эритроцитов в крови.
Продолжительность жизни эритроцитов
уменьшается.
В организме при
железодефицитной анемии возникают
компенсаторные реакции — усиление
абсорбции железа в пищевом канале,
повышение концентрации трансферрина,
гиперплазия эритроцитарного ростка,
увеличение интенсивности гликолиза и
активности 2,3-дифосфоглицерата в
эритроцитах, способствующее лучшей
отдаче кислорода тканям. Однако эти
реакции оказываются недостаточными,
чтобы восполнить дефицит железа в
организме и улучшить кислородтранспортную
функцию крови при уменьшении общего
количества эритроцитов и содержания в
них гемоглобина. Возникают морфологические
изменения в эритроцитарных клетках
костного мозга: гипохромия, связанная
с недостаточной гемоглобинизацией,
преобладание базофильных нормобластов
над ацидофильными в костном мозге,
микроцитоз, деструкция ядерных клеток
(нарушение митоза, кариорексис,
вакуолизация цитоплазмы эритробластов
и нормобластов).
Наряду с патологическими
изменениями эритропоэза дефицит железа
в организме приводит к уменьшению
миоглобина и активности железосодержащих
ферментов тканевого дыхания. Следствием
гемической и тканевой гипоксии при
железодефицитной анемии являются
атрофические и дистрофические процессы
в тканях и органах, особенно выраженные
в пищевом канале (глоссит, гингивит,
кариес зубов, поражение слизистой
оболочки пищевода, атрофический гастрит
с ахилией) и сердце (дистрофия миокарда).
Картина крови.Железодефицитная анемия — это анемия
с эритробластическим типом кроветворения,
гипохромная с низким цветовым показателем
(0,6 и меньше). Количество гемоглобина
снижается в большей степени, чем число
эритроцитов. Для мазка крови характерны
гипохромия, «тени» эритроцитов,
анулоциты, микроцитоз, пойкилоцитоз.
Количество ретикулоцитов зависит от
регенераторной способности эритроцитарного
ростка (регенераторная или чаще
гипорегенераторная анемия).
Источник
Классификация.В
зависимости от механизмов нарушения
эритропоэза можно выделить следующие
разновидности анемии:
дисрегуляторная,
обусловленная нарушением регуляции
эритропоэза при снижении выработки
эритропоэтина или повышенной продукции
его ингибиторов (при хронических
заболеваниях почек, гипофункции
гипофиза, щитовидной железы);дефицитная,
возникающая вследствие недостатка
веществ, необходимых для образования
эритроцитов (железо-, В12-,
фолиево-, белководефицитная анемия);ферментопатия,
вызванная нарушением активности
ферментов, участвующих в эритропоэзе
(например, в синтезе порфирина и гема);гипо(а)пластическая
при поражении эритроцитарного ростка
костного мозга, сопровождающемся резким
угнетением костномозгового кроветворения;метапластическая
— при замещении или вытеснении
эритроцитарного ростка другой тканью.
Железодефицитная анемия
Железодефицитная
анемия — анемия, вызванная недостатком
железа в организме в результате нарушения
баланса между его поступлением,
использованием и потерей. Это самый
распространенный вид анемии (80% всей
заболеваемости анемиями).
Этиология.
Наиболее частой причиной развития
железодефицитной анемии (ЖДА) являются
повторные и длительные, иногда массивные
однократные кровотечения, приводящие
к потере железа вместе с эритроцитами.
Чаще всего это наблюдается при маточных,
реже — желудочно-кишечных, почечных,
легочных кровотечениях, при геморрагическом
синдроме (см. «Постгеморрагическая
анемия«).
ЖДА может
возникать при нарушении поступления
железа с пищей (при кормлении детей
только коровьим или козьим молоком) и
повышенном расходе железа в период
роста, созревания организма, при
беременности, лактации. Кроме того,
причиной развития ЖДА служит снижение
всасывания железа при заболеваниях
пищевого канала (гипоацидный гастрит,
хронический энтерит) или резекции его
отделов, а также нарушение транспорта
железа (гипотрансферринемия при поражении
печени, наследственная атрансферринемия3),
его утилизации из резервов4
(при инфекции, интоксикации, глистной
инвазии) и депонировании (при гепатитах,
циррозе печени).
Патогенез. Экзогенный
или эндогенный дефицит железа в организме
характеризуется уменьшением и постепенным
истощением резервов железа, что
проявляется исчезновением гемосидерина
в макрофагоцитах печени и селезенки,
снижением до 2—5% в костном мозге
количества сидеробластов (клетки,
содержащие железо в виде гранул ферритина;
их число в норме — 20—40%). В крови понижается
концентрация сывороточного железа
(гипосидеремия достигает 1,8—2,7 мкм/л
вместо 12,5—30,4 мкм/л в норме) и степень
насыщения им трансферрина, что приводит
к уменьшению транспорта железа в костный
мозг. Нарушается включение железа в
эритроцитарные клетки, снижается синтез
гема в гемоглобине и некоторых
железосодержащих и железозависимых
ферментов (каталазы, глутатионпероксидазы)
в эритроцитах, что повышает их
чувствительность к гемолизирующему
действию окислителей. Увеличивается
неэффективный эритропоэз вследствие
возросшего гемолиза эритрокариоцитов
в костном мозге и эритроцитов в крови.
Продолжительность жизни эритроцитов
уменьшается.
В организме при
железодефицитной анемии возникают
компенсаторные реакции — усиление
абсорбции железа в пищевом канале,
повышение концентрации трансферрина,
гиперплазия эритроцитарного ростка,
увеличение интенсивности гликолиза и
активности 2,3-дифосфоглицерата в
эритроцитах, способствующее лучшей
отдаче кислорода тканям. Однако эти
реакции оказываются недостаточными,
чтобы восполнить дефицит железа в
организме и улучшить кислородтранспортную
функцию крови при уменьшении общего
количества эритроцитов и содержания в
них гемоглобина. Возникают морфологические
изменения в эритроцитарных клетках
костного мозга: гипохромия, связанная
с недостаточной гемоглобинизацией,
преобладание базофильных нормобластов
над ацидофильными в костном мозге,
микроцитоз, деструкция ядерных клеток
(нарушение митоза, кариорексис,
вакуолизация цитоплазмы эритробластов
и нормобластов).
Наряду с патологическими
изменениями эритропоэза дефицит железа
в организме приводит к уменьшению
миоглобина и активности железосодержащих
ферментов тканевого дыхания. Следствием
гемической и тканевой гипоксии при
железодефицитной анемии являются
атрофические и дистрофические процессы
в тканях и органах, особенно выраженные
в пищевом канале (глоссит, гингивит,
кариес зубов, поражение слизистой
оболочки пищевода, атрофический гастрит
с ахилией) и сердце (дистрофия миокарда).
Картина крови.Железодефицитная анемия — это анемия
с эритробластическим типом кроветворения,
гипохромная с низким цветовым показателем
(0,6 и меньше). Количество гемоглобина
снижается в большей степени, чем число
эритроцитов. Для мазка крови характерны
гипохромия, «тени» эритроцитов,
анулоциты, микроцитоз, пойкилоцитоз.
Количество ретикулоцитов зависит от
регенераторной способности эритроцитарного
ростка (регенераторная или чаще
гипорегенераторная анемия).
Соседние файлы в предмете Патологическая физиология
- #
- #
Источник
Классификация.В
зависимости от механизмов нарушения
эритропоэза можно выделить следующие
разновидности анемии:
дисрегуляторная,
обусловленная нарушением регуляции
эритропоэза при снижении выработки
эритропоэтина или повышенной продукции
его ингибиторов (при хронических
заболеваниях почек, гипофункции
гипофиза, щитовидной железы);дефицитная,
возникающая вследствие недостатка
веществ, необходимых для образования
эритроцитов (железо-, В12-,
фолиево-, белководефицитная анемия);ферментопатия,
вызванная нарушением активности
ферментов, участвующих в эритропоэзе
(например, в синтезе порфирина и гема);гипо(а)пластическая
при поражении эритроцитарного ростка
костного мозга, сопровождающемся резким
угнетением костномозгового кроветворения;метапластическая
— при замещении или вытеснении
эритроцитарного ростка другой тканью.
Железодефицитная анемия
Железодефицитная
анемия — анемия, вызванная недостатком
железа в организме в результате нарушения
баланса между его поступлением,
использованием и потерей. Это самый
распространенный вид анемии (80% всей
заболеваемости анемиями).
Этиология.
Наиболее частой причиной развития
железодефицитной анемии (ЖДА) являются
повторные и длительные, иногда массивные
однократные кровотечения, приводящие
к потере железа вместе с эритроцитами.
Чаще всего это наблюдается при маточных,
реже — желудочно-кишечных, почечных,
легочных кровотечениях, при геморрагическом
синдроме (см. «Постгеморрагическая
анемия«).
ЖДА может
возникать при нарушении поступления
железа с пищей (при кормлении детей
только коровьим или козьим молоком) и
повышенном расходе железа в период
роста, созревания организма, при
беременности, лактации. Кроме того,
причиной развития ЖДА служит снижение
всасывания железа при заболеваниях
пищевого канала (гипоацидный гастрит,
хронический энтерит) или резекции его
отделов, а также нарушение транспорта
железа (гипотрансферринемия при поражении
печени, наследственная атрансферринемия3),
его утилизации из резервов4
(при инфекции, интоксикации, глистной
инвазии) и депонировании (при гепатитах,
циррозе печени).
Патогенез. Экзогенный
или эндогенный дефицит железа в организме
характеризуется уменьшением и постепенным
истощением резервов железа, что
проявляется исчезновением гемосидерина
в макрофагоцитах печени и селезенки,
снижением до 2—5% в костном мозге
количества сидеробластов (клетки,
содержащие железо в виде гранул ферритина;
их число в норме — 20—40%). В крови понижается
концентрация сывороточного железа
(гипосидеремия достигает 1,8—2,7 мкм/л
вместо 12,5—30,4 мкм/л в норме) и степень
насыщения им трансферрина, что приводит
к уменьшению транспорта железа в костный
мозг. Нарушается включение железа в
эритроцитарные клетки, снижается синтез
гема в гемоглобине и некоторых
железосодержащих и железозависимых
ферментов (каталазы, глутатионпероксидазы)
в эритроцитах, что повышает их
чувствительность к гемолизирующему
действию окислителей. Увеличивается
неэффективный эритропоэз вследствие
возросшего гемолиза эритрокариоцитов
в костном мозге и эритроцитов в крови.
Продолжительность жизни эритроцитов
уменьшается.
В организме при
железодефицитной анемии возникают
компенсаторные реакции — усиление
абсорбции железа в пищевом канале,
повышение концентрации трансферрина,
гиперплазия эритроцитарного ростка,
увеличение интенсивности гликолиза и
активности 2,3-дифосфоглицерата в
эритроцитах, способствующее лучшей
отдаче кислорода тканям. Однако эти
реакции оказываются недостаточными,
чтобы восполнить дефицит железа в
организме и улучшить кислородтранспортную
функцию крови при уменьшении общего
количества эритроцитов и содержания в
них гемоглобина. Возникают морфологические
изменения в эритроцитарных клетках
костного мозга: гипохромия, связанная
с недостаточной гемоглобинизацией,
преобладание базофильных нормобластов
над ацидофильными в костном мозге,
микроцитоз, деструкция ядерных клеток
(нарушение митоза, кариорексис,
вакуолизация цитоплазмы эритробластов
и нормобластов).
Наряду с патологическими
изменениями эритропоэза дефицит железа
в организме приводит к уменьшению
миоглобина и активности железосодержащих
ферментов тканевого дыхания. Следствием
гемической и тканевой гипоксии при
железодефицитной анемии являются
атрофические и дистрофические процессы
в тканях и органах, особенно выраженные
в пищевом канале (глоссит, гингивит,
кариес зубов, поражение слизистой
оболочки пищевода, атрофический гастрит
с ахилией) и сердце (дистрофия миокарда).
Картина крови.Железодефицитная анемия — это анемия
с эритробластическим типом кроветворения,
гипохромная с низким цветовым показателем
(0,6 и меньше). Количество гемоглобина
снижается в большей степени, чем число
эритроцитов. Для мазка крови характерны
гипохромия, «тени» эритроцитов,
анулоциты, микроцитоз, пойкилоцитоз.
Количество ретикулоцитов зависит от
регенераторной способности эритроцитарного
ростка (регенераторная или чаще
гипорегенераторная анемия).
Источник


