Анемии при операциях на сердце
Анемии (малокровие) — состояние, характеризующееся уменьшением количества Hb в единице объёма крови, часто при одновременном уменьшении количества эритроцитов. Это самый распространённый гематологический синдром. По данным ВОЗ, во всём мире около 2 млрд человек страдают анемией, и приблизительно в 50% случаев она связана с дефицитом железа.
Анемия — самостоятельное заболевание системы крови, однако она может быть симптомом лейкоза, тромбоцитопении, геморрагических состояний и т.д. Кроме того, анемия может возникать или усугубляться при миелосупрессивной химиотерапии или радиационном облучении.
При анемии в основе патологии сердечно-сосудистой системы лежат глубокие биологические изменения в миокарде, обусловленные тканевой и гемической гипоксией. Гипоксия развивается в результате снижения кислородной ёмкости крови, а также при нарушении регуляции NO-зависимого расширения сосудов вследствие патологии переноса эритроцитами оксида азота. В патогенезе железодефицитной анемии имеет значение нарушение обмена железа — одного из основных микроэлементов, необходимых для нормальной жизнедеятельности человеческого организма. Железо входит в состав Нb, миоглобина, цитохромов, каталазы, пероксидазы и других ферментов, участвует в тканевом дыхании, обменных процессах, синтезе гормонов и т.д.
При острой анемии вследствие быстрого снижения Нb и циркулирующих эритроцитов (резкая и обильная кровопотеря, острый гемолиз) уменьшается доставка кислорода к тканям. Наибольшая относительная способность переноса кислорода сохранена при гематокрите 30-33%. По мере уменьшения концентрации Нb и содержания кислорода, обеспечение общей доставки кислорода происходит за счёт увеличения сердечного выброса. Компенсаторно возникает тахикардия, укорачивается диастола, уменьшается системное сосудистое сопротивление, снижается АД. В норме при здоровом сердце и большом резерве миокардиального кровотока перечисленные реакции компенсируют острую анемию без развития ишемии миокарда. Этому способствует возникающее в ответ на острую гипоксию увеличение уровня эритропоэтина, который оказывает кардиопротективное действие. В то же время при поражении коронарных артерий устойчивость миокарда к низкому уровню Нb значительно снижена. Это приводит к ишемии, а ишемизированный или гипертрофированный миокард более чувствителен, чем неизменённый, даже к незначительному снижению уровня Нb, в результате нарушение функций сердца может иметь серьёзные последствия.
При хронической анемии выявляют и другие компенсаторные реакции: увеличение сердечного выброса и преднагрузки, уменьшение постнагрузки, увеличение хронотропных и инотропных эффектов. Однако при длительном существовании даже умеренной анемии существующая при этом гипоксия приводит к более глубоким изменениям, проявляющимся в нарушении структуры и функции биологических мембран, в том числе мембран кардиомиоцитов. В миокарде происходят диффузио-дистрофические и структурные изменения (жировая дегенерация), появляются субэидокардиальные зоны ишемии, вплоть до мелкоочаговых некрозов, расширяются полости, что в конечном итоге приводит к нарушению диастолической и систолической функций сердца.
Диастолическая дисфункция ЛЖ и ПЖ характерна для всех видов анемии (особенно для гемолитической и серповидноклеточной). Причиной серповидноклеточной анемии считают окклюзию сосудов серповидными эритроцитами, приводящую к ишемии миокарда, при рецидивирующих гемолитических кризах развивающийся при этом фиброз миокарда. При некоторых гемолитических анемиях возможны микротромбозы коронарных артерий с развитием ИМ.
Определено, что длительное увеличение сердечного выброса при хронической анемии может привести к ремоделированию центральных артерий эластического типа (аорта и сонные артерии), увеличению массы миокарда ЛЖ.
Несмотря на разнообразную этиологию (постгеморрагичекие, гемолитические, а пластические, железодефицитные, В12-дефицитные и др.), анемии имеют общие симптомы: слабость, повышенную утомляемость, бледность кожных покровов и слизистых, боли в области сердца, сердцебиение, одышку и т.д. Длительное течение анемии приводит к развитию так называемого «анемического сердца», которое проявляется указанными выше жалобами, расширением границ относительной сердечной тупости влево, снижением амплитуды зубцов ЭКГ, низкой толерантности к физической нагрузке и депрессией сегмента ST во время проведения стресс-тестов.
В исследованиях последних лет выявлено значение анемии как независимого фактора риска развития ССЗ. В работах ARIC было показано, что снижение Нb на 1 г/дл связано с увеличением риска смерти на 14% и увеличением нарушений функций сердца на 28%. Анемию и высокий уровень гематокрита рассматривают как независимый предиктор острого коронарного синдрома и ИМ и прогностически неблагоприятный признак в отношении «поздней» госпитальной смерти и фатального кардиогенного шока. Снижение Нb коррелирует с выраженностью клинических проявлений ИБС, нарушениями ритма. При остром ИМ низкий уровень Нb может быть экстракардиальным фактором, усиливающим ишемию и провоцирующим систолическую дисфункцию сердца.
Анемия любой этиологии связана с возникновением и развитием застойной сердечной недостаточности. В ряде крупных многоцентровых исследований статистически доказана высокая частота выявления анемии у больных с ХСН, причём наличие анемии связано с худшим клиническим статусом, более тяжёлой систолической и диастолической дисфункцией, высоким уровнем натрийуретического пептида, быстрым ухудшением функции почек, низким качеством жизни и повышенными медицинскими затратами. Фремингемское исследование показало, что анемия — независимый фактор риска смерти больных с застойной сердечной недостаточностью. При снижении гематокрита на каждый 1% риск смерти больных с сердечной недостаточностью увеличивается на 6%.
Своевременное лечение по стандартным схемам, соответствующим опредёленному типу анемии (например, препараты железа назначают при железодефицитной анемии), может привести к уменьшению и устранению описанных изменений, в том числе ишемии, гипертрофии, дилатации и диастолической дисфункции ЛЖ, увеличению фракции выброса, ударного объёма, сердечного выброса и др.
Особое место среди анемий занимает талассемия — наследуемая по рецессивному типу гемолитическая анемия, характеризующаяся нарушением синтеза глобина (белка, входящего в состав Нb). Для неё характерно наличие мишеневидных эритроцитов, гипохромная анемия при повышенном содержании железа в органах, в том числе в сердце, с развитием гемосидероза. При накоплении железа в сердце могут возникать нарушения ритма, кардиомегалия, сердечная недостаточность. Описаны случаи экссудативного перикардита при данной патологии.
Наряду с яркими проявлениями талассемии существуют трудно диагностируемые, маломанифестные формы. В связи с этим следует подчеркнуть опасность применения препаратов железа у данной категории больных и необходимость обязательного исследования показателей обмена железа при выявлении анемии. Для лечения применяют препараты, выводящие избыток железа из организма, трансфузии эритроцитарных препаратов крови.
Поражение сердца при тромбоцитопениях и нарушениях свёртываемости крови.
Тромбоцитопеническая пурпура — группа заболеваний, для которых характерно наличие геморрагического синдрома, развивающегося в результате снижения числа тромбоцитов в периферической крови ниже уровня 155×10х9 г/л (тромбоцитопении).
Идиоматическая тромбоцитопеническая пурпура (болезнь Верльгофа) протекает в острой или хронической форме, проявляясь кровоизлияниями в кожу, слизистые оболочки, а также различными кровотечениями (в том числе в миокард, серозные оболочки, сетчатку и другие отделы глаза). Для болезни Мошковича характерно сочетание тромбоцитопении с геморрагическим синдромом и гемолитической анемией. Развитие симптоматических тромбоцитопений отмечают при других заболеваниях (злокачественные новообразования, лучевая болезнь, гепатит, инфекционные болезни), а также при использовании ряда лекарств. У больных ССЗ существует риск тромбоцитопении, вызванной приёмом клопидогрела, особенно при использовании его в высоких дозах (однократная доза 600 мг), хинидина, НПВС и ряда других средств.
Поражение сердца (микрососудистые тромбы и интрамиокардиальные кровоизлияния) при тромбоцитопенической пурпуре часто выявляют при морфологическом исследовании миокарда. Гистологическое исследование позволяет выявить фокальный миокардит, ассоциированный с тромбоцитарными микротромбами, зоны некроза, нарушения в проводящей системе области синоатриального и атриовентрикулярного узла, ножек пучка Гиса.
Частыми клиническими проявлениями указанных нарушений считают нарушения ритма, различные по характеру и тяжести. В ряде случаев они имеют транзиторный характер. Около 3-8% больных с тромбоцитопенической пурпурой жалуются на боли в области сердца по типу стенокардии. Редко возникает застойная сердечная недостаточность.
Опасными для жизни считают кровоизлияния в сердце, головной мозг. Существуют сообщения о внезапной смерти больных с тромбоцитопенической пурпурой, вызванной очаговыми кровоизлияниями в миокард (в том числе в зонах проводящей системы сердца), приводящими к фатальным нарушениям ритма.
Описаны возможности успешной коррекции и восстановления функции сердца при лечении тромбоцитопенической пурпуры, в частности после применения плазмафереза.
У ряда больных, получавших НФГ, развивается гепарин-индуцированная тромбоцитопения. Риск её возникновения составляет 1-3%. Состояние обычно развивается у больных, перенёсших операцию в условиях искусственного кровообращения. Выделяют два типа гепарин-индуцированной тромбоцитопении. Тромбоцитопения I типа — результат прямой активации гепарином тромбоцитов и их повышенная агглютинация — доброкачественная, без риска тромбозов, существует в течение первых 5-10 дней после операции и склонна к саморазрешению без лечебных мероприятий. Тромбоцитопения II типа — иммунная, вследствие образования антител к гепарину, характеризуется тяжёлым, иногда быстропрогрессирующим течением. При несвоевременной диагностике может возникнуть кровотечение, артериальные и венозные тромбозы, тромбоэмболические осложнения. Состояние требует лабораторного контроля (определяют количество тромбоцитов, степень их агрегации). При несвоевременно установленном диагнозе часто возникает необходимость интенсивной терапии. Прогноз может быть неблагоприятным, особенно у продолжающих получать гепарин после операции, в том числе после кардиохирургического вмешательства (например, протезирование клапанов сердца).
Диагноз гепарин-индуцированной тромбоцитопении следует рассматривать у всех больных с тромбоцитопенией, получавших гепарин в течение последних 14 дней, особенно при наличии признаков тромбоза. Лечение проводят прямыми ингибиторами тромбина с последующим переходом на пероральный прием варфарина, изучают возможности применения фондапаринукса — непрямого ингибитора фактора Ха.
Гемофилия — болезнь системы гемостаза, наследующаяся сцепленно с полом, характеризуется недостаточностью VIII или IX факторов свертывания крови. Болезнь Виллебранда сходна с классической гемофилией (атромбоцитопеническая пурпура) — наследственная болезнь системы гемостаза, характеризуемая количественными или качественными нарушениями синтеза фактора Виллебранда (фактор VIII циркулирует совместно с фактором Виллебранда, который его стабилизирует).
Для данных заболеваний характерен клинически выраженный геморрагический синдром и связанная с ним анемия, проявляющаяся соответствующими изменениями сердечной деятельности. У некоторых пациентов болезнь Виллебранда сочетается с признаками мезенхимальной дисплазии, выражающейся в числе прочего пролабированием створок клапанов сердца, артериовенозными шунтами.
Предполагают, что существует связь между фактором Виллебранда и развитием атеросклероза, однако данная теория не получила абсолютного подтверждения.
Необходимо отметить, что для больных с гемофилией состояние сердечной деятельности — важный фактор, определяющий режимы терапии, в частности объёмы переливаемой плазмы. Так, при необходимости переливания свежезамороженной плазмы в ситуации нормальной функции сердца скорость трансфузии может быть около 18 мл/кг в течение часа, в то время как при сердечной недостаточности объёмы переливания должны быть скорректированы в меньшую сторону.
Полицитемия истинная (эритремия, болезнь Вакеза) — болезнь, обусловленная гиперплазией костного мозга (преимущественно эритроцитарного ростка), характерен эритроцитоз, лейкоцитоз, тромбоцитоз, увеличение массы циркулирующей крови и количества Нb. Болезнь проявляется резким покраснением кожных покровов, кожным зудом, склонностью к тромбозам, спленомегалией.
В связи с увеличением массы эритроцитов в кровяном русле для полицитемии характерно повышение свёртывания крови, плеторический синдром, что обусловливает особенности клинических проявлений осложнения заболевания. Для большинства больных характерна АГ. Нарушение микроциркуляции в миокарде вызывает боли в области сердца. В случае тромбоза развивается острый коронарный синдром, ИМ.
Лечение больных с полицитемией при уровне тромбоцитов, превышающем норму, предполагает назначение антиагрегантов: ацетилсалициловая кислота, тиклопидин, клопидогрель в общетерапевтических дозах.
Помимо истинной полицитемии, эритроцитоз может развиться как компенсаторная реакция (так называемый вторичный эритроцитоз) в случаях снижения насыщения крови кислородом. Это характерно для жителей высокогорья (например, живущих в районах Тянь-Шаня, Гималаев, Анд и др.), больных с хроническими неспецифическими заболеваниями легких, лёгочным сердцем. Клинические проявления сходны с истинной полицитемией. Отмечают худший прогноз при ИМ на фоне эритроцитоза в случае лёгочной гипертензии в связи развитием более тяжёлых гемодинамических осложнений. Эритроцитоз повышает риск повторного тромбообразования в постинфарктном периоде, предрасполагает к прогрессированию сердечной недостаточности.
В лечении данной категории больных делают акцент на антиагреганты.
Горохова С.Г., Атаманова М.А.
Поражение сердца при заболеваниях крови
Опубликовал Константин Моканов
Статья посвящена проблеме приобретенной механической гемолитической анемии, вызванной дисфункцией имплантированных сердечных клапанов. Показано, что в современных условиях наиболее часто выраженные признаки гемолиза наблюдаются при дисфункции протеза, например, вследствие образования параклапанной фистулы. Представлены клинические случаи.
В настоящее время благодаря современным возможностям сердечно-сосудистой хирургии операция протезирования клапанов сердца стала повседневной в работе специализированных кардиохирургических центров. В мире живут десятки тысяч пациентов с имплантированными сердечными протезами. В условиях хирургической коррекции клапанов становится актуальной проблема послеоперационной анемии, которая может носить различный характер. Вероятность развития у такого рода больных приобретенной механической гемолитической анемии во многом определяет течение послеоперационного периода. Большое значение в достижении хороших отдаленных результатов приобретают квалифицированный контроль и лечение этих пациентов у врача поликлиники по месту жительства [1].
Данные о воздействии протезов на эритроциты и на возникновение гемолиза противоречивы. По данным некоторых исследователей, гемолиз бывает клинически невыраженным, в других работах имеются указания на значительные клинические проявления гемолиза [1–4]. Степень клинических проявлений гемолиза зависит как от состояния самих эритроцитов, так и от механических свойств протезов [5, 6]. Несомненно, играют роль не только обработка протеза и материал, из которого он сделан, но и гемодинамические условия: скорость кровотока в области протеза, образование завихрений.
В связи с улучшением методологии оперативных вмешательств, а также с модернизацией искусственных клапанов сердца (ИКС) сердечно-сосудистый риск при операциях на сердце в течение последних десятилетий существенно снизился во всех возрастных группах. В 1960–1970-е гг. после введения в практику протезирования клапанов сердца гемолитическая анемия развивалась у 5–15% прооперированных пациентов, особенно после имплантирования механических шаровых протезов [2, 5]. Использование протезов нового поколения снизило частоту гемолитической анемии до 1% [2, 6]. Современные искусственные клапаны сердца разработаны на основе клинических данных использования нескольких поколений протезов. Они изготовлены из новейших материалов и имеют уникальную конструкцию [7, 8]. Однако компенсированный гемолиз может возникнуть при любом типе протеза. Наиболее часто выраженные признаки гемолиза наблюдаются при нарушении функции протеза, например, вследствие образования параклапанной фистулы. Разрушение эритроцитов с развитием гемолиза связано с нарушением кровотока через дефектный протез и увеличением повреждения эритроцитов его створками [3, 7]. Клинически гемолиз может проявляться симптомами сердечной недостаточности и анемии. Наблюдаются бледность кожных покровов, желтуха, моча может приобретать коричневый или черный цвет. Содержание билирубина повышено, особенно непрямая фракция, могут быть ретикулоцитоз, повышение активности лактатдегидрогеназы (ЛДГ) и уровня свободного гемоглобина в плазме крови. Синдром механического гемолиза подтверждается обнаружением в мазке крови больного фрагментов (обломков) эритроцитов (Fragmentes Red Cell (FRC)) или шистоцитов (син. — шизоциты). Наблюдаются анизопойкилоцитоз (изменение формы и размеров эритроцитов), полихромазия (способность окрашиваться как основными, так и кислыми красителями). При длительно протекающем гемолизе развивается дефицит железа.
В отечественной и зарубежной литературе описано очень мало случаев макроангиопатической гемолитической анемии, связанной с механическим повреждением эритроцитов у пациентов с ИКС. Мы приводим собственные наблюдения о гемолизе, вызванном дисфункцией механического двустворчатого протеза МедИнж (ЗАО НПП «МедИнж», Россия).
Пациентка, 65 лет.
Диагноз: сочетанный приобретенный порок митрального, аортального и трикуспидального клапанов. Проведено протезирование аортального (МедИнж 23) и митрального (МедИнж 29) клапанов, аннулопластика трикуспидального клапана по Де Вега-2.
До оперативного вмешательства у пациентки показатели красной крови не выходили за пределы соответствующих референтных интервалов: эритроциты — 4,16×1012/л; гемоглобин — 124 г/л; гематокрит — 36%; средний объем эритроцитов — 86,6 фл; среднее содержание гемоглобина в эритроците — 29,8 пг; средняя концентрация гемоглобина в эритроците — 344 г/л; ширина распределения эритроцитов по объему — 13,7%. На 10-е сут после операции у нее наблюдалась нормохромная анемия: эритроциты — 2,74×1012/л; гемоглобин — 83,2 г/л; гематокрит — 23,7%; средний объем эритроцитов — 86,7 фл; среднее содержание гемоглобина в эритроците — 30,4 пг; средняя концентрация гемоглобина в эритроците — 351 г/л; ширина распределения эритроцитов по объему — 16,1%. Через 1 мес. признаки анемии сохранялись: эритроциты — 2,54×1012/л; гемоглобин — 80,2 г/л; гематокрит — 23%; средний объем эритроцитов — 82,3 фл; среднее содержание гемоглобина в эритроците — 27,4 пг; средняя концентрация гемоглобина в эритроците — 351 г/л; ширина распределения эритроцитов по объему — 17,1%. На фоне приема сульфата железа и аскорбиновой кислоты 200 мг/сут эффекта не наблюдалось.
Пациентку беспокоили одышка при минимальной физической нагрузке, в положении лежа, отеки, повышенная утомляемость. Через 6 мес. после операции в связи с сохранением жалоб, признаков анемии (гемоглобин — 70–80 г/л) находилась на лечении в терапевтическом отделении. У пациентки был повышен уровень непрямого билирубина (40,4 мкмоль/л), проба Кумбса отрицательная, отмечалось периодическое выделение мочи черного цвета. Эффекта от преднизолона не было. Была обследована у гематолога, диагностирована приобретенная гемолитическая анемия, обусловленная механическим повреждением эритроцитов протезированными клапанами сердца. Направлена в кардиохирургический стационар для решения вопроса о повторном оперативном вмешательстве.
При поступлении в стационар состояние тяжелое. Кожные покровы бледные, желтушные. Живот увеличен за счет асцита. Пастозность стоп, лодыжек. Тоны сердца приглушены, аритмичные. Мелодия протеза четкая, систолический шум во всех точках. На эхокардиографии: в проекции аортального клапана протез без признаков дисфункции; в проекции митрального клапана диагностирована трансклапанная регургитация 1–2 степени, по задней части протеза — параклапанная фистула 2 степени. Показатели красной крови: эритроциты — 2,76×1012/л; гемоглобин — 90 г/л; гематокрит — 26,3%; средний объем эритроцитов — 95,6 фл; среднее содержание гемоглобина в эритроците — 32,2 пг; средняя концентрация гемоглобина в эритроците — 342 г/л; ширина распределения эритроцитов по объему — 24,3%, при микроскопии окрашенного мазка — полихромазия, шистоциты (2,0%) (рис. 1), ретикулоциты — 2,5%. Билирубин общий — 98,5 мкмоль/л, билирубин непрямой — 50,4 мкмоль/л, свободный гемоглобин — 0,6 г/л.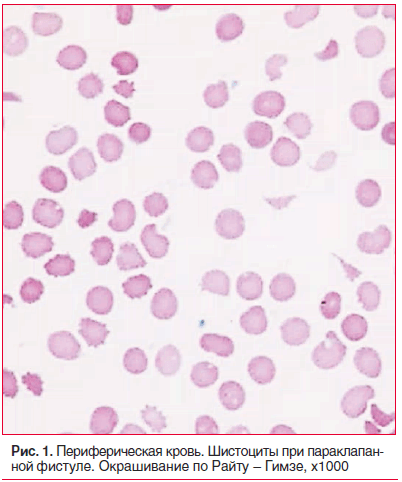
К сожалению, ввиду наличия у пациентки аортального протеза эндоваскулярное закрытие параклапанной фистулы митрального протеза было технически невыполнимо. В настоящее время пациентка наблюдается у кардиолога и гематолога по месту жительства. При снижении гемоглобина ниже 60 г/л ей проводятся трансфузии эритроцитосодержащих компонентов крови.
Пациентка, 60 лет. Диагноз: приобретенный порок митрального и трикуспидального клапанов. Проведены протезирование митрального (МедИнж 29) клапана, аннулопластика трикуспидального клапана по Де Вега.
Через 1 год после оперативного вмешательства у пациентки наблюдалось ухудшение состояния: одышка при минимальной физической нагрузке, отеки на ногах, последние 6 мес. — желтушность склер. В анализах, выполненных по месту жительства, — билирубин до 134 мкмоль/л. По данным чреспищеводной эхокардиографии в проекции митрального клапана — параклапанная фистула 1 степени.
Пациентка была госпитализирована в кардиохирургический стационар для устранения дефекта. При поступлении: билирубин — 110 мкмоль/л, непрямой билирубин — 22,7 мкмоль/л, свободный гемоглобин — 0,3 г/л. Наблюдалась гипохромная анемия: эритроциты — 4,6×1012/л; гемоглобин — 100 г/л; гематокрит — 36%; средний объем эритроцитов — 73,9 фл; среднее содержание гемоглобина в эритроците — 21,7 пг; средняя концентрация гемоглобина в эритроците — 291 г/л; ширина распределения эритроцитов по объему — 24,4%, шистоциты — 1,3%. Пациентке было проведено эндоваскулярное закрытие параклапанной фистулы окклюдером с положительной динамикой, с постепенным снижением уровня общего и непрямого билирубина, повышением уровня гемоглобина. При выписке гемоглобин — 128 г/л.
Таким образом, при подозрении на гемолиз у больных с ИКС всегда необходимо исключать механическую причину повреждения эритроцитов. Степень анемии в зависимости от степени и выраженности гемолиза может быть различной. Чаще всего анемия нормохромная, но при длительно протекающем гемолизе может носить гипохромный характер, с изменением морфологии красных клеток крови и присутствием шистоцитов либо только с присутствием шистоцитов как изолированным проявлением пойкилоцитоза. Рабочая группа Международного совета стандартизации в гематологии (МССГ (ICSH)) подготовила рекомендации для стандартизации, идентификации, подсчета и описания шистоцитов. Рекомендации определяют морфологическое описание шистоцитов, основанное на соответствующих критериях (в виде шлема; маленькие, неправильной треугольной формы, с наличием 2–3 углов; в форме полумесяца, с заостренными выступами, а также с отсутствием просветления в центре) [9–11]. В качестве полезного дополнения к микроскопу рекомендуется автоматизированный подсчет FRC. К сожалению, не все современные гематологические анализаторы демонстрируют сигналы тревоги («флаги»), сигнализирующие о наличии шистоцитов, а тем более проводят их подсчет. Да и специфичность автоматического метода очень низка (около 20%), требуется микроскопическое исследование для их подтверждения [9]. Поэтому общий анализ крови у пациентов с ИКС при подозрении на гемолиз необходимо дополнять микроскопией окрашенного мазка крови с описанием морфологии эритроцитов.
Выявленный шистоцитоз требует от врача-клинициста безотлагательных действий по установлению диагноза. При наличии клинической картины, лабораторных признаков гемолиза, нарастании в динамике процентного содержания шистоцитов диагноз механического разрушения эритроцитов становится очевидным. При подтверждении механической гемолитической анемии оправданным методом лечения является своевременное репротезирование клапанов сердца.