Активация макрофагов и атеросклероз
Главная
/
Архивы
/
Том 60 № 1 (2016)
/
- Обзоры
Никита Геннадьевич Никифоров
Научно-исследовательский институт атеросклероза, Сколково; Российский кардиологический научно-производственный комплекс, Москва; Научно-исследовательский институт общей патологии и патофизиологии, Москва
Н. В. Елизова
Научно-исследовательский институт атеросклероза, Сколково; Научно-исследовательский институт общей патологии и патофизиологии, Москва
Н. А. Никитина
НИИ физико-химической медицины, Москва
В. П. Карагодин
Российская экономическая академия им. Г.В. Плеханова, Москва
А. Н. Орехов
Научно-исследовательский институт атеросклероза, Сколково; Научно-исследовательский институт общей патологии и патофизиологии, Москва
Ключевые слова:
атеросклероз, макрофаги, моноциты, активация, воспаление, липопротеиды, липиды
Аннотация
При атеросклерозе макрофаги проявляют пластичность фенотипа, а также способны быстро реагировать на изменения в микроокружении. Липиды сыворотки крови, липопротеиды и различные стимулирующие факторы, такие как цитокины, хемокины, другие малые биологически активные молекулы, могут существенно влиять на фенотип макрофагов и вызывать про- или противовоспалительную активацию клеток. Динамика пластичности макрофагов обеспечивается путем активации или подавления транскрипционных факторов, ответственных за поляризацию макрофагов. Понимание механизмов пластичности макрофагов и разгадка функциональных характеристик фенотипов макрофагов поможет в разработке новых подходов в лечении хронического воспаления при сердечно-сосудистых заболеваниях.
Скачивания
Данные скачивания пока не доступны.

Как цитировать
Никифоров Н. Г., Елизова Н. В., Никитина Н. А., Карагодин В. П., Орехов А. Н. Активация макрофагов при атеросклерозе. Сообщение 2: факторы, влияющие на активацию макрофагов // Патологическая физиология и экспериментальная терапия. 2016. Т. 60. № 1. С. 59-64.
Наиболее читаемые статьи этого автора (авторов)
- Никита Геннадьевич Никифоров,
Всеволод Юрьевич Макеев,
Наталья Владимировна Елизова,
Александр Николаевич Орехов,Активируемость моноцитов человека при атеросклерозе
,Патологическая физиология и экспериментальная терапия: Том 59 № 3 (2015)
- Никита Геннадьевич Никифоров,
Владимир Юрьевич Корниенко,
Василий Петрович Карагодин,
Александр Николаевич Орехов,Активация макрофагов при атеросклерозе. Сообщение 1: активация макрофагов в норме и в атеросклеротическом поражении.
,Патологическая физиология и экспериментальная терапия: Том 59 № 3 (2015)
1. Гиперхолестеринемия
– патологически высокая концентрация
холестерина в плазме крови
2. Липопротеины:
низкой плотности (ЛПНП)
промежуточной
плотности (ЛППП)
ß-
липопротеины очень низкой плотности
(ß ЛПОНП)
окисленные
ЛПНП (ок. ЛПНП)
хиломикроны
очень низкой плотности (ЛПОНП)
высокой
плотности (ЛПВП)
Строго определённые
ЛП способны аккумулироваться в сосудистой
стенке и это приводит к атеросклерозу
(АТ) Т.о., ЛП делят на: атерогенные,
неатерогенные, антиатерогенные
Атерогенные ЛП:
ЛПНП
ЛППП
ß
ЛПОНП
ок.
ЛПНП
Неатерогенные
ЛП: хиломикроны
ЛПОНП
Антиатерогенные
ЛП: ЛПВП
3. Пенистые
клетки –
макрофаги сосудистой стенки, которые
захватывают атерогенные ЛП. Внутри
макрофагов ЛП не уничтожаются → имеет
место незавершенный фагоцитоз → макрофаг
становится активированным. Т.о. пенистые
клетки – это активированные макрофаги
сосудистой стенки, насыщенные ЛП.
4. Рецепторы –
«чистильщики» («мусорщики») – это
рецепторы на поверхности макрофагов,
которые распознают атерогенные ЛП. Их
называют «чистильщиками» и «мусорщиками»
потому, что атерогенные ЛП являются в
некотором роде «мусором» для организма
и подлежат уничтожению, растворению.
Атеросклероз
– отложение в интиме сосудов атерогенных
ЛП низкой плотности в результате
взаимодействия гладкомышечных клеток
сосудистой стенки с атерогенными ЛП
при их высокой концентрации в циркулирующей
крови.
Слово «атере»
(греч.) – «кашица», указывает на образование
в стенках сосудов кашицеобразных
липидных отложений с их дальнейшим
склерозированием и уплотнением..
ВОЗ: «Атеросклероз»
— вариабельная комбинация изменений
внутренней оболочки (интимы) артерий,
включающая накопление липидов, углеводов,
фиброзной ткани, компонентов крови,
кальцификацию и сопутствующие изменения
средней оболочки (медии).
Причина
атеросклероза: наследственные
расстройства липидного обмена: по
аутосомно-доминантному типу наследуется
недостаточность ЛПНП-рецепторов к
атерогенным ЛП и холестерину.
Предрасполагающие
факторы —
все они способны нарушать барьерную
функцию эндотелия: 1) гиперхолестеринемия;
2) гиперлипидемия; 3) артериальная
гипертензия;4) гормональная дисфункция;
5) изменение реологии крови; 6) курение;
7) диабет.
Теории
происхождения:1)
в ответ на повреждение эндотелия; 2)
моноклональная.
Наибольшее признание
получила теория № 1. Согласно этой
теории, атеросклеротическая бляшка
формируется на месте первичного
повреждения интимы.
Патогенез атеросклероза:
Аккумуляция в
сосудистой стенке атерогенных
липопротеинов
↓
Эндоцитоз атерогенных
ЛП макрофагами и «образование пенистых
клеток»
↓
Отложение аморфного
холестерина в сосудистой стенке вне
«пенистых клеток»
↓
«Пенистые клетки»
высвобождают вещества:
Активаторы ↓ Миграция в очаг | Факторы роста ↓ а) миграция в б) миграция и в) образование |
↓
Образование жировых
полосок – это начальный момент
формирования атероматозной бляшки.
Жировая полоска состоит из пенистых
клеток, аморфного холестерина,
Т-лимфоцитов, небольшого количества
гладкомышечных клеток
↓
Образование
диффузных утолщений интимы – на
предыдущие изменения накладывается
интенсивная миграция и размножение
гладкомышечных элементов сосудистой
стенки.
↓
Образование
атероматозной бляшки – в ее составе
лейкоциты, холестерин, др. липиды,
гладкомышечные клетки, межклеточное
вещество интимы артерий, пенистые
клетки.
Раньше считали,
что атеросклероз возникает в результате
пропитывания холестерином и триглицеридами
сосудистой стенки. Сейчас:атеросклероз
возникает в результате аккумуляции в
сосудистой стенке атерогенных
липопротеинов. Именно атерогенные
липопротеины переносят в интиму из
плазмы холестерин и триглицериды.
Итак: к
атеросклерозу приводит не гиперхолестеринемия,
а накопление в сосудистой стенке
атерогенных липопротеинов.
Патогенетическая
значимость атеросклероза: это
наиболее распространенная причина для
нарушения функций сердца и сосудов.
Соседние файлы в папке Lektsii
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Активация макрофагов. Механизмы
Активация — самый важный этап функционального созревания макрофагов. Активирующим действием обладают определенные цитокины — белковые соединения, которые осуществляют передачу сигнала между клетками и тем самым влияют на процесс воспаления или иммунный ответ. К этим цитокинам относятся интерфероны, интерлейкины, ростовые факторы, хемокины и ФНО. Те из них, которые активируют макрофаги, включают ИФН-у, ГМ-КСФ, М-КСФ и ФНО-а.
Активируют макрофаги также гормон роста и бактериальный эндотоксин или белки клеточной стенки. Термин «активированный макрофаг» в самом широком смысле означает, что он обладает повышенной способностью убивать микроорганизмы или опухолевые клетки. После активации макрофаги становятся крупнее, у них увеличивается число псевдоподий, а плазматическая мембрана приобретает бо, льшую складчатость.
Интенсивные функции активированных макрофагов:
• Бактерицидная активность.
• Противоопухолевая активность.
• Хемотаксис.
• Фагоцитоз (большинства частиц).
• Пиноцитоз.
• Транспорт и метаболизм глюкозы.
• Сопровождающая фагоцитоз продукция свободных радикалов (О2, Н2О2).
• Образование оксида азота.
• Представление антигенов.
• Секреция:
— компонентов комплемента;
— лизоцима;
— кислых гидролаз;
— коллагеназы;
— активатора плазминогена;
— цитолитической протеазы;
— аргиназы;
— фибронектина;
— интерлейкинов (ИЛ-1, ИЛ-10, ИЛ-12, ИЛ-15);
— ФНО-а;
— ИФН-а и -b.
• Факторы ангиогенеза.
Активация макрофагов при инфекции происходит путем взаимодействия их поверхностной молекулы CD40 с лигандом CD40 на сенсибилизированных антигеном Th-клетках, а также вследствие действия цитокинов, продуцируемых этими лимфоцитами. Активированные макрофаги выделяют ИЛ-12, который, в свою очередь, активирует Т-лимфоциты. Эти взаимодействия составляют основу клеточного иммунитета.
Особенно важный активирующий макрофаги цитокин, ИФН-у, используют в настоящее время для профилактики инфекций у больных с хронической гранулематозной болезнью и для лечения врожденного остеопетроза (замедления резорбции костей), связанного со снижением функции остеокластов.
При воздействии эндотоксина или других медиаторов воспаления макрофаги выделяют ФНО-а, который активирует другие макрофаги. Активированные макрофаги экспрессируют большее число рецепторов ФНО-а. Таким образом, макрофаги в очагах воспаления приобретают способность активировать друг друга и тем самым осуществлять свои функции быстрее, чем при классическом клеточном иммунном ответе, который требует накопления сенсибилизированных Т-лимфоцитов.
С другой стороны, макрофаги, как и Th-клетки, секретируют ИЛ-10, ингибирующий продукцию ИФН-у и тормозящий потенциально опасные последствия неконтролируемой активации макрофагов.
— Также рекомендуем «Функции и значение макрофагов»
Оглавление темы «Клетки иммунной системы»:
- Механизмы созревания нейтрофилов. Дифференцировка нейтрофилов
- Значение нейтрофилов. Механизмы фагоцитоза
- Мононуклеары: моноциты и макрофаги
- Активация макрофагов. Механизмы
- Функции и значение макрофагов
- Нарушения функции моноцитов и макрофагов иммунитета
- Функции и значение эозинофилов
- Причины эозинофилии. Гиперэозинофильный синдром
- Нарушения функции фагоцитов. Генетические причины недостаточности адгезии лейкоцитов
- Клиника и лечение недостаточности адгезии лейкоцитов — НАЛ
Сто тридцать лет назад замечательный русский исследователь И.И. Мечников в опытах на личинках морских звезд из Мессинского пролива сделал удивительное открытие, круто изменившее не только жизнь самого будущего Нобелевского лауреата, но и перевернувшее тогдашние представления об иммунной системе.
Втыкая в прозрачное тело личинки розовый шип, ученый обнаружил, что занозу окружают и атакуют крупные амебоидные клетки. И если чужеродное тело было небольшим, эти блуждающие клетки, которые Мечников назвал фагоцитами (от греч. пожиратель), могли полностью поглотить пришельца.
Долгие годы считалось, что фагоциты выполняют в организме функции «войск быстрого реагирования». Однако исследования последних лет показали, что благодаря своей огромной функциональной пластичности эти клетки еще и «определяют погоду» многих метаболических, иммунологических и воспалительных процессов, как в норме, так и при патологии. Это делает фагоциты перспективной мишенью при разработке стратегии лечения ряда тяжелых заболеваний человека
Подвижные клетки иммунной системы – фагоциты или макрофаги, присутствуют практически во всех тканях организма. Они осуществляют активный захват, переваривание и обезвреживание чужеродных микроорганизмов (вирусов, бактерий, одноклеточных, паразитов), а также утилизацию биологического «мусора», такого как «невостребованные» и погибшие клетки (например, «стареющие» эритроциты).
В зависимости от своего микроокружения тканевые макрофаги могут выполнять и различные специализированные функции. Например, макрофаги костной ткани – остеокласты, также занимаются выведением из кости гидроксиапатита кальция. При недостаточности этой функции развивается мраморная болезнь – кость становится чрезмерно уплотненной и при этом хрупкой.
Но самым, пожалуй, удивительным свойством макрофагов оказалась их огромная пластичность, т. е. способность изменять свою транскрипционную программу («включение» тех или иных генов) и свой облик (фенотип). Следствием этой особенности является высокая разнородность клеточной популяции макрофагов, среди которых присутствуют не только «агрессивные» клетки, встающие на защиту организма-хозяина; но и клетки с «полярной» функцией, отвечающие за процессы «мирного» восстановления поврежденных тканей.
Липидные «антенны»
Своей потенциальной «многоликостью» макрофаг обязан необычной организации генетического материала – так называемому открытому хроматину. Этот не до конца изученный вариант структуры клеточного генома обеспечивает быстрое изменение уровня экспрессии (активности) генов в ответ на различные стимулы.
Выполнение макрофагом той или иной функции зависит от характера получаемых им стимулов. Если стимул будет распознан как «чужой», то происходит активация тех генов (и соответственно функций) макрофага, которые направлены на уничтожение «пришельца». Однако макрофаг могут активировать и сигнальные молекулы самого организма, которые побуждают эту иммунную клетку участвовать в организации и регуляции обмена веществ. Так, в условиях «мирного времени», т. е. при отсутствии патогена и обусловленного им воспалительного процесса, макрофаги участвуют в регуляции экспрессии генов, отвечающих за метаболизм липидов и глюкозы, дифференцировку клеток жировой ткани.
Интеграция между взаимоисключающими «мирным» и «военным» направлениями работы макрофагов осуществляется путем изменения активности рецепторов клеточного ядра, представляющих собой особую группу регуляторных белков.
Среди этих ядерных рецепторов следует особо выделить так называемые липидные сенсоры, т. е. белки, способные взаимодействовать с липидами (например, окисленными жирными кислотами или производными холестерина) (Смирнов, 2009). Нарушение работы этих чувствительных к липидам регуляторных белков в макрофагах может быть причиной системных обменных нарушений. Например, дефицит в макрофагах одного из этих ядерных рецепторов, обозначаемых как PPAR-гамма, приводит к развитию диабета 2 типа и дисбалансу липидного и углеводного обмена во всем организме.
Клеточные метаморфозы
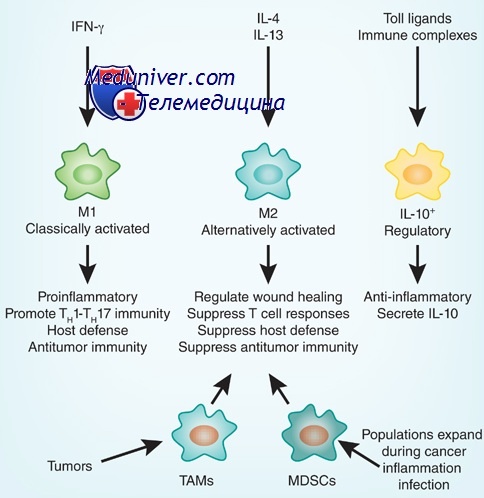
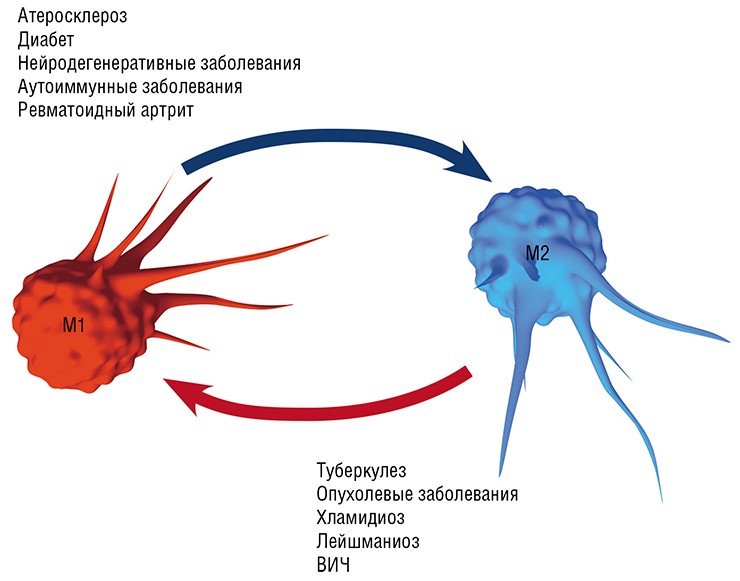
В разнородном сообществе макрофагов на основе базовых характеристик, определяющих их принципиальные функции, выделяют три основных клеточных субпопуляции: макрофаги М1, М2 и Мox, которые участвуют, соответственно, в процессах воспаления, восстановления поврежденных тканей, а также защите организма от окислительного стресса.
«Классический» макрофаг М1 формируется из клетки-предшественника (моноцита) под действием каскада внутриклеточных сигналов, запускающихся после распознавания инфекционного агента с помощью специальных рецепторов, расположенных на поверхности клетки.
Образование «пожирателя» М1 происходит в результате мощной активации генома, сопровождаемой активацией синтеза более чем сотни белков – так называемых факторов воспаления. К ним относятся ферменты, способствующие генерации свободных радикалов кислорода; белки, привлекающие в очаг воспаления другие клетки иммунной системы, а также белки, способные разрушать оболочку бактерий; воспалительные цитокины – вещества, обладающие свойствами активировать иммунные клетки и оказывать токсическое действие на остальное клеточное окружение. В клетке активируется фагоцитоз и макрофаг начинает активно разрушать и переваривать все, что встретится на его пути (Шварц, Свистельник, 2012). Так появляется очаг воспаления.
Однако уже на начальных этапах воспалительного процесса макрофаг М1 начинает активно секретировать и противовоспалительные субстанции – низкомолекулярные липидные молекулы. Эти сигналы «второго эшелона» начинают активировать вышеупомянутые липидные сенсоры в новых «рекрутах»-моноцитах, прибывающих в очаг воспаления. Внутри клетки запускается цепь событий, в результате которых активирующий сигнал поступает на определенные регуляторные участки ДНК, усиливая экспрессию генов, отвечающих за гармонизацию обмена веществ и одновременно подавляя активность «провоспалительных» (т. е. провоцирующих воспаление) генов (Душкин, 2012).
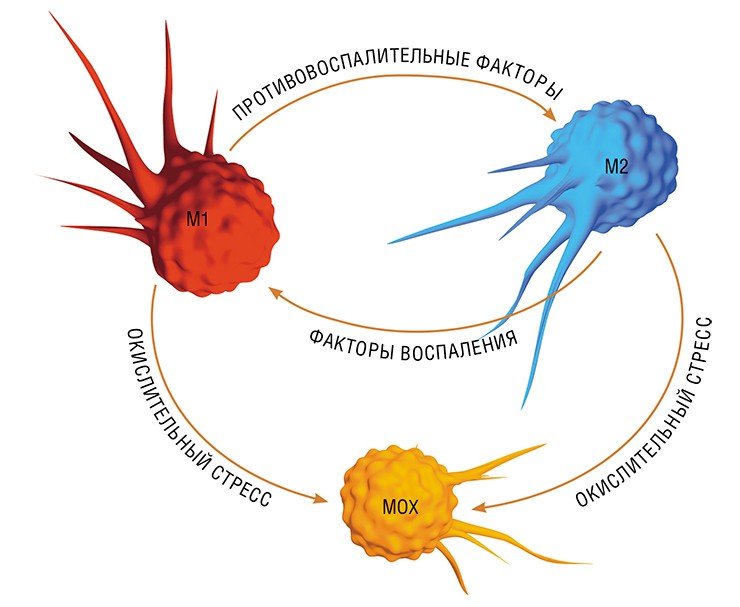
Так в результате альтернативной активации образуются макрофаги М2, которые завершают воспалительный процесс и способствуют тканевому восстановлению. Популяцию М2 макрофагов можно, в свою очередь, разделить на группы в зависимости от их специализации: уборщики мертвых клеток; клетки, участвующие в реакции приобретенного иммунитета, а также макрофаги, секретирующие факторы, которые способствуют замещению погибших тканей соединительной тканью.
Еще одна группа макрофагов – Мох, формируется в условиях так называемого окислительного стресса, когда в тканях возрастает опасность повреждения их свободными радикалами. Например, Мох составляют около трети всех макрофагов атеросклеротической бляшки. Эти иммунные клетки не только сами устойчивы к повреждающим факторам, но и участвуют в антиоксидантной защите организма(Gui et al., 2012).
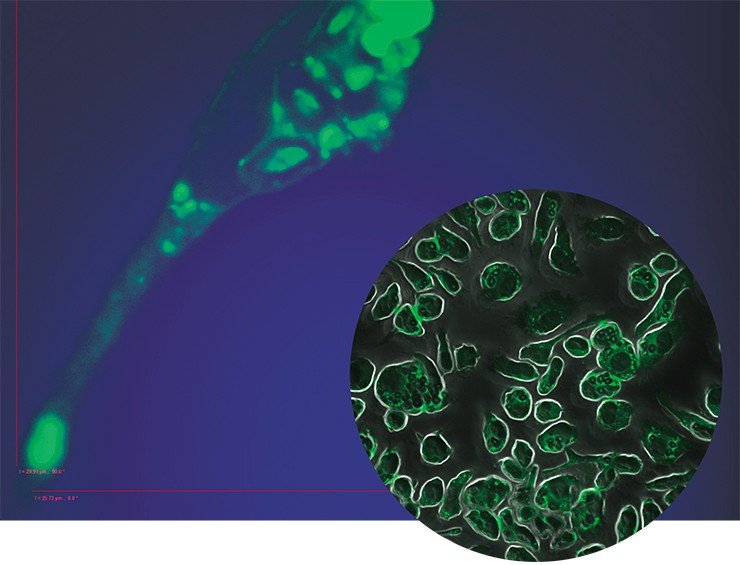
Пенистый камикадзе
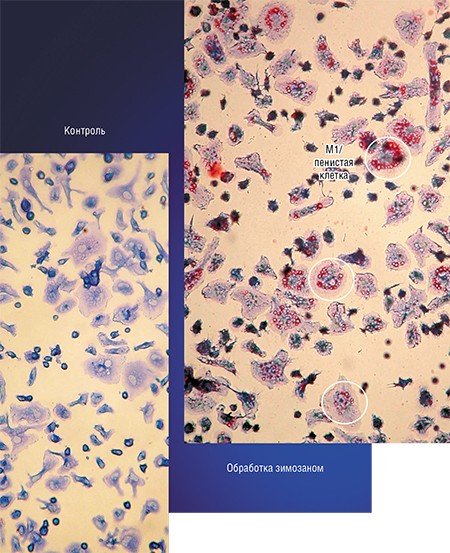
Одной из самых интригующих метаморфоз макрофага является его превращение в так называемую пенистую клетку. Такие клетки были обнаружены в атеросклеротических бляшках, а свое название получили из-за специфического внешнего вида: под микроскопом они напоминали мыльную пену. По сути, пенистая клетка – это тот же макрофаг М1, но переполненный жировыми включениями, преимущественно состоящими из водонерастворимых соединений холестерина и жирных кислот.
Была высказана гипотеза, ставшая общепринятой, что пенистые клетки образуются в стенке атеросклеротических сосудов в результате неконтролируемого поглощения макрофагами липопротеинов низкой плотности, переносящих «плохой» холестерин. Однако впоследствии было обнаружено, что накопление липидов и драматическое (в десятки раз!) возрастание скорости синтеза ряда липидов в макрофагах можно спровоцировать в эксперименте только лишь одним воспалением, без всякого участия липопротеинов низкой плотности (Душкин, 2012).
Это предположение подтвердилось клиническими наблюдениями: оказалось, что превращение макрофагов в пенистую клетку происходит при разнообразных заболеваниях воспалительной природы: в суставах – при ревматоидном артрите, в жировой ткани – при диабете, в почках – при острой и хронической недостаточности, в ткани мозга – при энцефалитах. Однако понадобилось около двадцати лет исследований, чтобы понять, как и зачем макрофаг при воспалении превращается в клетку, нафаршированную липидами.
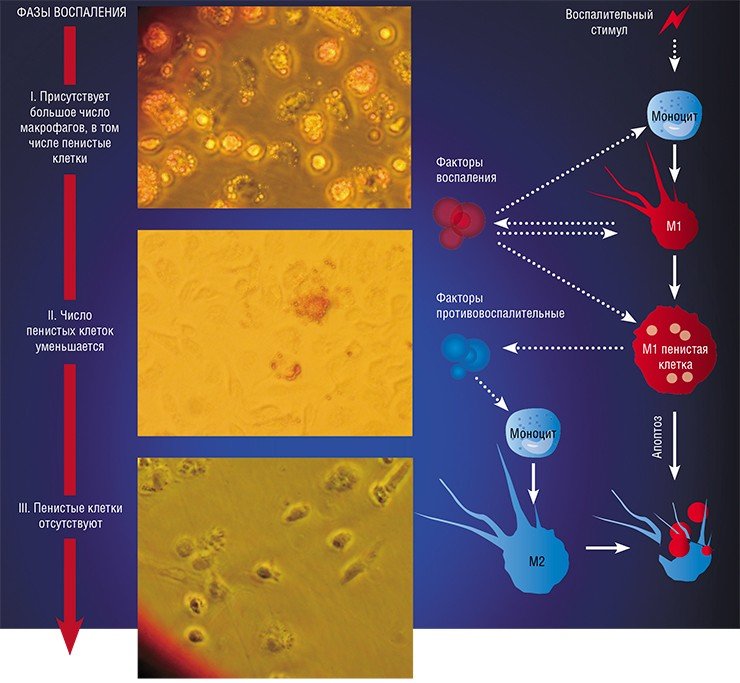
Оказалось, что активация провоспалительных сигнальных путей в М1 макрофагах приводит к «выключению» тех самых липидных сенсоров, которые в нормальных условиях контролируют и нормализуют липидный обмен (Душкин, 2012). При их «выключении» клетка и начинает накапливать липиды. При этом образующиеся липидные включения представляют собой вовсе не пассивные жировые резервуары: входящие в их состав липиды обладают способностью усиливать воспалительные сигнальные каскады. Главная цель всех этих драматических изменений – любыми средствами активировать и усилить защитную функцию макрофага, направленную на уничтожение «чужих» (Melo, Drorak, 2012).
Однако высокое содержание холестерина и жирных кислот дорого обходится пенистой клетке – они стимулируют ее гибель путем апоптоза, запрограммированной клеточной смерти. На внешней поверхности мембраны таких «обреченных» клеток обнаруживается фосфолипид фосфатидилсерин, в норме расположенный внутри клетки: появление его снаружи является своеобразным «похоронным звоном». Это сигнал «съешь меня», который воспринимают М2 макрофаги. Поглощая апоптозные пенистые клетки, они начинают активно секретировать медиаторы заключительной, восстановительной стадии воспаления.
Фармакологическая мишень
Воспаление как типовой патологический процесс и ключевое участие в нем макрофагов является, в той или иной мере, важной составляющей в первую очередь инфекционных заболеваний, вызванных различными патологическими агентами, от простейших и бактерий до вирусов: хламидиальные инфекции, туберкулез, лейшманиоз, трипаносомоз и др. Вместе с тем макрофаги, как уже упоминалось выше, играют важную, если не ведущую, роль в развитии так называемых метаболических заболеваний: атеросклероза (главного виновника сердечно-сосудистых заболеваний), диабета, нейродегенеративных заболеваний мозга (болезнь Альцгеймера и Паркинсона, последствия инсультов и черепно-мозговых травм), ревматоидного артрита, а также онкологических заболеваний.
Разработать стратегию управления этими клетками при различных заболеваниях позволили современные знания о роли липидных сенсоров в формировании различных фенотипов макрофага.
Так, оказалось, что в процессе эволюции хламидии и туберкулезные палочки научились использовать липидные сенсоры макрофагов, чтобы стимулировать не опасную для них альтернативную (в М2) активацию макрофагов. Благодаря этому поглощенная макрофагом туберкулезная бактерия может, купаясь как сыр в масле в липидных включениях, спокойно дожидаться своего освобождения, а после гибели макрофага размножаться, используя содержимое погибших клеток в качестве пищи (Melo, Drorak, 2012).
Если в этом случае использовать синтетические активаторы липидных сенсоров, которые препятствуют образованию жировых включений и, соответственно, предотвращают «пенистую» трансформацию макрофага, то можно подавить рост и понизить жизнеспособность инфекционных патогенов. По крайней мере в экспериментах на животных уже удалось в разы снизить обсемененность легких мышей туберкулезными бациллами, используя стимулятор одного из липидных сенсоров или ингибитор синтеза жирных кислот (Lugo-Villarino et al., 2012).
 Еще один пример – такие болезни, как инфаркт миокарда, инсульт и гангрена нижних конечностей, опаснейшие осложнения атеросклероза, к которым приводит разрыв так называемых нестабильных атеросклеротических бляшек, сопровождаемый моментальным образованием тромба и закупоркой кровеносного сосуда.
Еще один пример – такие болезни, как инфаркт миокарда, инсульт и гангрена нижних конечностей, опаснейшие осложнения атеросклероза, к которым приводит разрыв так называемых нестабильных атеросклеротических бляшек, сопровождаемый моментальным образованием тромба и закупоркой кровеносного сосуда.
Формированию таких нестабильных атеросклеротических бляшек и способствует макрофаг М1/пенистая клетка, который продуцирует ферменты, растворяющие коллагеновое покрытие бляшки. В этом случае наиболее эффективная стратегия лечения – превращение нестабильной бляшки в стабильную, богатую коллагеном, для чего требуется трансформировать «агрессивный» макрофаг М1 в «умиротворенный» М2.
Экспериментальные данные свидетельствуют, что подобной модификации макрофага можно добиться, подавляя в нем продукцию провоспалительных факторов. Такими свойствами обладает ряд синтетических активаторов липидных сенсоров, а также природные вещества, например, куркумин – биофлавоноид, входящий в состав корня куркумы, хорошо известной индийской пряности.
Нужно добавить, что такая трансформация макрофагов актуальна при ожирении и диабете 2 типа (большая часть макрофагов жировой ткани имеет М1 фенотип), а также при лечении нейродегенеративных заболеваний мозга. В последнем случае в мозговых тканях происходит «классическая» активация макрофагов, что приводит к повреждению нейронов и накоплению токсичных веществ. Превращение М1-агрессоров в мирных дворников М2 и Mox, уничтожающих биологический «мусор», может в ближайшее время стать ведущей стратегией лечения этих заболеваний (Walace, 2012).
С воспалением неразрывно связано и раковое перерождение клеток: например, имеются все основания считать, что 90 % опухолей в печени человека возникает как следствие перенесенных инфекционных и токсических гепатитов. Поэтому с целью профилактики раковых заболеваний необходимо контролировать популяцию М1 макрофагов.
Однако не все так просто. Так, в уже сформированной опухоли макрофаги преимущественно приобретают признаки статуса М2, который содействует выживанию, размножению и распространению самих раковых клеток. Более того, такие макрофаги начинают подавлять противораковый иммунный ответ лимфоцитов. Поэтому для лечения уже образовавшихся опухолей разрабатывается другая стратегия, основанная на стимулировании у макрофагов признаков классической М1-активации (Solinas et al., 2009).
Примером такого подхода служит технология, разработанная в новосибирском Институте клинической иммунологии СО РАМН, при которой макрофаги, полученные из крови онкобольных, культивируют в присутствии стимулятора зимозана, который накапливается в клетках. Затем макрофаги вводят в опухоль, где зимозан освобождается и начинает стимулировать классическую активацию «опухолевых» макрофагов.
Сегодня становится все более очевидно, что соединения, вызывающие метаморфозы макрофагов, оказывают выраженное атеропротективное, антидиабетическое, нейропротективное действие, а также защищают ткани при аутоиммунных заболеваниях и ревматоидном артрите. Однако такие препараты, имеющиеся на сегодня в арсенале практикующего врача, – фибраты и производные тиазолидона, хотя и снижают смертность при этих тяжелых заболеваниях, но при этом имеют выраженные тяжелые побочные действия.
Эти обстоятельства стимулируют химиков и фармакологов к созданию безопасных и эффективных аналогов. За рубежом – в США, Китае, Швейцарии и Израиле уже проводятся дорогостоящие клинические испытания подобных соединений синтетического и природного происхождения. Несмотря на финансовые трудности, российские, в том числе и новосибирские, исследователи также вносят свой посильный вклад в решение этой проблемы.
Так, на кафедре химии Новосибирского государственного университета было получено безопасное соединение TS-13, стимулирующее образование Мox фагоцитов, которое обладает выраженным противовоспалительным эффектом и оказывает нейропротективное действие в экспериментальной модели болезни Паркинсона (Дюбченко и др., 2006; Зенков и др., 2009).
В Новосибирском институте органической химии им. Н. Н. Ворожцова СО РАН созданы безопасные антидиабетические и противоатеросклеротические препараты, действующие сразу на несколько факторов, благодаря которым «агрессивный» макрофаг М1 превращается в «мирный» М2 (Dikalov et al., 2011). Большой интерес вызывают и растительные препараты, получаемые из винограда, черники и других растений с помощью механохимической технологии, разработанной в Институте химии твердого тела и механохимии СО РАН (Dushkin, 2010).
С помощью финансовой поддержки государства можно в самое ближайшее время создать отечественные средства для фармакологических и генетических манипуляций с макрофагами, благодаря которым появится реальная возможность превращать эти иммунные клетки из агрессивных врагов в друзей, помогающих организму сохранить или вернуть здоровье.
Литература
Душкин М. И. Макрофаг/пенистая клетка как атрибут воспаления: механизмы образования и функциональная роль // Биохимия, 2012. T. 77. C. 419—432.
Смирнов А. Н. Липидная сигнализация в контексте атерогенеза // Биохимия. 2010. Т. 75. С. 899—919.
Шварц Я. Ш., Свистельник А. В.Функциональные фенотипы макрофагов и концепция М1-М2-поляризации. Ч. 1 Провоспалительный фенотип. // Биохимия. 2012. Т. 77. С. 312—329.


